丹皮酚脂质体的研制及其体外释放研究
贾献慧, 唐文照, 闫 军
(1.山东省医学科学院药物研究所,山东省现代医用药物与技术重点实验室,山东济南 250062;2.济南市皮肤病防治院,山东济南 250001)
丹皮酚(paeonol)是中药牡丹皮的主要活性成分,具有抗炎、抗菌、抗变态反应、免疫调节、镇痛等[1-4]药理作用,现已广泛用于常见皮肤病治疗,能抑制黑色素细胞内酪氨酸酶的活性及黑色素的生成,对色斑、皮肤瘙痒、牛皮癣、带状疱疹、湿疹等具有较好的治疗作用[4-5]。已知剂型主要有软膏剂、贴剂、注射剂等。丹皮酚在水中的溶解度很低且易升华,见光易氧化分解,影响其使用和疗效。我们将其制成脂质体凝胶,局部涂抹治疗皮炎、湿疹等,是种新剂型。制成脂质体凝胶,因脂质体优良的生物相容性可将不易溶于水的药物包裹于其中,携带进入皮肤,增加透皮效果,并能提高药物的稳定性,增强疗效[6]。
本实验主要对丹皮酚脂质体进行研究,对丹皮酚脂质体不同制备方法进行了考察,筛选出了合适的制备方法,并对制备的的丹皮酚脂质体进行了相关研究。
1 试验材料
1.1 药品与试剂 丹皮酚(泰安中荟植物生化有限公司);大豆卵磷脂(上海楷洋生物技术有限公司);胆固醇(中国医药集团上海化剂公司);维生素E(山东省医科院药物所仲浩惠赠);丹皮酚对照品(中国药品生物制品检定所);鱼精蛋白(上海第一生化药业有限公司);CE型高精度透析袋(上海绿鸟科技发展有限公司);MeOH、CH2Cl2为分析纯;蒸馏水为新鲜自制。
1.2 仪器 AG245型电子天平(瑞士Mettler Toledu公司);R200真空旋转蒸发仪(瑞士BüCHI公司);U-3000型紫外-可见分光光度计(日本 HITACHI公司);LDZ5-2型台式低速自动平衡离心机(北京医用离心机厂);85-2型磁力加热搅拌器(金坛市江南仪器厂);ZETASIZER3000粒度分布与电势分析仪(英国Malvern公司);JEM-1200EX透射电镜(日本电子);ZRS-8G型智能溶出试验仪(天津大学无线电厂)。
2 试验方法
2.1 应用不同制备工艺制备丹皮酚脂质体[7-10]
2.1.1 薄膜-超声法 分别按处方量称取丹皮酚、大豆卵磷脂、胆固醇及维生素E,加入CH2Cl2溶解,置旋转蒸发仪上40℃减压干燥成膜。加pH 6.5磷酸盐缓冲液,振摇并超声使之分散均匀,依次过0.80、0.45 μm微孔滤膜各3次进行整粒,即得。
2.1.2 乙醇注入法 分别按处方量称取丹皮酚等脂质,加入无水乙醇超声使溶解,得到混悬液。取pH 6.5的磷酸盐缓冲液10 mL置三角烧瓶中,加入磁子,密封,置磁力加热搅拌器上搅拌,设定温度为40℃,将脂质的乙醇混悬液通过一注射针头,快速注入缓冲液中,得到悬浮液,将其依次过0.80、0.45 μm微孔滤膜进行整粒,即得。
2.1.3 乙醚注入法 分别按处方量称取丹皮酚等脂质,加入乙醚溶解。取pH 6.5的磷酸盐缓冲液置烧杯中,加入磁子,置磁力加热搅拌器上搅拌,设定温度为40℃,将脂质的乙醚溶液通过一注射针头,缓缓注入缓冲液中,得到悬浮液,将其依次过0.80、0.45 μm微孔滤膜进行整粒,即得。
2.1.4 逆相蒸发法 分别按处方量称取丹皮酚等脂质,加入CH2Cl2溶解后,加入pH6.5的磷酸盐缓冲液,振摇并超声使之分散成W/O型乳剂,置旋转蒸发仪上40℃减压蒸发除去溶剂,到达胶态后,再加pH6.5磷酸盐缓冲液,旋转蒸发使器壁上的凝胶脱落,继续减压蒸发得到混悬液,将其依次过0.80、0.45 μm微孔滤膜进行整粒,即得。
2.1.5 二次乳化法 分别按处方量称取丹皮酚等脂质,加入CH2Cl2溶解后,加入pH 6.5的磷酸盐缓冲液,振摇并超声使之分散成W/O型乳剂,再加pH 6.5的磷酸盐缓冲液,振摇并超声使之分散成W/O/W型乳剂,置旋转蒸发仪上40℃减压蒸去溶剂,得混悬液,将其依次过0.80、0.45 μm微孔滤膜进行整粒。
2.2 对各脂质体进行质量考察
2.2.1 脂质体微观形态观察 取各脂质体适量,分别用pH 6.5的磷酸盐缓冲液稀释后,滴加在有支持膜的专用铜网上,用3%磷钨酸钠溶液染色后,自然晾干,在透射电镜下观察脂质体的形态。
2.2.2 脂质体粒度分布 取各脂质体适量,分别用pH 6.5的磷酸盐缓冲液稀释后,用ZETASIZER3000粒度分析仪进行测定,应用动态光散射软件进行数据处理,记录平均粒径及多分散性指数。
2.2.3 包封率的测定 采用鱼精蛋白法考察脂质体包封率。
丹皮酚含量测定采用紫外-可见分光光度法[11]。取丹皮酚对照品5 mg,精密称定,置50 mL量瓶中,加甲醇溶解、定容。分别从中精密量取0.5、1、1.5、2、2.5、3 mL 分别置 25 mL 量瓶中,定容,在274 nm处测定吸光度,绘制工作曲线,考察线性关系。
取脂质体混悬液摇匀,精密量取0.1 mL,分别置50 mL量瓶中,加甲醇溶解,测定脂质体中总药物的浓度。
取脂质体混悬液摇匀,精密量取0.1 mL,分别置于10 mL锥形离心管中,加入0.1 mL鱼精蛋白溶液(10 mg/mL),搅匀,静置3 min,再加3 mL生理盐水,在室温条件下2 000 g离心20 min。吸取2 mL上清液,测定游离药物的浓度。
以甲醇为空白,分别取丹皮酚脂质体各样品溶液,在274 nm处测定吸收度,并计算各制备工艺脂质体的包封率(Qw%)。
综合各脂质体的特性和包封率,确定合适的制备工艺制备丹皮酚脂质体。
2.3 丹皮酚脂质体的制备及质量考察 按优选的制备工艺制备丹皮酚脂质体,进行形态观察、粒径测定并测定其包封率。
2.4 丹皮酚脂质体体外释放研究[12]
丹皮酚混悬液的制备:精密称取丹皮酚细粉(过100目)40 mg,加pH 6.5磷酸盐缓冲液10 mL,超声使成混悬液,即得。
精密量取丹皮酚脂质体及丹皮酚混悬液各3份,每份0.1 mL,分别加甲醇至5 mL,振摇使溶解;再分别从中精密取出0.5 mL,加甲醇至5 mL。以甲醇为空白,在274 nm处测定吸光度,计算药物含量。
精密量取丹皮酚脂质体及丹皮酚混悬液各3份,每份0.5 mL,分别置于面积同样大小的高密度透析袋中,固定于溶出仪的搅拌浆上,pH 6.5磷酸盐缓冲液200 mL为释放介质,37℃,100 r/m条件下进行释放试验,丹皮酚混悬液及其脂质体分别于0.5、1、1.5、2、3、4、6、8、10、12、24 h 时取样,每次精密取样5.0 mL,同时补加同体积同温度的新鲜介质。将取出的样品溶液经0.8 μm滤膜滤过,即得供试品溶液。
取体外释放试验所得的样品溶液,以甲醇为空白,在274 nm处测定吸光度。计算各样品溶液中所含药物总量及释放度。
3 试验结果
3.1 不同制备工艺的脂质体质量考察
3.1.1 脂质体微观形态观察 由透射电镜照片可以看出,乙醚注入法制得的脂质体粒径差异较大,其余制备工艺所制的脂质体大多为粒径均一的圆球形结构,见图1。

图1 不同制备方法所得丹皮酚脂质体电镜图
3.1.2 脂质体粒度分布 各脂质体平均粒径及多分散性指数见表1。
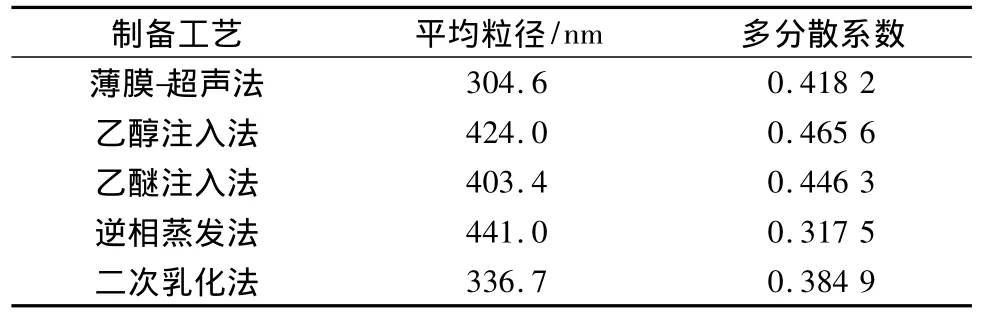
表1 不同制备工艺制得的脂质体粒径分析(n=3)
3.1.3 包封率的测定 丹皮酚溶液在2.14~12.84 μg/mL内,浓度与吸收度有着良好的线性关系,回归方程为y=0.097 7x-0.002 5,r=0.999 7。各制备工艺脂质体的包封率测定结果见表2。
结果表明,薄膜-超声法、逆相蒸发法、二次乳化法制备的脂质体包封率较高。考虑到薄膜-超声法制备的脂质体形状较为圆整、大小均匀,粒径分布较为合理,包封率较高,且操作较为简单方便,决定选用薄膜-超声法来制备丹皮酚脂质体。

表2不同制备工艺制备的丹皮酚脂质体包封率(n=3)
3.2 丹皮酚脂质体的的制备及质量考察
采用薄膜-超声法制备得到丹皮酚脂质体,并进行质量考察。
脂质体混悬液呈乳白色,分散较好。由透射电镜照片可以看出脂质体大多为粒径均一的圆球形结构,见图2;其平均粒径为359.3 nm,多分散性系数为0.435 7;丹皮酚脂质体包封率为71.55%。
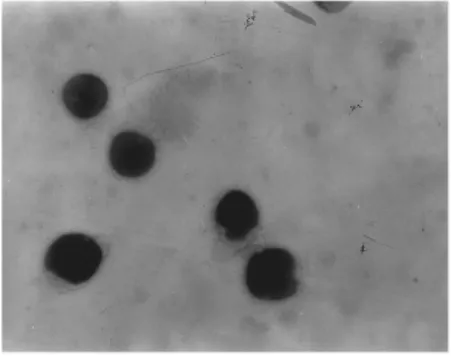
图2 丹皮酚脂质体电镜图(×10,000)
3.3 丹皮酚脂质体的体外释放
丹皮酚脂质体释放曲线见图3:
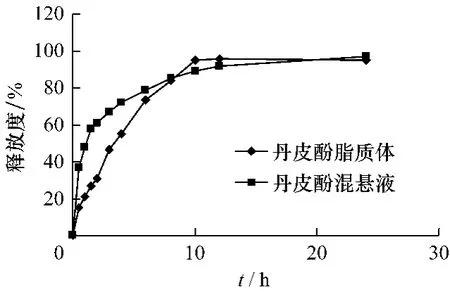
图3 丹皮酚脂质体和混悬液释放曲线(n=3)
可以看出,混悬液在1h时释放即接近50%,而脂质体只有20%左右的释放,脂质体明显具有缓释作用。两者在12 h时释放均达到90%左右。
4 讨论
包封率是衡量脂质体质量的一个重要指标,所以本文以包封率为主要指标来衡量不同的制备工艺。鱼精蛋白凝聚法是一种适应性较广的包封率测定方法,预试验时曾采用葡聚糖凝胶柱层析法来测定脂质体的包封率,比较繁琐、费时,后来选择鱼精蛋白法,简便快速,且重现性好。
应用薄膜-超声法制备丹皮酚脂质体,经查阅文献及预试验,曾以包封率为指标,对处方中大豆卵磷脂/胆固醇、大豆卵磷脂/丹皮酚以及维生素E用量进行了优选,得到最佳配比为大豆卵磷脂/胆固醇4∶1、大豆卵磷脂/丹皮酚10∶1、VE用量为0.1%。
报道,同时考虑到脂质体的体外释放过程比较繁琐且样品较多,故选用紫外-可见分光光度法来测定丹皮酚的含量,方法简单、方便、省时。
因磷脂结构中含有不饱和基团可以自发发生氧化,所以在脂质体处方中加入一定量的抗氧剂可以抑制自由基反应。考虑到VE除抗氧化外,还具有美白、抗衰老等功效,而我们的最终制剂是皮肤外用药,所以选择VE作为抗氧剂来抑制脂质体中磷脂等的氧化。在脂质体凝胶中则选择尼泊金乙酯作为抑菌剂,结果表明抑菌效果良好,脂质体凝胶放置半年后,无变质、变色、腐败等,稳定性良好。
参考文献:
[1]胡春弟,张 杰.丹皮酚的药理及合成研究进展[J].化学与生物工程,2009,26(8):16-18.
[2]刘爱敏,武海军,杨玉梅.丹皮酚的镇痛作用[J].包头医学院学报,2004,20(2):99-100.
[3]刘春云,武廷章.凤丹丹皮酚抗菌作用的研究[J].生物学杂志,2000,17(3):23-24.
[4]邢国胜,房德敏,周咏梅.丹皮酚的制备及药理作用研究进展[J].中草药,2006,37(11):附 2-7.
[5]解士海,陈志强.丹皮酚在体外对人黑素细胞酪氨酸酶活性及黑色素生成的影响[J].中华皮肤科学杂志,2006,39(11):639-641.
[6]江彬彬,曾 抗,吕红松.脂质体透皮吸收的研究进展[J].中国药房,2002,13(6):369-371.
[7]平其能,胡一桥,周建平,等.现代药剂学[M].北京:中国医药科技出版社,2001:588-612.
[8]邓英杰.脂质体技术[M].北京:人民卫生出版社,2007:10.
[9]贾献慧,唐文照,闫 军.氨苯砜脂质体的制备及其质量考察[J].中国新药杂志,2009,18(22):2179-2182.
[10]魏 铭,刘小平,李 惠,等.苦参碱脂质体的研究[J].武汉理工大学学报,2006,28(8):46-53.
[11]李世根,谢少玲,苏锡潭.丹皮酚凝胶的制备及质量控制[J].中国药房,2006,17(10):747-749.
[12]王晓东,闫 军,贾献慧,等.氨苯砜脂质体的制备及其体外释放考察[J].中国医院药学杂志,2010,30(1):50-53.

