同科植物SSR引物在烟草遗传差异分析中的应用研究
聂 琼,刘仁祥
(贵州大学烟草科学研究中心,贵阳 550025)
分子标记为研究作物遗传多样性及其品种改良提供了新的手段。在作物分子标记及其应用研究中,目前主要有RFLP、RAPD、SSR、SRAP、ISSR和AFLP标记等,这些都有效提高了作物遗传分析的效率和准确性。SSR是指由几个(多为2~4个)碱基组成的串联重复的 DNA序列,如(CA)n,(ATG)n, (TAGG)n等重复。其长度一般较短,广泛分布于基因组的不同位置。不同遗传材料重复次数的可变性导致了SSR长度的高度变异性。由于其操作简单、多态含量丰富、遗传信息量大、共显性及检测方便等特点,被认为是一种理想的遗传标记,已广泛应用于植物遗传多样性分析、遗传图谱构建、基因定位和分子标记辅助育种等研究领域。目前,在水稻、玉米、番茄、小麦、拟南芥、辣椒等植物中应用较多。烟草是一种重要的经济作物,也在科学研究中广泛应用,但是SSR标记在烟草上的应用,国内外报道较少。这是因为SSR标记技术应用的前提是特异物种的SSR引物的设计开发,其开发有一定难度,费用也较高,因此限制了SSR标记在烟草遗传分析上的发展。针对烟草的SSR标记引物开发工作,直到2007年初,Bindler等进行了首次报道[1],目前国内此类报道还较少。
本研究将同科植物的SSR引物应用于烟草,同时对其在烟草品种资源中的应用进行探讨,这对于加速烟草种质资源遗传多样性的研究利用、丰富其分子标记类型与绘制遗传图谱具有重要的意义。
1 材料与方法
1.1 材料
用于筛选引物的烟草材料14份(表1),包括烤烟、雪茄烟、白肋烟、晒晾烟、香料烟和野生种。用于遗传多样性分析的烤烟品种(系)24份(表2)。
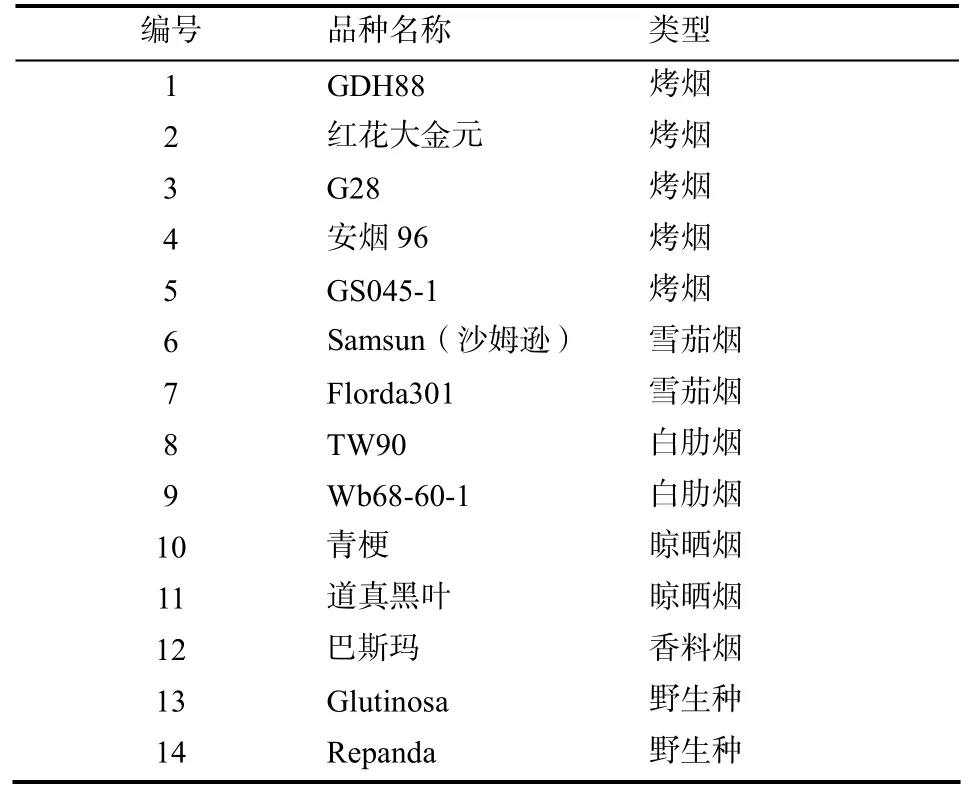
表1 供试材料Table1 The test materials
1.2 方法
1.2.1 烟草基因组 DNA 提取 采用 CTAB 高盐沉淀法[2]。
1.2.2 SSR标记分析 扩增反应在 Eppendorf-PC5331型PCR仪上进行,采用10 μL体系进行扩增,其中含10 ng模板DNA,2×Taq PCR MasterMix 5 μL(北京 TIANGEN),引物浓度为 0.5 μmol/L。扩增程序为:预变性94 ℃ 4 min,94 ℃变性40 s,56 ℃退火40 s(退火温度根据引物调整),72 ℃延伸1 min,共35个循环,最终72 ℃ 延伸7 min。SSR引物序列(表3)选自文献[3-4],由上海生物工程有限公司合成。扩增产物经10%的聚丙烯酰胺凝胶电泳银染检测。
1.2.3 数据处理 SSR 扩增带形以0和1统计,建立数据库。在相同迁移率位置上,有带记为 1,无带记为0。计算引物多态信息量(PIC),PIC= 1-ΣPi2,Pi表示第i个等位位点出现的频率。按Nei等(1979)的方法[5]计算任意两个品种的相似系数(GS):GS=2Nij(Ni+Nj),其中,Ni和 Nj分别为 i和j两份材料总的等位基因数,Nij为i和j两材料的共有等位基因数,遗传相异系数(GD)=1-GS,利用DPS 软件,采用GD值按不加权成对群算数平均法(UPGMA)进行聚类分析,构建分子进化系统树状图。
2 结 果
2.1 引物筛选
选取 5个类型 14个遗传差异大的烟草材料DNA为模板,从22对SSR引物中筛选到多态性、重复性、稳定性都较好的8对引物,引物多态性见表4。其中9号引物的电泳谱带清晰可见,且不同品种的条带不同,多态性为 100%(图1)。8对引物共检测到72条谱带,60条遗传多态性带,多态性条带数比率达83.33%,扩增片断长度为80~500 bp,每对引物扩增的多态性带数目为4~14个,平均7.5条;引物多态信息量变化范围为0.714~1,平均 0.811。这表明,这些引物在检测烟草基因组遗传多态性上有较显著的检出效率,可以用于烟草SSR图谱的检测,并可进行烟草遗传多样性分析和指纹图谱的构建。

表2 供试材料编号、 名称及来源Table2 Code, name and origins of tobacco germplasms

表3 SSR 引物编号、序列及来源Table3 SSR primers’ codes, sequences and origins
2.2 SSR引物对烤烟品种(系)遗传多态性分析
应用筛选出的8对引物对24份烤烟品种(系)进行SSR扩增,8对引物共检测到98个位点,其中 66个具有遗传多态性,每对引物扩增的多态性带数目为5~16个,平均8.2个,引物多态信息量变化范围为 0.451~1,平均 0.646。扩增片断长度为50~560 bp。24个烟草材料的DNA谱带表现出较好的遗传多态性,图2是引物9对24个烤烟材料的SSR图谱,谱带可把24个品种完全区分开,表现出100%的多态性。

表4 多态性引物Table4 The primers which produced polymorphic bands

图1 14个烟草材料DNA-SSR 指纹图谱。1-14:引物9的扩增图谱;16-29:引物14的扩增图谱;M:MarkerFig.1 Result of PCR amplification using primers 9 and 14

图2 引物9 对24 份烟草材料的SSR 扩增图谱。M:Marker,1~24为材料编号,其对应的品种名称同表2Fig.2 SSR patterns of 24 tobacco amplified by primer 9
2.3 品种(系)间亲缘关系和聚类分析
根据8对引物的SSR图谱,建立0-1数据库,计算24个供试材料样本间的遗传相异系数(GD)。结果表明,遗传相异系数变异范围为 0.3445~0.8626,平均 0.6052,其中红花大金元和威宁白花烟的遗传相异系数最小,仅为0.3445,表明两者的亲缘关系最近。NC82和韭菜坪2号之间的遗传相异系数最大(0.8626),表明它们相互之间的遗传基础相对较远。整体来看,引进品种的遗传相异系数0.6057略低于贵州选育品种(系)0.6236,表明我省地方材料品种的遗传差异较大。本中心自选品系GDH系列的遗传相异系数较近,为0.5640。在所有供试材料中,Va116与其他品种的遗传相异系数最高,遗传相异系数在0.484~0.717之间,说明此品种与其他供试材料间遗传基础相对较大,遗传相似性最低。
利用SSR遗传距离矩阵按UPGMA方法构建了各个供试品种的树状聚类图(图3)。聚类结果与品种间的亲缘关系具有较好的一致性:在遗传距离为0.63水平时,可将24个品种聚为4个类群,大部分美国引进品种和本中心自育的品系都在第Ⅰ类;Coker147和Va116独自成第Ⅱ和第Ⅳ类;贵州自育或地方品种及云烟 317,NC27NF等部分引进品种归为第Ⅲ类。在遗传距离为0.54水平时,第Ⅰ类又可分为3个亚类,第Ⅰ亚类包括G70、GDH黄叶突变体、RG11、G80、C1-5-1、GDH84、GDH64,其中本中心自育的品系GDH84、GDH64、GDH黄叶突变体和G70、G80都有G28的血统,因此聚为一类。NC82自成第Ⅱ亚类,第Ⅲ亚类包括GDH02、K326、8611、GDH279、水城烟、K730,其中 GDH02、GDH279都具有8611的血统,而8611是中国农业科学院烟草研究所用(单育2号×G-28)×(G-28×净叶黄)杂交育成的,也是G28的后代。第Ⅲ类又分为4个亚类。GDH88,NC27NF各自成为第Ⅰ亚类和第Ⅳ亚类,第Ⅱ亚类包括红花大金元、威宁白花烟、南江3号、G140,其中南江3号是从红花大金元品种中获得的自然变异株,经系统选择培育而成。第Ⅲ亚类包括韭菜坪2号和云烟317。系谱分析表明,多数品种的亲缘关系与聚类结果基本一致,少数不一致,这可能与其长期定向栽培选育过程中产生变异有关。
3 讨 论

图3 24 份烟草材料基于SSR 标记的聚类图Fig.3 Clustering of 24 tobacco materials based on SSR
一些研究人员早已证明一个物种的微卫星引物可以在研究其近源植物中被利用[5-6]。笔者运用番茄、辣椒的SSR引物对24份在烟草育种中贡献较大的种质进行SSR扩增分析,结果表明遗传相异系数变异范围在0.3445~0.8626之间,平均0.6052,说明这些品种(系)之间的遗传背景较远。聚类分析结果也从分子水平进一步验证了我国烟草育种资源的匮乏,主要使用的主体亲本是 K326、红花大金元和 G28。梁景霞[8]、肖炳光[9]、陶爱芬等[10]分别运用ISSR、RAPD、AFLP、SRAP、SSR等标记对现有主要育成品种和栽培烟草品种的遗传多样性及系谱亲缘关系进行了分析,发现品种之间的遗传背景相似,亲缘关系较近,特别是烤烟品种之间存在着遗传基础狭窄的问题。与前人的研究结果相比,笔者发现本研究的这些烤烟品种(系)间的亲缘关系较远,这与这些材料是本中心杂交育种中贡献较大有关,作为杂交育种亲本,差异一般都较大。
研究还表明我省选育品种和地方材料的遗传差异大于引进品种。贵州省属山区气候特点,生态环境差异比较大,栽培选育的烟草品种之间的差异也较大,这有利于我省烟草品种资源的利用与发展。笔者认为结合烟区生态条件,充分发挥贵州烟叶生产地区生态环境差异大的优势,加强对现有特色品种的改良,在突出地方特色品种风格的基础上,提高综合性状,可培育一批具有鲜明地方特色的新品种。
4 结 论
本实验的结果与实际材料的亲缘关系基本一致,并揭示了不同品种的遗传基础,表明同科植物的SSR引物可对烟草种质资源进行遗传差异分析,而且也可为烟草品种的鉴定、遗传分析和核心种质的构建提供可靠信息,有着潜在的应用价值。
[1]Bindler G, van der Hoeven R, Gunduz I, et al.A microsatellite marker based linkage map of tobacco [J].Theor Appl Genet, 2007, 114: 341-349.
[2]聂琼,刘仁祥,徐如宏,等.烟草基因组DNA的高效提取与SSR应用[J].种子,2009,28(4):57-59.
[3]王日升,李杨瑞,杨丽涛,等.番茄栽培品种 SSR 标记和形态标记的遗传多样性分析[J].热带亚热带植物学报,2006,14(2):120-125.
[4]罗玉娣,李建国,李明芳.用 SSR标记分析辣椒属种质资源的遗传多样性[J].生物技术通报,2006(增刊):337-341.
[5]Nei M,Li W H.Mathematical model for studying genetic variation in terms of restriction endonucleases[J].Proc.Natl.Acad.Sci.USA, 1979, 76: 5269-5273.
[6]Peakall R, Gilmore S, Keys W, et al.Cross-species amplification of soybean (Glycine max) simple sequence repeats (SSRs) within the genus and other legume genera:implications for the transferability of SSRs in plants[J].Mol Biol Evol, 1998, 15: 1275-1287.
[7]钟智林,蒋建雄,杨璐,等.玉米 SSR 引物在芒属植物遗传多样性分析的应用研究[J].现代生物医学进展,2009,9(11):2076-2079.
[8]梁景霞, 祁建民, 方平平, 等.烟草种质资源遗传多样性与亲缘关系的 ISSR 聚类分析[J].中国农业科学,2008,41(1):286-294.
[9]肖炳光.利用RAPD和ISSR标记分析烤烟品种间遗传关系[J].武汉植物学研究,2006,24(5):392-396.
[10]陶爱芬,刘中华,祁建民.烟草种质资源遗传多样性的IRAP和 ISSR标记比较分析[J].武汉植物学研究,2009,27(6):589-594.
[11]杨友才.烟草种质资源遗传多样性及青枯病抗性基因的分子标记研究[D].长沙:湖南农业大学,2005.
[12]王日新.普通烟草类型间重要性状差异及其遗传特性研究[D].北京:中国农业科学院,2009.
[13]叶兰钦,辛明明,杜金昆, 等.SSR标记应用于烟草品种遗传多样性研究[J].中国农学通报,2009,25(1):56-62.

