力竭运动及恢复期大鼠纹状体5-HT、DA及其代谢物浓度的动态变化研究*
杨东升,刘晓莉,乔德才△
(1.北京师范大学体育与运动学院,北京 100875;2.浙江工业大学体育科学研究所,杭州 310014)
纹状体是基底神经节中接受传入信息的主要部位,参与随意运动的程序编制与执行[1]。本实验室前期电生理学研究发现,运动疲劳后大鼠纹状体神经元高频放电比例增高、爆发式放电活动增多,神经元活动规律性减弱,初步证实了纹状体是引起运动疲劳的重要中枢脑区之一[1,2]。神经元的电活动变化与神经递质的释放有关,5-羟色胺(serotonin,5-HT)是脑内抑制性神经递质,多巴胺(dopamine,DA)是脑内兴奋性神经递质,有研究表明,脑内5-HT和DA代谢变化可能与运动性中枢疲劳有关[3]。然而,以往的研究多采用断头取脑及定点采样的方法,获得的结果难以反映运动过程中中枢脑区神经递质的连续动态变化特征。为此,本实验采用活体微透析结合毛细管电泳-激光诱导检测技术,连续动态观察大鼠在一次性力竭运动过程及运动后恢复期纹状体细胞外液中5-HT和DA及其代谢产物色氨酸(tryptophan,Trp)、5-羟吲哚乙酸(5-hydroxyindoleacetic acid,5-HIAA)、酪氨酸(tyrosine,Tyr)含量的变化,探讨一次性力竭运动对大鼠纹状体主要单氨类神经递质及其代谢产物的影响,进一步解释运动疲劳引起纹状体神经元电活动改变的可能机制。
1 材料与方法
1.1 实验对象
实验采用健康雄性Wistar大鼠6只,鼠龄8周,体重(250±10)g,购自北京维通利华实验动物技术有限公司,动物许可证号:SCXK(京)2006-0008。常规分笼饲养,自由饮水进食,自然光照,动物房内温度20℃±1℃,相对湿度为40%~60%。
1.2 仪器与试剂
主要仪器:微量注射泵(BAS,MD-0250)、微透析探针(BAS,MD-2204)、微透析探针套管(BAS,MD-2251)、三维立体定位仪(日本成茂,SN-3N)、毛细管电泳仪(BECK MAN,P/ACETM MDQ)、488 nm氩离子激光诱导荧光检测器(LIF)、Karat系统软件;毛细管柱:未涂层石英毛细管柱 75μmID×50/57 cm(分离长度/总长)(BECK MAN);pH计(HANNA,HI98128)。
主要试剂:Trp,DA,Tyr,5-HIAA和5-HT标准品均购自 Sigma公司;NaCI、KCI、硼砂(分析纯)等试剂购自北京芮得生物科技有限公司。人工脑脊液(Artificial cerebrospinal fluid,aCSF)各组份浓度(mmol/L)分别为:NaCl 126,KCl 2.4,KH2PO40.5,MgCl20.85,NaHCO327.5,Na2SO40.5,CaCl21.1,pH值为7.4。无菌过滤器(0.2μm)过滤,冷藏备用。
1.3 微透析探针导轨的植入
大鼠以戊巴比妥钠(50mg/kg)腹腔麻醉,俯卧固定于脑立体定位仪上,沿大鼠头顶正中线做矢状切口,暴露前、后囟及冠、矢状缝等骨性标志。调整门齿高度,使前囟和后囟处在同一水平面上,依照大鼠脑立体定位图谱,在纹状体对应的颅骨部位钻孔,掀去硬脑膜。将透析套管定植入左侧纹状体(P∶0.2,L∶3,H∶3.2),并用小螺钉及牙科水泥固定,保证导轨不随动物的正常活动而移动或松动。术后4~5 d,手术引起的不良反应即可消失,大鼠饮食和行为恢复正常,开始恢复性的渐增负荷运动训练。
1.4 力竭运动方案
待大鼠能够以20m/min的速度跑30min,并未见不良反应,次日即进行正式实验。一次性力竭运动采用本实验室建立的递增负荷跑台运动方案[4],跑台坡度为0°,负荷分为3级:I级,8.2 m/min,15 min;II级 ,15 m/min,15 min;III级 ,20m/min,运动至力竭。力竭判定标准为:动物不能维持预定跑速,滞留于跑道后挡板不动,使用光、电、声刺激驱赶仍无效,并伴有呼吸急促,腹卧跑台,垂头不起等行为表现。
由于不同大鼠运动至力竭的时间个体差异较大,为了便于观察运动疲劳形成、发展及恢复过程中大鼠纹状体细胞外液中神经递质的变化情况,我们将力竭运动及恢复过程划分为四个阶段:运动前安静期(0~30min);运动 Ⅰ(30~60min);运动 Ⅱ(力竭前60min~力竭)和恢复期(恢复0~90min)。
1.5 微透析-毛细管电泳荧光检测
开启透析灌流系统,调节恒流泵控制液体流速为2μl/min,将透析探针插入预先植入脑内的探针导轨,探针与人工脑脊液灌流系统直接相接(图1)。灌流平衡60min后开始收集透析液,采样频率为15 min,每次采集样品量30μL,连续采集大鼠安静、运动、力竭和恢复过程中纹状体的透析液,并放置-20℃的冰箱中保存待测。
取5μL透析液样品,分别加入10μl硼砂缓冲溶液(2 mmol/L,pH 10.00),5μl异硫氰酸荧光素(0.005 mmol/L)溶液,室温避光条件下衍生17 h,再用2 mmol/L硼砂缓冲溶液定容至100μl,进行毛细管电泳-激光诱导荧光检测。电泳条件:运行电压25 kV,实验温度25℃,压力进样0.5 psi,进样时间15 s,检测波长220nm。

Fig.1 Schematic illustration of microdialysate and capillary electrophoresis in rat striatum during experiment
1.6 脑组织学鉴定
微透析实验结束后,用10%水合氯醛按0.35 ml/kg的剂量腹腔麻醉大鼠,仰卧位固定四肢。打开大鼠胸腔,用4%福尔马林溶液经心脏常规灌流固定,取出脑组织,冠状面做切片,对照大鼠脑立体定位图谱鉴定探针尖端所在位置(图2),探针未能准确插入纹状体的数据将被删除。

Fig.2 Schematic illustration of the implantation of microdialysis probe
1.7 数据处理
以每只大鼠安静透析液物质的平均浓度为基础值,将不同时间段透析液样品中物质浓度所占基础值的百分比反映其变化规律,所有结果均用均数±标准差()表示。应用SPSS 11.0统计软件进行Repeated measures ANOVA分析。
2 结果
2.1 力竭运动过程及恢复期大鼠纹状体细胞外液中5-HT、Trp和5-HIAA水平的动态变化
力竭运动过程及恢复期大鼠纹状体细胞外液中5-HT、Trp和5-HIAA水平的变化见图3。从图中可见,运动开始30min(运动Ⅰ)5-HT、Trp和5-HIAA水平均未见显著变化;从力竭前45 min(运动Ⅱ)三指标开始明显增高,与运动前安静时相比5-HT约增长了1倍,Trp约增长了0.2倍,而5-HIAA增高了约2.2倍;随后三指标继续增长,力竭时其含量显著高于安静水平(P<0.05),且在恢复期90min内继续保持增长趋势(P<0.05,P<0.01)。

Fig.3 Variation of 5-HT,Trp and 5-HIAA in rats striatum during exhaustive exercise(n=6)
2.2 力竭运动过程及恢复期大鼠纹状体细胞外液中DA和Tyr水平的动态变化
力竭运动过程及恢复期大鼠纹状体细胞外液中DA和Tyr水平的变化见图4。在运动的第一阶段(运动Ⅰ)DA和Tyr的浓度与安静时相比虽有增加,但增幅不大;当运动至力竭前45 min时,DA和Tyr的浓度开始显著增高,力竭时达到安静状态的1.5倍以上(P<0.05,P<0.01),且在运动结束后的恢复期仍保持继续增长趋势(P<0.05,P<0.01),恢复90min时,DA浓度达安静时的3倍以上。

Fig.4 Variation of Tyr and DA in rats striatum during exhaustive exercise(n=6)
2.3 力竭运动过程及恢复期大鼠纹状体DA/5-HT的变化
力竭运动过程及恢复期大鼠纹状体细胞外液中DA/5-HT的动态变化见图5。从图中可见,运动开始DA/5-HT出现升高趋势,在运动15 min和30min时达到最高水平(P<0.05,P<0.01);之后开始下降,运动Ⅱ基本呈持续下降趋势,直至力竭;而恢复期内基本保持平稳状态,力竭和恢复期与安静状态相比均没有显著性差异。
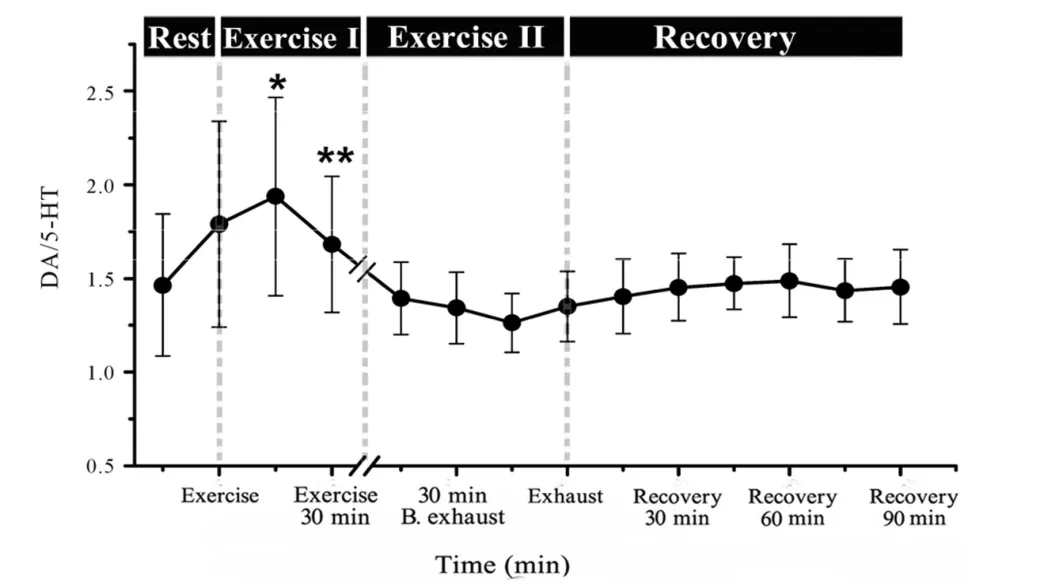
Fig.5 The variation of DA/5-HT in rats striatum during exhaustive exercise(n=6)
3 讨论
5-HT是中枢一种重要的抑制性单胺类神经递质。脑部5-HT能神经元胞体主要集中于中脑下部、脑桥上部和延髓中缝核,其神经纤维可投射到下丘脑和纹状体等部位[3]。脑中的5-HT是由血液中的Trp进入5-HT能神经元后在色氨酸羧化酶(TPH)作用下合成的,并主要经单氨氧化酶(MAO)催化将5-羟吲哚乙醛转变为最终产物5-HIAA途径进行分解。因此,Trp是5-HT合成的前体,5-HIAA是其主要的代谢产物。Newsholme等首次提出神经递质是中枢疲劳的潜在调节物,并根据5-HT在脑内的作用与变化将其视为中枢疲劳的可能性介质。推测脑内5-HT浓度增加会对中枢向外周发放神经冲动产生一定的影响,从而引起运动能力下降[5]。本研究采用活体微透析结合毛细管电泳—激光诱导检测技术,通过在体直接分段取样的方法揭示了大鼠在一次性力竭运动过程及恢复期纹状体细胞外液中5-HT浓度的动态变化特征。结果发现,在运动开始至30min(运动Ⅰ),5-HT浓度未出现明显改变,此时大鼠体力充沛,能较好地跟随跑台进行自主运动;之后当递增强度运动至力竭前45 min时(运动II),5-HT浓度则出现迅速增长并一直持续至力竭,此时大鼠的运动能力出现明显下降,必须依靠声、光、电等外部轻微刺激继续运动直至力竭。上述结果表明,纹状体细胞外液中5-HT浓度的改变与大鼠的运动能力有密切的关系。本研究结果还发现,Trp和5-HIAA的变化趋势与5-HT基本相同。提示:在力竭运动过程中,纹状体细胞外液中5-HT处于不断合成与分解的动态变化之中,刘蓓蓓等人[6]的研究也证实了这一点。分析其原因,可能与运动导致血浆中以结合形式存在的Trp大量释放,引起游离Trp(f-Trp)增多有关,f-Trp可以通过血脑屏障被5-HT能神经元摄取合成5-HT。此外,运动使支链氨基酸参与肌肉供能的数量增多,造成血浆支链氨基酸浓度降低,也会导致进入脑内的Trp增加,引起5-HT合成增多[6,7]。据此认为,5-HT合成前体f-Trp增多是力竭运动过程中及运动后恢复期纹状体内5-HT升高的重要原因之一。
DA是脑内含量较为丰富的一类兴奋性单胺类神经递质。脑内的DA主要由黑质产生,沿黑质-纹状体投射系统分布,在纹状体DA神经末稍的囊泡中储存。Tyr是DA合成的前体,血液中的Tyr进入脑内后转运至DA神经元内,在酪氨酸羟化酶(TH)的催化作用下再合成DA。有研究表明,力竭运动可导致大鼠纹状体内DA及其代谢产物明显增高[8]。我们的实验发现,运动开始至30min(运动Ⅰ),DA浓度出现增高的趋势;随运动时间和强度的递增,当大鼠运动至力竭前45 min时(运动II),DA浓度显著升高,运动至力竭时约增高了1.5倍;Tyr的增长趋势与DA基本一致。在DA能神经系统中,DA II型受体(D2DR)具有调节DA生物合成和释放的双重功能[9]。实验室前期研究已经证实,运动疲劳使纹状体内DA与D2DR含量均显著增高。DA与D2DR受体结合可激活间接通路影响锥体外系对运动功能的调节[10]。
本文结果发现纹状体内兴奋性神经递质DA和抑制性神经递质5-HT在运动过程中都呈长时间的升高趋势,而他们的合成底物Trp与Tyr均同步显著升高,提示长时间的运动导致的纹状体内神经递质代谢的显著变化的主要原因与外周血中由运动引起的生化指标的变化直接相关,说明了在运动性中枢疲劳的调控过程中,外周因素也起着重要的作用。运动性疲劳是一个外周与中枢协同交互作用的复杂过程,运动可能是首先通过血液一些生化指标的变化进而导致中枢神经系统产生进一步的调节机制,参与运动性疲劳的中枢调控。另外研究结果也提示在运动性疲劳的中枢调控过程中,脑内兴奋性神经递质与抑制性神经递质可能产生相同的变化趋势,其中一类神经递质的变化并不能很好地反映中枢的兴奋与抑制状态。所以,我们采用DA/5-HT比值来描述二者在运动疲劳形成和发展过程中的可能关系,结果发现,力竭运动过程中纹状体细胞外液中DA/5-HT比值的变化也可分为两个阶段:运动开始(运动状态Ⅰ)DA/5-HT出现升高趋势,运动15 min和30min时达到最高水平;之后比值呈下降趋势并略低于安静水平(运动 II)。提示:在运动初期纹状体兴奋性神经递质DA的作用占优势,神经元以兴奋性功能活动为主;而运动后期则以抑制性神经递质5-HT作用占优势,神经元以抑制性功能活动为主,且力竭运动引起纹状体细胞外液中神经递质浓度的变化需要较长时间的恢复过程。
[1]侯莉娟,刘晓莉,乔德才.男性大学生运动疲劳前后大脑纹状体核磁共振1H谱特征分析[J].中国运动医学杂志,2010,29(4):414-417.
[2]乔德才,侯莉娟,何德富,等.运动疲劳对大鼠新纹状体神经元电活动的影响[J].中国运动医学杂志,2005,24(6):676-680.
[3]宋亚军,孙勤枢,王鲁克,等.急性耐力运动对大鼠不同脑区单胺类神经递质及其代谢产物的影响[J].北京体育大学学报,2005,28(4):484-486.
[4]杨东升,乔德才,刘晓莉.力竭运动过程中大鼠纹状体葡萄糖/乳酸代谢的实时观察[J].中国运动医学杂志,2009,28(4):384-387.
[5]Newsholme E,Acworth I,Blomstrand E.Amino acids,brain neurotransmitters and a functional link between muscle and brain that is important in sustained exercise[M].London,UK:Advances in myochemistry,1987.127-133.
[6]刘蓓蓓,张蕴昆.运动与脑组织中5-羟色胺及其代谢产物的研究现状[J].南京体育学院学报(自然科学版),2005,4(4):29-33.
[7]Davis J M,Alderson N L,Welsh R S.Serotonin and central nervous systemfatigue:nutritional considerations[J].Am J Clin Nutr,2000,72(2 Suppl):573-578.
[8]Blomstrand E.Amino acids and central fatigue[J].Amino Acids,2001,20(1):25-34.
[9]Bergmann O,Winter C,Meissner W,et al.Subthalamic high frequency stimulation induced rotations are differentially mediated by D1 and D2 receptors[J].Neuropharmacol,2004,46(7):974-983.
[10]侯莉娟,刘晓莉,乔德才.运动疲劳诱导大鼠纹状体单胺类递质含量及多巴胺受体表达的影响[J].中国康复医学杂志,2010,25(7):639-642.
- 中国应用生理学杂志的其它文章
- 健身健美负荷训练中的心率阈研究*

