一种简便的大鼠肝脏星状细胞分离培养方法及鉴定
张荣涛, 李向农
原发性肝癌与肝硬化的关系密切,而肝星状细胞(hepatic stellate cells,HSCs)在肝硬化的发生发展中起重要作用。HSCs活化后可以分泌大量细胞外基质及细胞因子[1]。20世纪80 年代 Knook等[2]最早用链酶蛋白酶、胶原酶灌注消化的方法分离得到HSCs。但是分离方法复杂,条件苛刻,尤其是酶灌注时间及密度梯度离心液的精确配置不易把握。目前现有的许多分离方法需要特殊的循环设备及昂贵的密度梯度离心液。本研究借鉴国内外先进的HSCs分离方法[3-5],经过多次实验,探索出一种简单、经济、可靠的HSCs分离方法,现介绍如下。
1 材料与方法
1.1 材料
1.1.1 实验动物 雄性SD大鼠20只,体重400~500 g,徐州医学院实验动物中心提供。普通饲料喂养,自由进食。实验前12 h禁食。
1.1.2 主要试剂 Ⅳ型胶原酶、链酶蛋白酶、Percoll、DNA酶(均是sigma产品),DMEM高糖型培养基、PBS(北京索莱宝公司),胎牛血清(无支原体级)(杭州四季青),Desmin抗体(bioword),SABC免疫组化试剂盒(武汉博士德)。
1.2 方法
1.2.1 液体配制 (1)灌注酶:链酶蛋白酶100 mg,Ⅳ型胶原酶 50 mg,D-Hanks 100 mL。(2)消化酶:Ⅳ型胶原酶
50 mg,链酶蛋白酶20 mg,DNA酶10 mg,D-Hanks 100 mL。(3)密度梯度离心液:9份Percoll加 1 份 1.5M PBS,配置成 100% 的 Percoll。用0.15M的PBS将100%的Percoll稀释至39.5%,pH=7.4;用密度计测量密度并调整至1.053,滤器过滤。
1.2.2 HSCs的分离 SD大鼠用10%水合氯醛0.3 mL/100 g腹腔注射麻醉。碘伏消毒切口皮肤。腹部十字型切口入腹,入腹后暴露门静脉,结扎肝动脉、胆总管。在门静脉远心端用眼科剪做“V”型切口,置入硬膜外麻醉用导管,结扎固定后连接输液器。同时在下腔静脉做一小切口,插入硬膜外导管,结扎固定,作为出液端。实验前将D-Hanks液、灌注酶、消化酶水浴至37℃。先用100 mL(含2 U/mL肝素)的D-Hanks经门静脉插管灌注肝脏,灌注时间约15 min。待肝脏变为土黄色时,改用50 mL灌注酶缓慢灌注。将下腔静脉插管的出液端置于培养皿,收集流出的灌注酶,供重复灌注使用。灌注大约30 min(重复灌注3~5次),至肝脏软化时,剪下肝脏,置于培养皿。20 mL D-Hanks清洗3次,去除肝脏表面残留灌注酶。剔除肝包膜及结缔组织,剪碎肝组织;加入30 mL预热的消化酶,消化20 min,可见肝组织变成细胞悬液,再加入1 mL胎牛血清终止消化。将细胞悬液用200目筛网过滤,移入50 mL离心管,2 500 r/min离心 5 min,弃上清;3 mL D-Hanks悬浮沉淀,重复离心1次,弃上清;沉淀用6 mL DMEM悬浮,制成细胞悬液。取2个10 mL玻璃离心管,各加入5 mL密度梯度离心液,吸取3 mL细胞悬液缓慢加入离心液上方,保证两层液体之间界面清楚。3 800 r/min离心30 min,可见上清与离心液之间有一层HSCs形成的絮状沉淀。小心吸取此层沉淀,装入10 mL玻璃离心管,3 mL DMEM悬浮,2 500 r/min离心5 min,重复1次,所得HSCs沉淀用3 mL含20%胎牛血清的DMEM悬浮,供细胞培养用,同时取90 μL细胞悬液以鉴定细胞活性。
1.2.3 细胞培养 (1)原代培养:将分离所得3 mL HSCs细胞悬液接种于50 mL塑料培养瓶,置于37℃、5%CO2的细胞培养箱中。24 h后换液,以后每48 h换液1次。一般10天左右细胞长满瓶底约80%面积时,即可开始传代培养。(2)传代培养:用1 mL 0.25%的胰酶加入培养瓶消化2 min。显微镜下观察瓶壁细胞变圆后,弃去胰酶,加入2 mL含10%胎牛血清DMEM中止消化。吸管吹打,制成细胞悬液;移入10 mL玻璃离心管,1 000 r/min离心5 min,弃上清;沉淀用3 mL含10%胎牛血清的DMEM培养基悬浮,每毫升细胞悬液接种于1个50 mL塑料培养瓶。将此传代后的HSC置于37℃、5%CO2的细胞培养箱中,用含10%胎牛血清的DMEM培养。
1.2.4 HSCs活性鉴定 台盼蓝拒染实验,光镜下观察刚分离出的HSCs,未着色者为活细胞。
1.2.5 HSCs性质鉴定 (1)形态学:光镜观察原代HSCs培养过程中的形态变化。(2)免疫细胞化学:采用 Desmin抗体鉴定,将原代培养10天的HSCs以1×105/mL浓度接种于24孔板,继续培养24 h,冷丙酮固定,SABC法染色,DAB显色,着色者为阳性。
2 结果
2.1 细胞得率及活率
本法分离的细胞得率为(2.35 ±0.15)×107/每肝,细胞活率为(95.5 ±0.6)%。
2.2 细胞性质鉴定
2.2.1 形态学 刚分离的HSCs呈圆形、椭圆形,含较多脂滴,透明度高。24 h后细胞贴伸出伪足。培养7天后细胞呈明显的梭形、星形,细胞透明度降低(图1~3)。
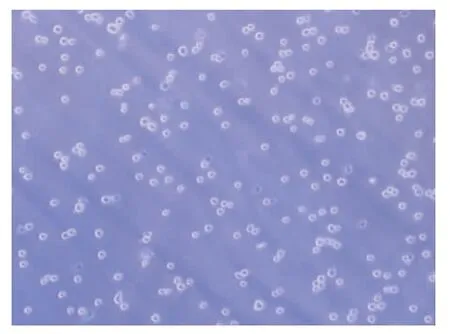
图1 刚分离的HSCs(×200)
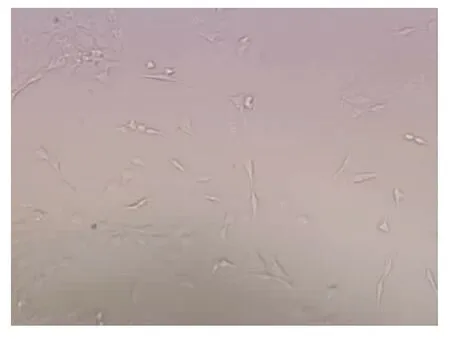
图2 原代培养7天的HSCs(×200)
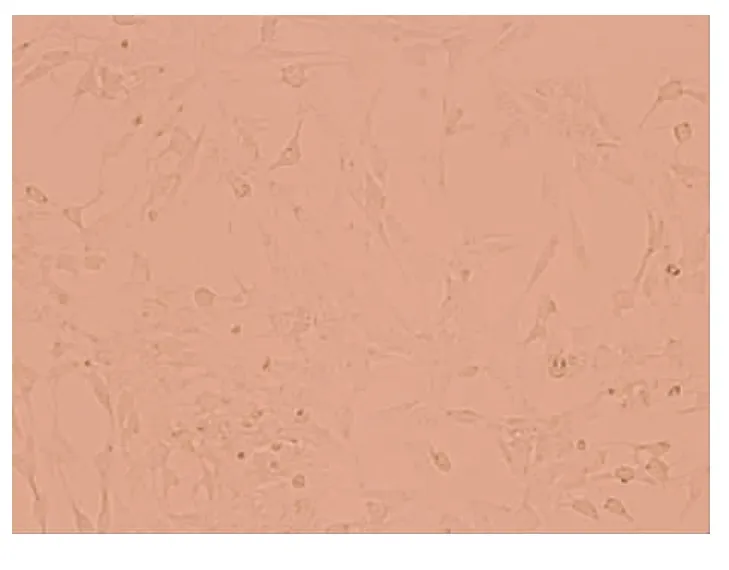
图3 原代培养第10天的HSCs(×200)
2.2.2 免疫细胞化学 原代培养10天的HSCs用Desmin抗体鉴定,SABC法免疫细胞化学染色(图4)。HSCs阳性率为(92.4 ±1.5)%。
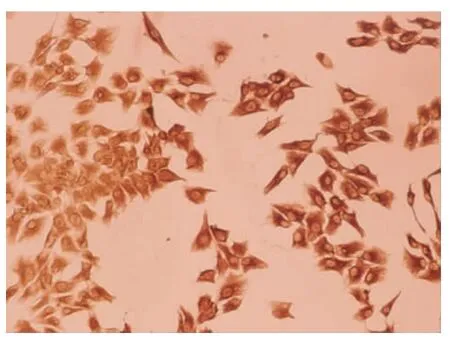
图4 原代培养10天的HSCs免疫细胞化学染色(SABC法,×200)
3 讨论
HSCs在肝纤维化的过程中扮演重要角色[6]。HSCs的分离提取方法不断改进,其中以原位灌注法最常使用,但其步骤繁琐,不易操作。为简化HSCs提取步骤,缩短实验时间,我们在常规方法的基础上做了一些改进:(1)HSC与Kuffer细胞密度有一定交叉,密度梯度离心液的精确配制是细胞成功提取的前提。Percoll作为一种密度梯度离心介质,粘滞度低,梯度容易形成,对细胞无毒性。本实验参考了不同浓度的Percoll密度表,将Percoll与PBS混匀,用密度计调配密度到1.053,有效保证了密度梯度离心液的精度,也降低了配液难度。(2)选用硬膜外导管作为门静脉的插管。硬膜外导管在硬度与韧性方面是理想的大鼠门静脉插管材料,可有效提高插管成功率,有利于控制灌注速度。但是,肝脏中的肝细胞与HSCs粘附紧密,酶消化不足将降低细胞得率,消化过度则降低细胞活性。因此,对肝脏消化程度的把握与实验者的经验有一定关系。总之,本实验方法分离提取HSCs无需特殊设备和昂贵试剂,在保证细胞得率、活率及纯度的前提下简化了操作步骤,简单易行。
[1]Reeves HL,Friedman SL.Activation of hepatic stellate cells-a key issue in liver fibrosis[J].Front Biosei,2002,1(7):d808-d826.
[2]Knook DL,Seffelaar AM,de Leeuw AM.Fat-storing cells of the rat liver:Their isolation and purification [J].Exp Cell Res,1982,139(2):468-471.
[3]Friedman SL,ROLL FJ.Isolation and culture of hepatic lipocytes,Kupffer cells,and sinus oidal endothelial cells by density gradient centrifugation with stractan[J].Anal Biochem,1987,161(1):207-218.
[4]翁山耕,冷希圣,魏玉华,等.改良法大鼠肝星状细胞培养与鉴定[J].北京大学学报,2001,33(1):83-86.
[5]Riccalton-Banks L,Bhandari R,Fry J,et al.A simple method for the simultaneous isolation of stellate cells and hepatocytes from rat liver tissue[J].Mol Cell Biochem,2003,248(1-2):97-102.
[6]Li D,Friedman SL.Liver fibrogenesis and the role of hepatic stellate cells:new insights and prospects for therapy[J].J Gastroenterol Hepatol,1999,14(7):618-633.

