冠心病患者胰岛素抵抗状态的研究
戈吉祥,高 华,孙 萍,姚 萱
(北京仁和医院心内科,北京 102600)
近年来,胰岛素抵抗在冠状动脉粥样硬化性心脏病(冠心病)发生、发展中的作用逐渐受到内分泌学者和心血管病学者们的重视。国外学者在对不伴有糖尿病的人群进行前瞻性研究中发现,血浆胰岛素水平升高与冠心病发病危险增高有独立的相关性[1-3];我国学者在大量的临床研究中发现胰岛素抵抗与冠心病关系密切[4-6]。目前我国衡量胰岛素抵抗常用指标为1993年李光伟等[7]提出的胰岛素敏感指数(insulin sensitivity index,ISI),即 1/(空腹血糖×空腹胰岛素)。该指标与正常血糖胰岛素钳夹技术(判断胰岛素抵抗的金标准)显著相关。
本研究根据冠状动脉造影结果,把观察对象分为病例组和对照组,观察胰岛素敏感指数、稳态模型的胰岛素抵抗指数(homeostasis mode assessment-insulin resistance,HOMA-IR)等指标在病例组和对照组中的变化情况,通过分析这些指标的变化情况及其内在联系,从而揭露胰岛素抵抗在冠心病患者中的作用。
1 资料与方法
1.1 研究对象 选择2003年4月至2004年1月在中国人民解放军总医院心内科住院的患者,共88例,其中20例临床怀疑冠心病均经冠状动脉造影检查排除冠心病确诊为健康者作为对照组,其中男17例,女3例,平均年龄(60.16 ±9.46)岁。其余68例为病例组,均经冠状动脉造影确诊。冠心病诊断标准为经冠状动脉造影证实至少有一支血管狭窄≥50%。根据1979年国际心脏病学会和协会及世界卫生组织关于缺血性心脏病的命名和诊断标准以及2001年美国心脏病学会/美国心脏协会联合发表有关“心肌梗死新指南”分为 4组:①ST段抬高型心肌梗死(ST-segment elevated myocardial infarction,STEMI)组 19例,其中男17例,女2例,平均年龄(61.71±5.68)岁;主要表现为严重而持久的胸痛,心电图出现病理性Q波、ST段抬高和T波倒置,肌钙蛋白I或肌钙蛋白T升高(TnT≥0.1 mg/L);②非ST段抬高型心肌梗死(non-ST-segment elevated myocardial infarction,NSTEMI)组15 例,其中男14 例,女1 例,平均年龄(62.94 ±9.64)岁;主要表现为严重而持久的胸痛,心电图不出现病理性Q波、无ST段抬高,只有ST段压低或T波倒置,肌钙蛋白I或T升高(TnT≥0.1 mg/L);③不稳定型心绞痛(unstable angina,UAP)组18例,其中男14例,女4 例,平均年龄(63.83 ±7.96)岁;主要表现为:典型缺血性胸痛,肌钙蛋白I或T不升高(TnT<0.1 mg/L),包括初发和恶化型劳累性心绞痛、自发性心绞痛、心肌梗死后心绞痛;④稳定型心绞痛(stable angina,SAP)组16例,其中男14例,女2例,平均年龄(64.20±9.46)岁;主要表现为劳累性心绞痛发作性质在1~3个月内无改变。上述所有入选对象排除了高血压病、糖尿病、肿瘤、肝肾疾病、血液病、风湿病及其他内分泌疾病,及已知其他原因的心脏病。临床一般资料的收集包括性别、年龄、吸烟史、饮酒史、收缩压、舒张压、身高、体质量等。
1.2 血液标本采集 所有受检者均于入院24 h内抽取清晨安静平卧状态下的空腹肘静脉血。空腹胰岛素(fasting plasma insulin,FINS)标本制备为专用采集血清真空采血管,采集晨起时肘静脉血3 mL,血液标本在1 h内用3000 r/min低温离心机,分离血清后置-80℃冰箱保存待测。空腹血糖(fasting blood glucose,FPG)标本制备同空腹胰岛素。
1.3 指标检测
1.3.1 FINS测定 采用酶联免疫法,仪器为雅培公司自动免疫分析仪,试剂为雅培公司提供的酶联免疫分析试剂盒。
1.3.2 FPG测定 采用氧化酶法,采用日本产7100HITACH全自动生化分析仪。
1.3.3 评价胰岛素敏感性 采用李光伟等[7]提出的ISI公式及稳态模式评估法公式计算。ISI=自然对数(LN)[1/FINS×FPG],以正常对照组ISI(取绝对值)95%位点为标准判断是否存在胰岛素抵抗。HOMA-IR=FINS × FPG/22.5。
1.3.4 冠状动脉造影 按美国心脏病学会/美国心脏协会造影指南,用PHILIPS500心血管造影机,采用Judkin's法取多部位造影,冠状动脉病变≥50%为有意义狭窄。病变冠状动脉支数:造影示腔径≥50%的病变累及左前降支、左回旋支、右冠状动脉的支数,分为单支病变、双支病变、多支病变。
1.4 统计学方法 所有数据用SPSS 10.0统计软件进行统计学分析,各项计量参数以均值±标准差(±s)表示,数值变量两组间采用t检验,多组间采用方差分析,多组间两两比较用Post Hoc Dunnett法,计数分类变量用χ2检验,两因素分析应用相关分析。均以P<0.05为有统计学意义。
2 结果
2.1 基础临床资料比较 不同类型冠心病患者与对照组比较在性别构成、年龄、收缩压、舒张压、吸烟史、饮酒史、体质量指数、血尿酸均无统计学意义(P>0.05)。提示5组患者临床一般情况具有可比性(表1)。
2.2 5组患者胰岛素抵抗程度比较 从表2可见,5组间空腹血糖水平无显著性差异(P>0.05),冠心病组患者与对照组相比空腹胰岛素水平增高,胰岛素抵抗程度加重。STEMI组、NSTEMI组与SAP组比较,胰岛素水平差异有统计学意义(P<0.01);胰岛素敏感性差异亦有统计学意义(P<0.01)。说明冠心病患者病情程度不同,胰岛素抵抗的程度及空腹胰岛素水平不同且随着病情的加重而加重。

表2 5组胰岛素抵抗程度的比较
2.3 冠心病组与对照组胰岛素抵抗发生率的比较将以正常对照组ISI(取绝对值)95%位点为标准判断是否存在胰岛素抵抗,结果显示冠心病组胰岛素抵抗的发生率明显高于对照组(72%比15%,P<0.05)(图1)。各组结果:STEMI组 15 例(78.9%)、NSTEMI组 12 例(80%)、UAP 组 13例(72.2%)、SAP组9例(56.2%)、对照组3例(15%)存在胰岛素抵抗(图2)。
3 讨论
3.1 胰岛素抵抗在冠心病发生中的作用 近年来研究表明[8],胰岛素抵抗作为人类多种复杂疾病发病机制中的共同基础受到越来越多的重视。已有的流行病学资料和临床观察表明,胰岛素抵抗和继发的高胰岛素血症与冠心病、高血压、动脉粥样硬化、2型糖尿病、脂代谢紊乱等疾病相关[9]。胰岛素抵抗是指胰岛素作用的靶器官主要是肝、肌肉和脂肪,血管内皮细胞和动脉平滑肌细胞对胰岛素敏感性下降,即正常剂量的胰岛素产生低于正常生物学效应或需要超正常量的胰岛素才能达到正常的生理效应,胰岛素抵抗时机体对胰岛素调节糖代谢作用的敏感性下降,表现在外周组织摄取和利用糖障碍,以及肝糖原合成减弱,糖原分解增强,同时胰岛素抵抗通过引起脂代谢异常、内皮功能障碍、以及增加冠心病危险因素引起冠状动脉粥样硬化疾病。目前公认的检测胰岛素敏感性的金标准是正常血糖高胰岛素钳技术[10],但此方法采血量大,操作复杂,价格昂贵,难以在大规模的临床试验中应用。本研究采用的ISI[LN(1/FPG×FINS)]是李光伟等[7]提出的,并经过与经典的正常胰岛素钳夹技术比较,两者具有良好的相关性,被证实是群体研究中较为实用有效的指标。本研究结果显示:①冠心病组患者与正常对照组相比存在空腹胰岛素水平升高、胰岛素敏感性下降;而STEMI、NSTEMI组与SAP组相比空腹胰岛素水平升高、胰岛素敏感性下降更明显;②根据ISI(取绝对值)以正常对照组的95%位点来划分有或无胰岛素抵抗,结果发现胰岛素抵抗在冠心病组发生率明显高于正常对照组,各亚组胰岛素抵抗的发生率亦高于对照组。这些结果提示,胰岛素抵抗不仅在冠心病患者中普遍存在,而且胰岛素抵抗程度与病情有关,即胰岛素抵抗随着冠心病病情的加重程度而增强,这提示冠心病可能在形成冠状动脉粥样硬化易损斑块中发挥了一定的作用。并与文献报道相一致[11-14]。
其发生机制为:胰岛素是促细胞分裂因素,通过自身的生长刺激作用和刺激其他生长因素(如胰岛素生长因子1),能促使血管平滑肌细胞增殖,还间接地通过刺激与动脉粥样硬化相关的细胞因子而诱发血管平滑肌增生和动脉壁内膜和中层增殖[15];胰岛素抵抗时胰岛素的促进内皮细胞释放的一氧化氮对平滑肌的舒张作用受损[16]。同时空腹胰岛素、胰岛素抵抗与炎症相关因子促进斑块的不稳定;另有研究表明[17],胰岛素抵抗者纤溶能力降低;血小板聚集性增强,内源性抗纤溶物质及其他凝血前体物质如血管性血友病因子、Ⅹ因子等明显增高。所有这些均可引起或加重冠状动脉粥样硬化,导致冠状动脉事件的发生。
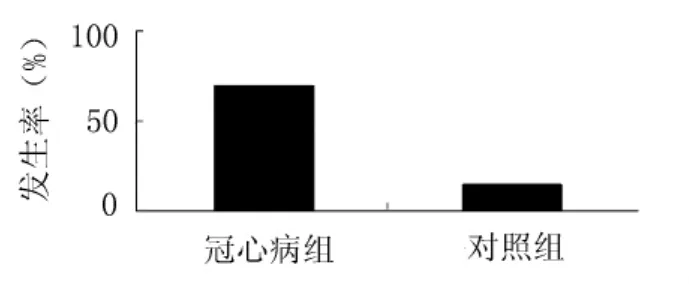
图1 胰岛素抵抗发生率
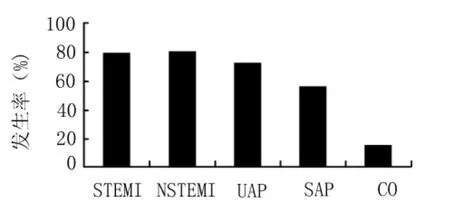
图2 各组胰岛素抵抗发生率
[1]Pyörälä M,Miettinen H,Halonen P,et al.Insulin resistance syndrome predicts the risk of coronary heart disease and stroke in healthy middle-aged men:the 22-year follow-up results of the Helsinki Policemen Study[J].Arterioscler Thromb Vasc Biol,2000,20(2):538-544.
[2]Fontbonne A,Charles MA,Thibult N,et al.Hyperinsulinemia as a predictor of coronary heart disease mortality in a healthy population,the Paris Prospective Study,15-year follow-up[J].Diabetologia,1991,34(5):356-359.
[3]Kareinen A,Viitanen L,Halonen P,et al.Cardiovascular risk factors associated with insulin resistance cluster in families with earlyonset coronary heart disease[J].Arterioscler Thromb Vasc Biol,2001,21(8):1346-1352.
[4]张桂玲,石嘉玲,林青.胰岛素抵抗和高胰岛素血症与冠心病关系的研究[J].天津医科大学学报,1997,3(4):43-44.
[5]蔡琳,刘汉雄,燕纯伯,等.胰岛素抵抗与冠状动脉狭窄严重程度的关系[J].中华心血管病杂志,2001,29(9):538-541.
[6]尹朝霞,洪涛,蒋捷,等.胰岛素抵抗与冠心病危险因素及冠状动脉病变程度的相关分析[J].中国介入心脏病学杂志,2003,11(5):258-260.
[7]李光伟,潘孝仁,Lillioja S,等.检测人群胰岛素敏感性的一项新指数[J].中华内科杂志,1993,32(5):656-660.
[8]Stern MP.Diabetes and cardiovascular disease:"the Common soil"hypothesis[J].Diadetes,1995,44(4):369-374.
[9]Kendall DM,Harmel AP.The metabolic syndrome,type 2 diabetes,and cardiovascular disease:understanding the role of insulin resistance[J].Am J Mang Care,2002,8(20 Suppl):635-653.
[10]DeFronzo RA,Tobin JD,Andres R.Glucose clamp technique:a method of quantifying insulin secretion and resistance [J].Am J Physiol,1979,237(3):214-223.
[11]陈浩量,彭树全,霍道贵,等.胰岛素抵抗与急性冠脉综合征的关系[J].中华新医学,2003,4(15):1394-1395.
[12]李虹伟,顾复生,罗春苏.冠心病病人的胰岛素抵抗状态[J].中华心血管杂志,1995,23(1):43-45.
[13]郑虹,米树华,田磊.不同类型冠心病患者的胰岛素抵抗[J].临床荟萃,2003,18(19):1093-1095.
[14]Stout RW.Insulin AS ami to gentic factor:role in the pathogensis of cardiovascular disease [J].Am J Med,1991,90(Suppl 2A):62-70.
[15]Steinberg HO,Chaker H,Leaming R,et al.Obesity/insulin resistance is associated with endothelialdy function implication for the syndrome of insulin resistance[J].J Clcin Invest,1996,97(11):2601-2610.
[16]Festa A,D'Agostino R,Howard G,et al.Chronic subclinical in flammation as part of the insulin resistance syndrome the insulin resistance atherosclerosis study(IRAS)[J].Circulation,2000,102(1):42-47.
[17]Devaraj S,Xu DY,Jialall C.Reactive protein increase plasm inogen activator inhibitorl expression and activity in human a orticendo the lialcells:implications for the metabolic syndrome and a therothrombosis[J].Circulation,2003,107(3):398-404.

