制何首乌单用或伍用白蒺藜对小鼠肝脏毒性的比较研究Δ
夏 蕾,王丽霞,牟稷征(中国中医科学院广安门医院药剂科,北京市 100053)
由于皮肤科很多疾病均为慢性病程,因此皮肤科长疗程用药的蓄积中毒问题值得关注。制何首乌和白蒺藜是治疗白癜风经常配伍使用的中药。目前已有不少学者在临床病例和动物实验中发现制何首乌能引起肝功能损害[1,2],但尚未见关于白蒺藜肝脏毒性的报道。笔者前期的实验表明,制何首乌和白蒺藜对小鼠无急性毒性,两药按中国中医科学院广安门医院皮肤科的临床常用剂量ig 2周后,亦未发现肝脏毒性[3],但对这两种药物的临床安全使用剂量范围及疗程并未深入研究。因此,本课题组通过对不同剂量下单用制何首乌和制何首乌伍用白蒺藜对小鼠肝脏毒性的比较研究,旨在系统评价白蒺藜是否具有肝脏毒性以及制何首乌与白蒺藜伍用的合理性,并为确定这两种中药的安全使用剂量范围及疗程提供依据。
1 仪器与材料
1.1 仪器
AU640型全自动生化分析仪、BX50型光学显微镜(日本Olympus公司);YFDL20型十功能自动煎药机(北京东华原医疗设备有限公司)。
1.2 试药
制何首乌药材(产自浙江,中国药材集团华邈中药工程技术开发中心,批号:080401)、白蒺藜药材(产自内蒙古,北京晨益药业有限公司,批号:080701),均经中国中医科学院广安门医院中药质检室王建升副主任药师鉴定为真品;丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、碱性磷脂酶(ALP)检测试剂盒均由南京建成生物工程研究所提供。
1.3 动物
昆明种小鼠192只,♀♂兼半,体重(20±2)g,由中国医学科学院实验动物研究所提供(动物生产许可证号:SCXK(京)2004-0001)。
2 方法
2.1 实验剂量确定
笔者前期的最大安全限度实验表明,小鼠对制何首乌和白蒺藜的最大耐受倍数均>100,提示两药毒性甚小[3]。因此,本研究以中国中医科学院广安门医院临床常用剂量作为实验的低剂量,此剂量的5倍作为高剂量。从皮肤科处方可见,制何首乌常用剂量为15 g·d-1,白蒺藜为9 g·d-1。折合成小鼠的实验剂量为制何首乌2.27 g·kg-1,白蒺藜1.36 g·kg-1(按生药量计算)。
2.2 实验药物制备
按临床煎煮水煎剂的流程制备制何首乌药液,并浓缩至含生药量1 g·mL-1;同法制备白蒺藜药液,并浓缩至含生药量1 g·mL-1;制何首乌与白蒺藜按5∶3比例配伍的合煎药液,浓缩至含制何首乌生药量1 g·mL-1,含白蒺藜生药量0.6 g·mL-1。
2.3 分组和给药
设高、低剂量组,将每个剂量组的小鼠均随机分成4组,分别为空白对照、制何首乌、白蒺藜和制何首乌伍用白蒺藜(以下简称“制+白”)组,每组24只,♀♂各半,分笼饲养。低剂量组ig剂量为:空白对照组予等体积的蒸馏水,制何首乌组给药剂量为2.27 g·kg-1,白蒺藜组给药剂量为1.36 g·kg-1,制+白组给药剂量为2.27 g·kg-1(按制何首乌生药量计算,合煎药液中按比例白蒺藜的给药剂量为1.36 g·kg-1);高剂量组ig剂量为各低剂量的5倍。各组小鼠每日禁食禁水6 h后ig,每天1次,连续8周。
2.4 指标测定
观察小鼠给药后的一般情况,并记录体重,根据体重调整给药量。各组小鼠于6周末处死8只,处死前取眼眶血进行肝功能检测,包括ALT、AST、ALP、总胆汁酸(TBA),并留取肝脏;剩余小鼠1/3停药观察2周,1/3按原给药剂量继续ig2周,于8周末处死全部剩余小鼠,处死前取眼眶血进行肝功能检测,并留取肝脏计算肝脏指数[肝脏指数=肝脏重量(mg)/小鼠体重(g)]。
2.5 病理学指标测定
全部小鼠肝脏组织经固定、包埋、染色后行病理学观察。光镜下炎症改变病理分级为:-,正常;±,低倍镜下见炎性细胞浸润灶<3个,炎性细胞数<30个;+,低倍镜下见炎性细胞浸润灶<5个,炎性细胞数<50个;++,低倍镜下见炎性细胞浸润灶>5个,炎性细胞数>50个。空泡变病理分级为:-,正常;±,小叶间可见散在小空泡;+,肝板结构紊乱,可见较多灶状空泡改变;++,肝板紊乱明显,肝索不连续,存在片状空泡改变。
2.6 统计学方法
3 结果
3.1 小鼠的一般情况观察[4]
高、低剂量组在给药6周、8周后,各组小鼠的摄食量、毛发、粪便、呼吸频率和幅度以及活动状态均无差别,体重变化无显著性差异。高、低剂量组小鼠体重测量结果见表1。
表1 高、低剂量组小鼠体重测量结果(±s,n=8)Tab 1 Body weight of mice in high-dose and low-dose groups(±s,n=8)

表1 高、低剂量组小鼠体重测量结果(±s,n=8)Tab 1 Body weight of mice in high-dose and low-dose groups(±s,n=8)
3.2 肝功能测定
高、低剂量组在给药6周、停药恢复2周和给药8周后小鼠血清ALT、AST、ALP和TBA无显著性差异,提示在此剂量范围内使用制何首乌和白蒺藜8周后对小鼠肝酶系统基本无影响,而且制何首乌单用或伍用白蒺藜对小鼠肝酶系统的影响亦无显著性差异。高、低剂量组6周末小鼠血清ALT、AST、ALP和TBA测定结果见表2;低剂量组8周末小鼠血清ALT、AST、ALP和TBA测定结果见表3;高剂量组8周末小鼠血清ALT、AST、ALP和TBA测定结果见表4。
3.3 小鼠肝脏观察
表2 高、低剂量组6周末小鼠血清ALT、AST、ALP和TBA测定结果(±s,n=8)Tab 2 Levels ofALT,AST,ALPand TBAin mice serum in high-dose and low-dose groups after 6 weeks(±s,n=8)

表2 高、低剂量组6周末小鼠血清ALT、AST、ALP和TBA测定结果(±s,n=8)Tab 2 Levels ofALT,AST,ALPand TBAin mice serum in high-dose and low-dose groups after 6 weeks(±s,n=8)
表3 低剂量组8周末小鼠血清ALT、AST、ALP和TBA测定结果(±s,n=8)Tab 3 Levels ofALT,AST,ALPand TBAin mice serum in low-dose groups after 8 weeks(±s,n=8)
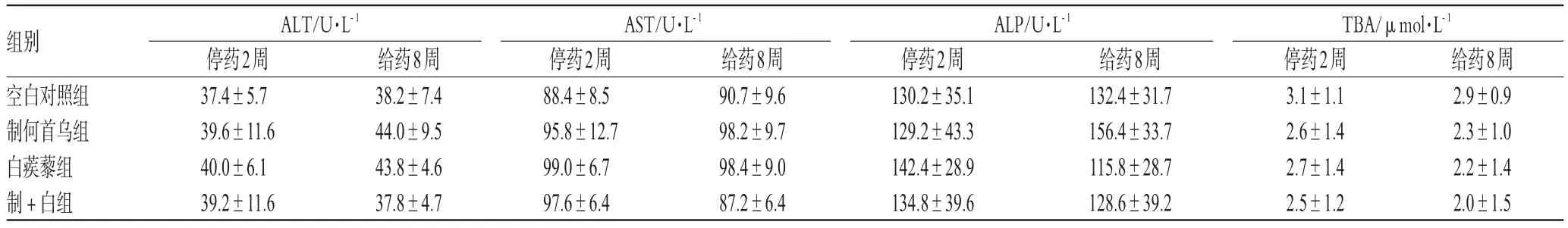
表3 低剂量组8周末小鼠血清ALT、AST、ALP和TBA测定结果(±s,n=8)Tab 3 Levels ofALT,AST,ALPand TBAin mice serum in low-dose groups after 8 weeks(±s,n=8)
表4 高剂量组8周末小鼠血清ALT、AST、ALP和TBA测定结果(±s,n=8)Tab 4 Levels ofALT,AST,ALPand TBAin mice serum in high-dose groups after 8 weeks(±s,n=8)

表4 高剂量组8周末小鼠血清ALT、AST、ALP和TBA测定结果(±s,n=8)Tab 4 Levels ofALT,AST,ALPand TBAin mice serum in high-dose groups after 8 weeks(±s,n=8)
肉眼观察各组小鼠肝脏,大体形态正常,质地柔软,多呈 红褐色,未见结节、包块及囊肿等。高、低剂量组各期小鼠肝脏指数无显著性差异。病理分析结果表明,单用制何首乌会对小鼠肝脏造成炎症改变,与空白对照组比较差异显著(P<0.05),高、低剂量组比较也有显著性差异(P<0.05);尽管单用白蒺藜对小鼠肝脏仅表现轻微炎症反应(与空白对照组比较无显著性差异),但是制何首乌伍用白蒺藜后小鼠肝脏主要以肝板排列紊乱以及空泡变为主(与空白对照组比较差异显著),炎症反应反而减轻,高、低剂量组病变比较亦差异显著(P<0.05)。小鼠肝脏指数测定结果见表5;小鼠肝脏病理分析结果见表6;小鼠肝脏病理形态观察见图1。
表5 小鼠肝脏指数测定结果(±s,n=8)Tab 5 Liver index of mice(±s,n=8)
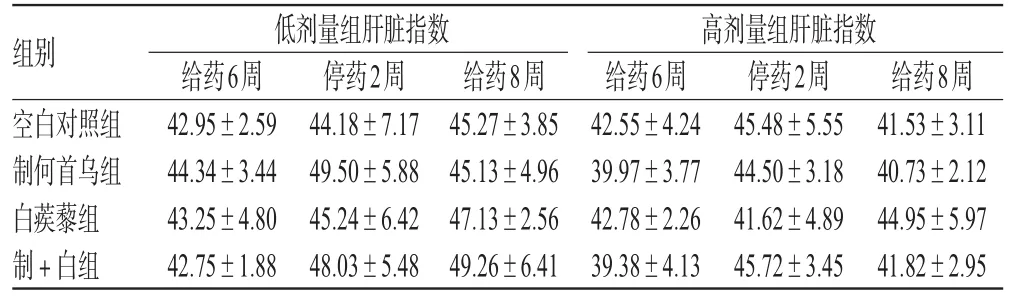
表5 小鼠肝脏指数测定结果(±s,n=8)Tab 5 Liver index of mice(±s,n=8)
组别空白对照组制何首乌组白蒺藜组制+白组低剂量组肝脏指数给药6周42.95±2.5944.34±3.4443.25±4.8042.75±1.88停药2周44.18±7.1749.50±5.8845.24±6.4248.03±5.48给药8周45.27±3.8545.13±4.9647.13±2.5649.26±6.41高剂量组肝脏指数给药6周42.55±4.2439.97±3.7742.78±2.2639.38±4.13停药2周45.48±5.5544.50±3.1841.62±4.8945.72±3.45给药8周41.53±3.1140.73±2.1244.95±5.9741.82±2.95
4 讨论

表6 小鼠肝脏病理分析结果(n=24)Tab 6 Pathomorphological analysis of mice livers(n=24)

图1 小鼠肝脏病理形态观察A.制何首乌组(低剂量,6周);B.制何首乌组(低剂量,8周);C.制何首乌组(高剂量,6周);D.制何首乌组(高剂量,8周);E.白蒺藜组(高剂量、8周);F.制何首乌+白蒺藜组(低剂量,6周);G.制何首乌+白蒺藜组(低剂量,8周);H.制何首乌+白蒺藜组(高剂量,6周);I.制何首乌+白蒺藜组(高剂量,8周)Fig 1 Pathomorphological change of livers in different groupsA.Polygoni Multiflori Radix Praeparata group(low-dose,6 weeks);B.Polygoni Multiflori Radix Praeparata group(low-dose,8 weeks);C.Polygoni Multiflori Radix Praeparata group(high-dose,6 weeks);D.Polygoni Multiflori Radix Praeparata group(high-dose,8 weeks);E.T-ructus terrestris group(high-dose,8 weeks);F.Polygoni Multiflori Radix Praeparata+T.terrestris group(low-dose,6 weeks);G.Polygoni Multiflori Praeparata Radix+T.terrestris group(low-dose,8 weeks);H.Polygoni Multiflori Radix Praeparata+T.terrestris group(high-dose,6 we-eks);I.Polygoni Multiflori Radix Praeparata+T.terrestris group(high-dose,8 weeks)
自从龙胆泻肝丸事件以来,中药的安全性问题已经日益成为关注和研究的热点,特别是慢性疾病长期用药后的蓄积毒性问题。我院近期也出现了数例白癜风患者服用含制何首乌和白蒺藜的中药煎剂后出现肝功能损害的不良反应。因此,本研究通过比较不同剂量下单用制何首乌和制何首乌伍用白蒺藜对小鼠肝脏的毒性作用,提示按临床常用剂量和5倍的高剂量使用8周后,单用制何首乌和白蒺藜以及两药伍用后对小鼠肝酶系统以及肝脏指数均无明显影响。不过,肝脏病理分析的结果却显示,白蒺藜对小鼠肝脏无明显毒性作用,但是长期单用制何首乌会对小鼠肝脏造成炎症改变,而且制何首乌伍用白蒺藜后对小鼠肝脏主要表现为肝板排列紊乱以及空泡变,而炎症反应明显减轻。因此,白蒺藜是否能减轻制何首乌对小鼠肝脏的炎症反应,以及两药伍用后对小鼠肝脏的损伤机制都值得进一步探讨。考虑这两种药物是临床上经常配伍使用的中药,而本研究观察到的病理改变可能与用药剂量和用药疗程均呈正相关,再结合笔者前期的研究工作[3,4],建议对慢性疾病长期用药患者可以采用短疗程持续疗法,即用药2周后停药评价其肝肾及相关系统功能情况,然后再根据患者实际情况继续治疗;另外在用药剂量选择上,应尽可能参照药典标准,除非个别特殊情况,不建议长期大剂量用药。
[1]胡锡琴,杨红莲,张晓琴,等.制何首乌对大鼠肝脏毒理的实验研究[J].陕西中医学院学报,2006,29(3):40.
[2]黄建平,黄文豪.何首乌致肝功能损害1例报道[J].中华医学实践杂志,2006,5(6):693.
[3]夏 蕾,王丽霞,牟稷征.制何首乌和白蒺藜对小鼠毒性作用的实验研究[J].中国医院用药分析与评价,2010,10(1):34.
[4]付书婕,黄建春,王乃平,等.玉郎伞多糖对小鼠急性酒精性肝损伤保护作用的研究[J].中国药房,2009,20(6):406.

