利多卡因及伊布利特在治疗犬长时间心室颤动模型中的疗效比较
刘红臻,钟敬泉,李景莎,苏国英,王静,张运
我国每年约有544000人死于心源性猝死[1],心室颤动是心源性猝死的常见原因,直接影响复苏的成功率。2005年欧洲心肺复苏指南中指出,在2~3次的电击,持续心肺复苏后仍为心室颤动的,应考虑给予抗心律失常药[2]。以往许多研究中,抗心律失常药通常是在心肺复苏中晚期应用,这可能会抵消一部分抗心律失常作用。在心室颤动心肺复苏的早期阶段应用抗心律失常药会不会为心肺复苏带来益处,值得研究。本实验通过建立犬心室颤动模型,在心肺复苏早期阶段应用利多卡因或伊布利特,通过观察血流动力学及电生理指标,比较两种药物对心肺复苏的影响。
1 材料与方法
实验动物与试剂:2010-06至2010-10选择家犬30只,雌雄不限,体重14~19 kg,由山东大学医学院实验动物中心提供。利多卡因:上海福达制药有限公司,产品批号为080523;依布利特:杭州赛诺菲圣德拉堡民生制药有限公司,产品批号为H20020586。
心室颤动模型制作:3%戊巴比妥钠(30mg/kg)静注麻醉,气管插管,连接呼吸机(Newport E-100M,纽波特医疗器械有限公司,美国),在S1WV模式下调整呼吸机参数为:潮气量10~15ml/kg,呼吸频率16~20次/分,吸入氧浓度(FiO250% ~80%),吸气与呼气时间比为 1∶1.5~2.0,呼气末正压为 5cmH2O(0.49 kPa)。将体表心电图连于除颤器(MA0180,惠普公司,美国)监测与记录心电图。穿刺股动、静脉,将压力导管分别送入主动脉和右心房,在X线下确定导线位置,并连于多导电生理记录仪(PowerLab系统,AD Instruments公司,澳大利亚),监测与记录主动脉压力和右心房压力。制作心室颤动模型:将体外电刺激器火线端与零线端的导电针头分别插入心前区右上方与左下方的皮下,以80 V持续刺激5秒即可成功的诱发持续心室颤动。心室颤动成功的标准:①心电图示心室颤动波形;②主动脉压力失去波动,降至10~20mmHg(1mmHg=0.133 kPa)以下。
实验分组:心室颤动模型一旦成功建立,即撤除呼吸机,心室颤动持续12分钟后立即进行2分钟胸外按压,实验中固定三人徒手按固定顺序轮流按压:每人按压2 min,并通过POWERLAB系统监测压力波形判断和保证按压的效果,使频率控制在100~120次/分,放松时胸廓恢复到正常位置,按压/放松时间大致相等。随即100J双向波电除颤,仍为心室颤动的犬随机分为3组(每组8只),分别给与相应药物:利多卡因组:利多卡因(1.5mg/kg)联用肾上腺素(0.02mg/kg);伊布利特组:伊布利特(0.01mg/kg)联用肾上腺素(0.02mg/kg);对照组:只应用肾上腺素(0.02mg/kg)。用药时胸外按压不间断,每2分钟的心肺复苏后进行1次电除颤,除颤能量均为150 J,如心室颤动持续存在,上述剂量的药物每5分钟重复用1次,如此周而复始。终点事件为达到自主循环恢复(主动脉收缩压≥80mmHg,持续时间≥1 min[3])。
血流动力学指标:实验过程中监测与记录主动脉收缩压与舒张压及右心房收缩压与舒张压,心肺复苏过程时的冠状动脉灌注压等于主动脉舒张压减右心房舒张压。分别统计用药2 min、4 min、6 min、8 min、10 min后的冠状动脉灌注压以及达到自主循环恢复后的主动脉平均压、右心房平均压及冠状动脉灌注压。
电生理指标:记录基础状态及成功心肺复苏后动物的QT间期,心率和R-R间期。用Bazett’s公式计算出校正的QT间期(QTc)。
2 结果
三组动物基础状态下各个参数指标差异无统计学意义(P>0.05)(表1)。
表1 三组动物基础状态下各参数指标(n=8,)
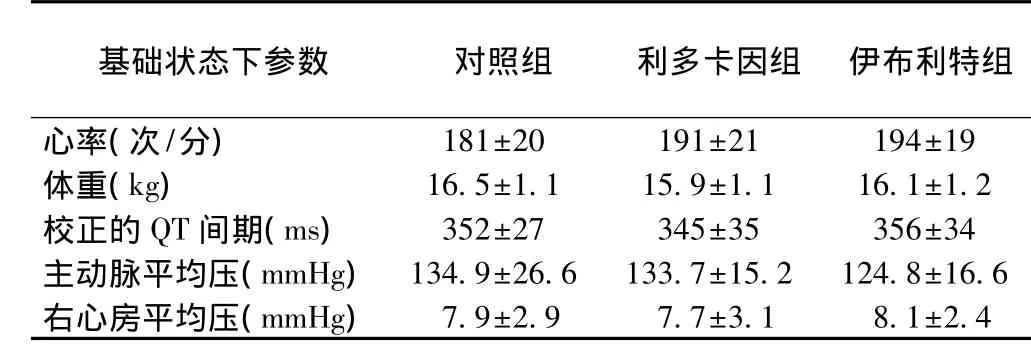
表1 三组动物基础状态下各参数指标(n=8,)
注:1mmHg=0.133 kPa
?
用药后第8 min、第10 min,利多卡因组及伊布利特组动物的冠状动脉灌注压高于对照组,差异有统计学意义(P<0.05),其余各时间点的冠状动脉灌注压3组间差异无统计学意义(P>0.05)(表2)。
表2 三组动物用药后冠状动脉灌注压的比较(n=8,)
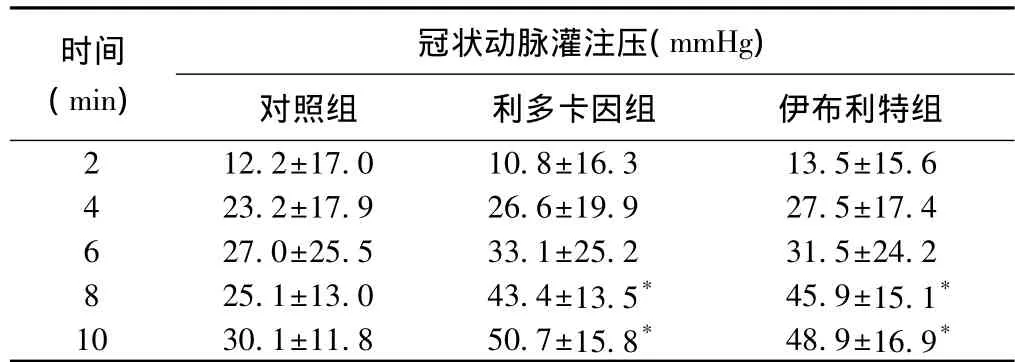
表2 三组动物用药后冠状动脉灌注压的比较(n=8,)
注:与对照组比较 *P<0.05。余注见表1
?
利多卡因组、伊布利特组和对照组动物达到自主循环恢复的数量分别为6只、6只、5只。利多卡因组及对照组动物的QTc明显低于伊布利特组,差异有统计学意义(P<0.05)。利多卡因组及伊布利特组动物的主动脉平均压、冠状动脉灌注压均高于对照组,差异有统计学意义(P<0.05),且利多卡因组及伊布利特组动物的除颤能量低于对照组,差异有统计学意义(P<0.05)。三组动物的右心房平均压差异无统计学意义(P>0.05)(表3)。
表3 三组动物自主循环恢复后各参数指标的比较()
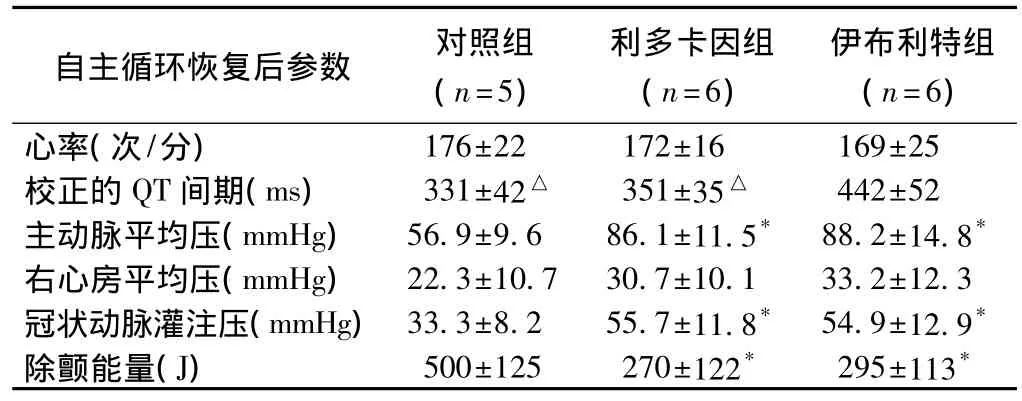
表3 三组动物自主循环恢复后各参数指标的比较()
注:与对照组比较*P<0.05;与伊布利特组比较△P<0.05。余注见表1
自主循环恢复后参数 对照组(n=5)利多卡因组(n=6)伊布利特组(n=6)176±22 172±16 169±25校正的QT间期(ms) 331±42△ 351±35△ 442±52主动脉平均压(mmHg) 56.9±9.6 86.1±11.5* 88.2±14.8*右心房平均压(mmHg) 22.3±10.7 30.7±10.1 33.2±12.3冠状动脉灌注压(mmHg)33.3±8.2 55.7±11.8* 54.9±12.9*除颤能量(J) 500±125 270±122* 295±113心率(次/分)*
3 讨论
心室颤动时及时应用抗心律失常药对稳定心电起重要作用。传统抗心律失常药利多卡因起效快,用法简单,临床上可用于无脉搏、对电复律和肾上腺素治疗无效的室性心动过速、心室颤动[4]。利多卡因通常不影响心肌收缩力、动脉血压。利多卡因对心脏的直接作用是抑制Na+内流,促进K+外流,通过降低4相除极速率而提高阈电位,从而提高致颤阈值。心室颤动发生时部分心肌缺血,导致缺血区和正常心肌之间动作电位持续时间不均一,利多卡因可以减少这种不均一性,并且可以延长缺血组织的传导时间和不应期,使得折返波不易形成,心室颤动也就不能维持下去。
伊布利特属于Ⅲ类抗心律失常药,对多种离子通道有作用。伊布利特通过抑制复极时K+外向电流、促进平台期缓慢内向Na+电流及Ca2+电流,可延长心肌动作电位时限、QT间期及有效不应期,从而发挥抗心律失常的作用。Wood等[5]对一组55例冠状动脉疾病患者的电生理研究中发现,应用伊布利特后有44%的患者不能再次诱发出单行型室性心动过速,并且发现心室肌的有效不应期、QTc和心室单相动作电位时程均延长。Buchanan等[6]的研究也证实在狗的心肌梗死模型上伊布利特抑制心室颤动和室性心动过速的发生,并且可以降低除颤阈值。同利多卡因一样,伊布利特起效快,各种动物模型及临床研究均表明,伊布利特对心率、血压及其他血流动力学指标明显影响[7],无明显负性肌力作用,不会加重心力衰竭。Stambler等[8]对一组左心室射血分数<0.35的患者静脉注射伊布利特,结果显示,患者的心输出量,平均动脉压和肺毛细血管楔压与对照组相比无明显改变。
冠状动脉灌注压与心肌血流量,自主循环恢复,24小时出院率呈正相关。复苏中如果有动脉血压监测,则应最大限度提高动脉舒张压以提高冠状动脉灌注压。动物实验模型中,在无冠状动脉疾病的前提下,冠状动脉灌注压达到15~20mmHg预示着能够达到自主循环恢复。本实验结果显示,利多卡因及伊布利特组动物达到自主循环恢复时的平均动脉压及冠状动脉灌注压明显高于对照组,推测导致该结果的原因是伊布利特及利多卡因能够很好的稳定心电活动,使得心肌的电—机械耦联趋于规则,从而使血流动力学相对稳定。Ⅲ类抗心律失常药物是否发挥作用,QT间期延长是一个重要表现。伊布利特组动物的QT间期延长,表明伊布利特正在发挥着抗心律失常作用。但QT间期过度延长是发生恶性心律失常如多形性室性心动过速的一个危险因素,应该密切观察QT间期变化,使其维持在安全范围之内。
本实验也存在着不足:首先,实验的动物是健康的成年犬,与临床上通常的病理状态不尽相同;其次,只是以自主循环恢复为实验终点,没有研究生存率是否存在差异;最后,本实验采用的是电击诱发心室颤动的动物模型,是否适合临床上常见的缺血性诱因,有待于进一步的研究和论证。
[1]Hua W,Zhang LF,Wu YF,et al.Incidence of sudden Cardiac Death in China:Analysis of 4 Regional Populations.J Am Coll Cardiol,2009,54:1110-1118.
[2]International Liaison Committee on Resuscitation.2005 International consensus on cardiopulmonary resuscitation and emergency cardiovascular care science with treatment recommendations.Resuscitation,2005,67:181-341.
[3]James J,Clifton W,Lawrence D.Ventricular fibrillation scaling exponent can guide timing of defibrillation and other therapies.Circulation,2004,109:926-931.
[4]蒋文平.心律失常药物治疗的点评.中国心脏起搏与电生理杂志,2005,19(4):243-245.
[5]Wood MA,Stambler BS,Ellenbogen KA,et al.Suppression of inducible ventricular tachycardia by ibutilide in patients with coronary artery disease.Ibutilide Investigators.Am Heart J,1998,135(6 Ptl):1048-1054.
[6]Buchanan LV,Kabell G,Turcotte UM,et al.Effects of ibutilide on spontaneous and induced ventricular arrhythmias in 24-hour canine myocardial infarction:a comparative study with sotalol and encainide.J Cardiovasc Pharmacol,1992,19:2556-2563.
[7]Matks TA,Terry RD.Developmental toxicity of ibutilide fumarate in rats.Teratology,1994,49:406.
[8]Stambler BS,Wood MA,Ellenbogen KA,et al.Efficacy and safety of repeated intravenous doses of ibutilide for rapid conversion of atrial flutter or fibrillation.Circulation,1996,94:1613-1621.

