多巴胺在L-半胱氨酸修饰玻碳电极上的电化学行为及伏安测定
吴 影,李念兵
(1.西南大学化学化工学院,重庆 北碚 400715;2.重庆文理学院,重庆 永川 402160)
生物电活性分子电化学行为的研究仍是当今电化学和分析电化学中较为活跃的领域,愈来愈受到科研工作者的高度重视.多巴胺(Dopamine,DA)作为神经中枢系统内天然存在的一种极为重要的儿茶酚胺类神经递质,同时又能独立存在于脑组织;然而当脑组织内的多巴胺神经功能发生失调的时候,就会导致精神分裂症和帕金森氏症等恶性疾病[1-3].这引起了众多学者利用现代分析研究方法测定它在人体血液中的微量存在的浓厚兴趣.国内外分析检测DA的主要研究手段有:荧光光度法、反相或流动注射-化学发光法、气相色谱-质谱法、胶束电动毛细管色谱法等[4-8].然而,DA在传统的Au,Ag,Pt等金属电极和碳电极表面发生电化学反应的时候,过电位颇高,响应信号较低,容易受到电极反应产物的污染,从而致使电极表面发生“钝化”.近些年来,随着电化学的不断深入发展,人们发现当在裸电极表面引入一层适当的氨基酸薄膜之后,能够增加DA在修饰电极表面的传质速率,从而实现DA的高灵敏度、高选择性测定.本文研究了L-半胱氨酸(L-Cysteine)在玻碳电极(GCE)上的修饰条件,制备了L-半胱氨酸修饰玻碳电极,研究了在此电极上的电化学行为,实现了DA的伏安测定.
1 实验部分
1.1 仪器和试剂
仪器:LK2005A电化学分析仪(中国,天津兰力科仪器公司);pH B-4酸度计;AS10200AT超声波清洗机;PG-2A机械抛光机;传统三电极体系:L-半胱氨酸修饰玻碳电极(L-Cys/GC电极)为工作电极,饱和甘汞电极(SCE)为参比电极,铂丝为对电极.
试剂:L-半胱氨酸(L-Cysteine,上海索宝生物技术有限公司);多巴胺(Dopamine,重庆川东化工有限公司);0.1mol/L混合磷酸盐(PBS)缓冲溶液均由 0.2 mol/L NaH2PO4、0.2 mol/L Na2HPO4和0.1mol/L KCl储备液配置,采用0.5mol/L NaOH和0.5mol/L H3PO4调节至所需pH值.其它化学试剂及药品均采购于重庆北碚化学试剂厂(分析纯),实验所用水为二次蒸馏水.
1.2 L-Cys/GC电极的制备方法
将玻碳电极(Φ=3mm)分别经细金相砂子打磨光滑,机械抛光成镜面,电化学活化预处理及超声清洗洁净后作为工作电极,SCE为参比电极,铂丝电极为对电极,将该三电极体系浸入浓度为0.01mol/L的L-半胱氨酸的PBS缓冲溶液(pH=6.864)中,采用循环伏安法在 -0.8~0.6 V电位范围内,以100mV/s的扫速重复循环扫描10周,即可制得L-Cys/GC电极.
1.3 分析测试方法
采用循环伏安法在50mL容量瓶中加入一定量的DA标准溶液,用pH为6.864的PBS稀释至刻度,摇匀,倒入电解池中.采用传统三电极体系:L-Cys/GC电极为工作电极,SCE为参比电极,铂丝电极为对电极,放置于DA溶液中,开路搅拌富集20 s后,在-0.2~0.6 V电位扫描范围内以100mV/s的扫描速率扫描,记录循环伏安曲线,测量电流-电位图上氧化还原峰的峰电流.每次扫描结束后,将电极置于空白底液中循环扫描至无峰,滤纸吸干后,即可再生.
2 结果与讨论
2.1 L-Cys在玻碳电极上的修饰
实验考查了不同修饰剂浓度、pH、扫描速率及电位范围对DA的电催化作用的影响.结果表明:当修饰底液 pH 为 6.684、L-Cys浓度为0.01mol/L、电位范围为 -0.8 ~0.6 V、扫描速率为100mV/s时,随着扫描周数的增加,DA的氧化峰和还原峰的峰电流都同时逐渐增加.这充分说明L-Cys逐渐被修饰到玻碳电极表面形成了一层薄膜,因而才会对DA产生明显的电催化作用,并且其电催化作用也越来越强.扫描次数为10周时,所得修饰电极最佳.
2.2 DA在L-Cys/GC电极上的电化学行为
图1为3.0×10-4mol/L DA 在 PBS(pH=6.684)中,在L-Cys/GC电极(a)和裸GC电极(b)上的CV曲线.图1表明,在b电极上,DA出现了一对极其微弱的类似于“馒头”的氧化还原峰,峰电流很低;而在a电极上,则出现了一对明显的氧化峰和还原峰,峰电流比值略大于1,峰电位分别约为 Epa=0.180 V、Epc=0.125 V,峰电位差△E=55mV.根据可逆体系中△E=Epa-Epc=0.059 V/n可得,DA在电极表面发生的电子转移数目n为1,与文献[9]报道的结果一致.这就说明了L-Cys薄膜加速了DA在玻碳电极表面电子转移的速率,从而起到对DA优良的电化学催化作用,即是L-Cys膜对DA的电化学反应起到了明显的促进作用,比其在裸GC电极上更容易发生电化学反应.
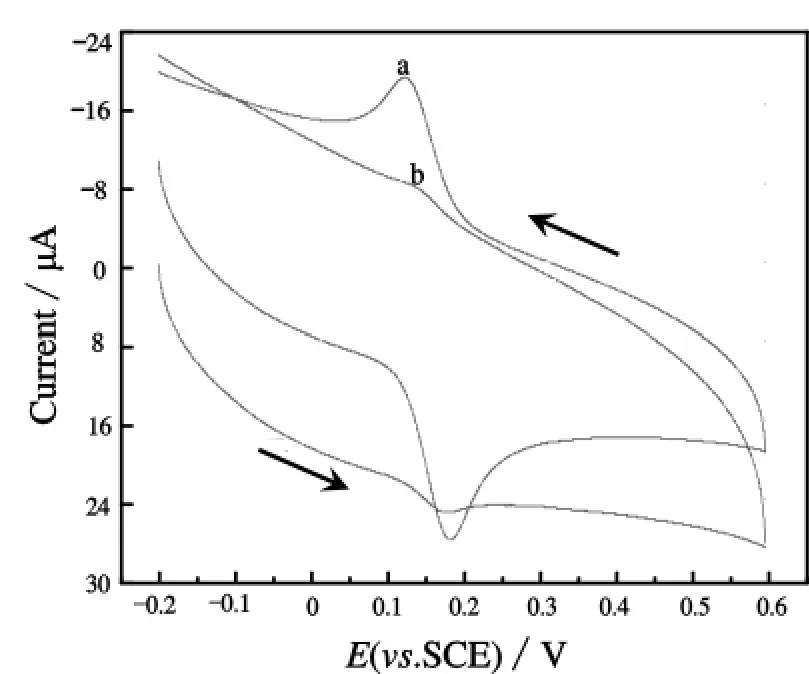
图1 DA在L-Cys/GC电极和裸GC电极上的循环伏安曲线
2.3 电化学测试条件的选择与优化
2.3.1 缓冲体系的选择
实验分别考察了邻苯二甲酸氢钾、NaAc-HAc、混合磷酸盐、四硼酸钠等缓冲体系.结果显示,在混合磷酸盐缓冲体系中,DA在修饰电极上的峰形最好,峰电流稳定,且电极重现性也很好.因此本实验选择0.1mol/L PBS体系作为缓冲介质.
2.3.2 pH值的选择
考察了修饰玻碳电极在pH为4.0~9.0的磷酸盐缓冲溶液体系中的影响.结果如图2所示,当pH为6.864时,峰电流达到最大值.同时,就DA的氧化反应过程而言,电化学反应进行的效果明显优于还原反应过程.故实验选用pH为6.864的PBS缓冲溶液作为测试介质的最佳pH值.
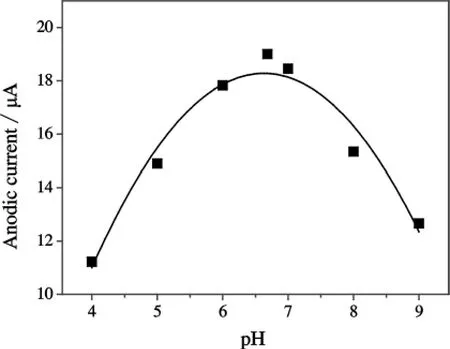
图2 DA的氧化峰峰电流与pH值的关系
2.3.3 富集时间的选择
含有5×10-4mol/L的 DA在 pH=6.864的PBS缓冲溶液体系中,分别搅拌富集1、5、10、20、30 s的修饰电极作为工作电极,结果发现,在-0.3~0.6 V电位范围,随着富集时间的增加峰电流也在逐渐增大,但20 s以后,峰电流趋于稳定,在20 s所得循环伏安曲线峰型最好、峰电流最大.故实验选择富集时间为20 s.
2.4 实验测定线性范围和检出限
在最佳实验条件下,对于DA的氧化过程,测定得出DA的氧化峰电流(Ipa)与其浓度在1×10-3~1.0×10-6mol/L范围呈现出良好的线性关系,如图3所示,其线性回归方程Ipa(μA)=-9.80379 logC(DA)+59.40981,相关系数 R2=0.99231.最低检出限可低至 1.0 ×10-7mol/L(S/N=3).
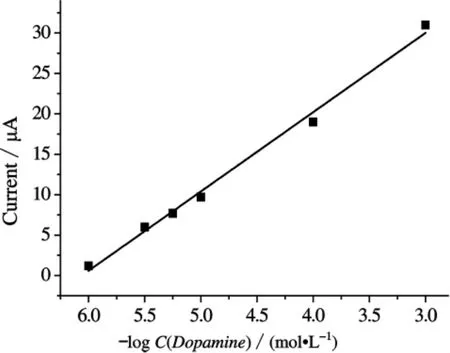
图3 阳极氧化峰电流与DA浓度的关系
2.5 电极的稳定性和重现性
实验中,将优化条件下制得的修饰电极每次用于DA的测定后,保存在pH=6.864的PBS缓冲溶液中再用于对DA的测定,响应信号仍然保持在98.5%以上,说明该方法制得的L-Cys/GC电极具有良好的稳定性.用此修饰电极对1×10-4mol/L的多巴胺重复测定50次,峰电流基本保持不变,其相对标准偏差约为2.5%,表明此电极用于DA的测定具有良好的重现性.
3 结论与展望
在实验中,采用循环伏安法制备了L-Cys/GC电极,研究了DA在L-Cys/GC电极上的电化学行为,并利用该电极对微量DA进行测定.结果表明,L-Cys/GC电极表现出较高的稳定性和重现性,测定DA的灵敏度高,线性范围宽,检出限低,可望将其进一步微型化发展为超微电极或微电极,应用于实际样品或者生物活体内的神经递质DA的测定及相关研究.
[1]Neubold C,Kalcber K,Diewald W,et al.Voltammetric determination of nitrate with a modified carbon paste electrode[J].Electroanalysis,1994(6):227-236.
[2]Gerhardt G A,Gezanagy O G,Moghaddam B,et al.Nafion-coated electrode with high selectivity for CNS electrochemistry[J].Brain Research,1984,290:390-395.
[3]Rice M E,Oke A,Bradberry C W,et al.Simultaneous voltammetric and chemical monitoring of dopamine release in situ[J].Brain Reseach,1985,340:151-155.
[4]陈亚红,田丰收,曹丽娟.酶催化动力学光度法测定盐酸多巴胺[J].药物分析杂志,2010,30(2):314-316.
[5]龙云,李东辉,冯建章,等.利用荷移反应分光光度法测定针剂中的多巴胺[J].分析化学,1997,25(8):11-13.
[6]吴霞,童裳伦,苏本玉,等.荧光光度法测定多巴胺[J].分析化学,1999,27(9):1069.
[7]朱庆仁,孙登明,张宏兵.聚组氨酸修饰电极测定DA的研究[J].淮北煤师院学报:自然科学版,2001,22(4):26-29.
[8]Zhang H M,Li N Q,Zhu Z W.Electrocatalytic response of dopamine at a DL-homocysteine self-assembled gold electrode[J].Microchem J,2000,64(3):277-282.

