犬瘟热病毒重组囊膜糖蛋白(H/F)全长质粒的构建
王 磊 ,冯 娜 ,李天松 ,刘玉秀 ,高玉伟 ,王铁成 ,杨松涛 ,夏咸柱
(1.军事医学科学院军事兽医研究所,吉林 长春 130062;2.吉林农业大学,吉林 长春 130062;3.吉林省人兽共患病预防与控制重点实验室,吉林 长春 130062)
犬瘟热是由副黏病毒科麻疹病毒属的犬瘟热病毒(CDV)引起多种动物的一种急性、热性、高度接触性病毒性传染病[1]。CDV自然感染宿主在不断扩大,除犬科动物外,还可感染大熊猫、小熊猫、狮、虎和豹等食肉目所有8个科,偶蹄目猪科、灵长目的猕猴属和鳍足目海豹科等多种动物。国内外对犬瘟热的预防仍然主要依赖于弱毒疫苗,而弱毒疫苗在使用过程中存在返祖、首免时受到母源抗体的干扰、引起一过性的免疫抑制和血小板减少、导致免疫动物发生脑炎等现象[2],因此,犬瘟热病毒新型疫苗的研究迫在眉睫。
反向遗传学技术(reverse genetic technique)是上世纪90年代在分子病毒学研究领域兴起的新技术,也被称为“病毒拯救( the rescue of virus)”。1994年Schnell利用反向遗传学技术首次成功拯救出狂犬病毒(RV),为负链RNA病毒的研究提供新的思路[3]。运用反向遗传技术可从cDNA水平进行RNA病毒改造,可以有目的地改变病毒基因组结构,获得有感染性的重组病毒,从而研发出新型减毒活疫苗和新型病毒表达载体[4]。本实验室已经成功构建了CDV/R-20/8弱毒株全长cDNA质粒和病毒蛋白N、P、L基因的辅助表达质粒,利用T7启动子和表达T7 RNA聚合酶的BSR细胞构成的表达系统进行病毒拯救,获得成功。在此基础上我们对全长cDNA质粒进行定向改造,将本病毒本身的F和H基因序列插入到M基因前非编码区,构建带有双囊膜糖蛋白的全长cDNA质粒,为下一步拯救具有双囊膜糖蛋白基因的CDV和开展更为安全高效的重组CDV活载体疫苗及CDV病毒相关机制的研究奠定技术基础。
1 材料与方法
1.1 材料
犬瘟热病毒CDV/R-20/8疫苗株的反向遗传操作系统及表达绿色荧光蛋白的重组犬瘟热病毒全长质粒(pCI-CDV-EGFP)、含犬瘟热病毒H和F基因的重组质粒pBluescript-F和pBluescript-H由中国农业科学院哈尔滨兽医研究所人畜共患病研究室提供;T4 DNA连接酶、Pme I限制性内切酶购自NEB公司;其它限制性内切酶均购自 TaKaRa 公司;Dephospharylation(BAP)Kit、2×PCR Solution Premix PrimeSTARRHS 购自TaKaRa公司;DH5α、TOP10感受态细胞购自北京全式金公司;质粒小量提取试剂盒、凝胶回收试剂盒购自AXYGEN公司。
1.2 方法
1.2.1 重组质粒pBluescript-F和pBluescript-H的转化及回收
重组质粒pBluescript-F和pBluescript-H转化DH5α感受态细胞,采用热激法转化,氨苄抗性平板筛选阳性菌落后挑取单菌落,用LB培养基进行摇菌,菌液OD值达0.5时按AXYGEN小提试剂盒进行质粒小量提取,1%琼脂糖凝胶电泳和分光光度计对质粒大小和浓度进行鉴定。
1.2.2 重组质粒 pBluescript-F、pBluescript-H、pCI-c1-EGFP酶切及载体去磷酸化
用PmeI限制性内切酶对重组质粒pBluescript-F、pBluescript-H、pCI-c1-EGFP(c1 为 CDV基因组中的一段450 bp序列,在犬瘟热病毒全基因中的位置为2962~3371)分别进行单酶切,按AXY GEN凝胶回收试剂盒说明书回收酶切产物CDV-F、CDV-H基因片段及pCI-c1载体。pCI-c1载体回收后两端为平末端,防止载体出现自连需去除5’端磷酸基团,按 Dephospharylation(BAP)Kit说明书操作,反应体系 50μL :10 ×BAP Buffer 5μL 、Bacterial Alkaline Phosphatase(BAP)2.5μL、载体片段 30μL、双蒸馏水补至50μL。65℃水浴30min,去磷结束后回收载体,加入50μL的灭菌蒸馏水,即终体积为100μL,加入 300μL的 Buffer DE-A 及 150μL Buffer DE-B,混合均匀后置于制备管中,后续操作与凝胶回收一致。纯化后的载体及CDV-F和CDV-H基因片段分别取出1μL进行1%琼脂糖凝胶电泳鉴定大小及浓度。
1.2.3 pCI-c1-F和pCI-c1-H质粒的构建
根据纯化后载体与F、H目的片段按载体:片段摩尔比1:3进行连接,连接用10μL反应体系:10×T4 DNA 连接酶 Buffer 1μL、T4 DNA 连接酶 0.5μL、载体 2.5μL、目的基因片段(CDV-H、CDV-F)6μL。16℃连接过夜。热激法转化DH5α感受态细胞。分别用EcoR I和BglII内切酶鉴定pCI-C1-F和pCI-C1-H质粒,1%琼脂糖凝胶电泳检测。
1.2.4 全长质粒pCI-CDV-F和pCI-CDV-H的构建
对全长质粒pCI-CDV-EGFP和正向连接的重组pCI-c1-F和pCI-c1-H质粒用Sal I和Mlu I同时进行双酶切,全长质粒回收大载体(pCI-CDV-),重组pCI-c1-F和pCI-c1-H质粒回收c1-F和c1-H目的基因片段。根据载体与目的片段大小和浓度,将载体与目的基因片段摩尔比为1:10进行16℃连接过夜,转化TOP 10感受态细胞,平板30℃倒置培养,大量筛选阳性克隆并分别命名为pCI-CDV-F、pCI-CDV-H。
1.2.5 重组全长质粒鉴定
1.2.5.1 PCR鉴定
根据犬瘟热病毒CDV/R-20/8疫苗株全基因序列,用Primer 5.0软件设计3对引物,由北京华大基因公司合成,引物序列如下:

PCR 反应总体系 25μL:灭菌纯水 18.25μL、10×ExBuffer 2.5μL、2.5mmol/L dN TP 2μL、ExTaq 0.25μL、上游引物(20 pmol/μL)0.5μL、下游引物(20 pmol/μL)0.5μL、重组质粒 1μL。PCR 反应条件为:95℃预变性 5min;95 ℃变性 30 s,50 ℃退火 40 s,72 ℃延伸1.5min,35个循环:72℃终延伸10min。PCR产物经1%琼脂糖凝胶电泳鉴定结果。
在后备牛不同年龄阶段,生长速度可能会影响乳房发育,但是在断奶之后有影响,并不是断奶前。图1可以看出,3月龄前,体重生长曲线和乳腺增长曲线完全一致,这意味着,在3月龄前,不管怎么饲养,提供的营养物质是高或是低,牛长得快或慢,都不会对乳腺组织发育产生影响,即不会对后期产奶产生影响。
c引物扩增完整外源基因:
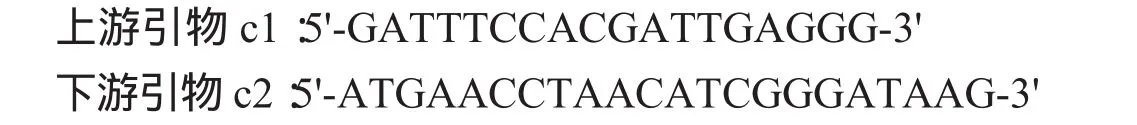
PCR反应总体系为 50μL,用 Premix Prime STAR HS预混液进行扩增,扩增条件:95℃预变性5min;98 ℃ 变性 10 s,55 ℃退火 15 s,72 ℃ 延伸 3min,35个循环;72℃延伸10min。PCR产物经1%琼脂糖凝胶电泳鉴定扩增结果,初步鉴定正确后将PCR产物进行精测序。
1.2.5.2 酶切鉴定
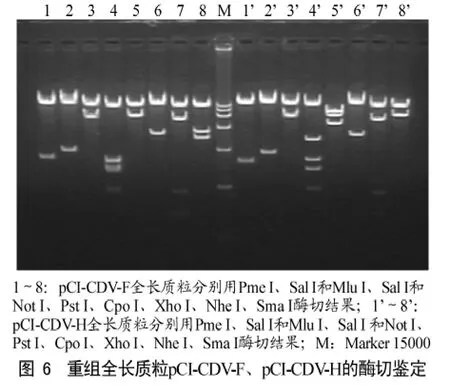
初步使用Pme I单酶切和Sal I+Mlu I双酶切进行鉴定,鉴定正确后用Sal I+Not I进行双酶切及用 Pst I、Cpo I、Xho I、Nhe I、Sma I进行单酶切鉴定,酶切鉴定体系都为20μL,酶切体系和条件按TaKaRa内切酶说明书操作过程见图1和2示意图。


2 结果
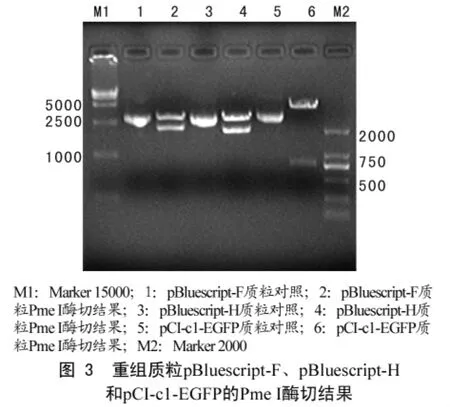
2.1 重组质粒 pBluescript-F、pBluescript-H和pCI-c1-EGFP的Pme I酶切结果
质粒pBluescript-H和pBluescript-F中,H和F基因两端分别设计成相同的PmeI位点,单酶切时分别可以切下大小为 2036 bp(CDV-F)和 1886 bp(CDV-H)的目的片段,质粒pCI-c1-EGFP中,EGFP基因两端为PmeI酶切位点,可切下726bp的片段(图3)。
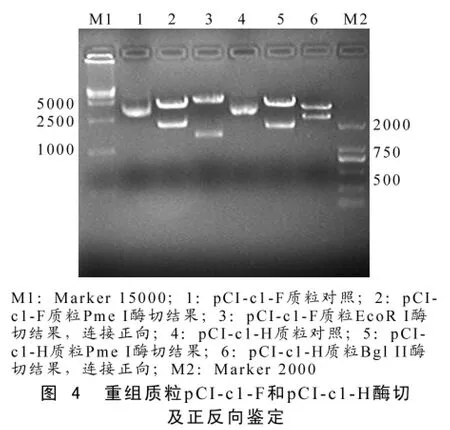
2.2 重组质粒pCI-c1-F和pCI-c1-H酶切及正反向鉴定
Pme I酶切后为平末端,CDV-F和CDV-H基因连接到pCI载体上后需进行正反向鉴定,用EcoR I酶切pCI-c1-F质粒后若是正连,酶切结果为:1413 bp和4987 bp;若反连,酶切结果为575 bp和5825 bp。对pCI-c1-H质粒,若正连,Bgl II内切酶进行酶切后可切出3724 bp和2468 bp;若是反连,酶切后可以切出4745 bp和1078 bp。图4结果显示筛选出连接正确的阳性重组质粒pCI-c1-F和pCI-c1-H。
2.3 重组全长质粒pCI-CDV-F、pCI-CDV-H PCR及酶切鉴定
PCR鉴定过程中,上游引物在插入的CDV-F和CDV-H基因中,下游引物在插入基因的外面,对CDV-F基因,上游引物在6352 bp位置(F基因在全基因组中的位置为:4935~6923 bp),对CDV-H基因,上游引物在7954 bp位置(H基因在全基因组中的位置为:7079~8902 bp);下游引物在全基因组中的位置为4043 bp,以上两种基因插入的位置为全基因组中3371 bp,因此若无目的片段插入,两对引物均不能扩增出条带;对pCI-CDV-F质粒,若正确插入目的片段,可扩增出1243 bp片段;对pCI-CDV-H质粒,可扩增出1611 bp片段。而第三对引物扩增出的片段大小 pCI-CDV-F为2686 bp、pCI-CDV-H为 2536 bp。如图5所示PCR扩增结果均正确。
2.3.2 酶切鉴定结果
CDV-H和F基因两端均为Pme I酶切位点,用此酶进行单酶切时可以从全基因质粒中切出CDV-F为2036 bp和CDV-H为1886 bp的片段。Pme I酶切位点上游410 bp左右的位置含Sal I酶切位点,下游2 bp位置含Mlu I酶切位点,用以上两种酶同时进行双酶切,可以从全基因质粒中酶切出目的片段为:CDV-F(2486 bp)、CDV-H(2336 bp)。酶鉴定正确后,用 Noc I、Xho I、Sma I、Nhe I、Pst I进行单酶切鉴定,Sal I+Not I进行双酶切鉴定全长质粒丢失情况,鉴定结果如图6所示,没有发现质粒丢失,与计算结果一致。

3 讨论
犬瘟热病毒基因组为非分节段的单股负链RNA。负链RNA病毒的主要特点是基因组RNA不具有感染性,而且裸露的基因组RNA本身也不能作为模板,只有在与核蛋白N/NP结合成核糖核蛋白(RNP)复合体后,才能作为模板起始复制和转录,并表达和包装出活病毒,关键是获得有功能的RNP[5]。RNA病毒感染性克隆的构建,实现了从病毒整体与分子之间、病毒与宿主关系方面研究病毒的毒力和致病性。采取基因敲除、插入、置换、或构建嵌和病毒等方法对病毒基因功能进行研究,本研究旨在将犬瘟热病毒的囊膜糖蛋白插入到M基因前面的非编码区,构建重组CDV cDNA全长质粒。使用了pCI真核表达载体,CMV/T7启动子的反向遗传操作系统。T7启动子是一种具有高特异性和功能强大的原核启动子,但在真核细胞感染表达T7 RNA聚合酶的BSR细胞(本实验室已经成功在BSR细胞中拯救出犬瘟热病毒),同样可以使真核细胞中的T7启动子序列发挥转录作用[6]。
CDV囊膜表面的纤突是由H和F两种糖蛋白组成的[7]。研究表明H、F蛋白是宿主免疫系统的主要目的抗原,是产生中和抗体的重要抗原。二者在病毒的吸附和侵入宿主细胞过程中起作用,病毒通过H蛋白吸附到细胞表面的受体上,并协助F蛋白介导病毒囊膜与宿主细胞膜、感染细胞与非感染细胞的融合,使病毒在宿主体内扩散。H蛋白主要诱导了体液免疫,并且抗CDV H蛋白单克隆抗体(MoAb)具有中和病毒活性;F蛋白诱导的免疫反应能阻止病毒感染,并且在有病毒增殖的情况下抑制症状的发生。用相关或非相关病毒的糖蛋白基因取代自身糖蛋白基因后的重组病毒也已成功用于疫苗研制[8]。在狂犬病毒(RV)研究中,RABV G 蛋白是唯一的膜蛋白并诱导VNA(中和抗体)的产生,额外的RABV G 蛋白(2个或3个)被克隆至RABV 基因组,并成功拯救出携带2~3个G蛋白基因的衰减病毒,使得G蛋白表达量增加,其致病性进一步下降,免疫原性提高,由此可见,过度表达G蛋白可潜在的增强适应性免疫应答及提高保护率[9-10]。本研究选择囊膜糖蛋白并分别构建了双囊膜糖蛋白基因的全长质粒,其目的就是想借助反向遗传操作平台进行免疫原性比较,筛选出致病性低、免疫原性好的致弱犬瘟热病毒疫苗株,并对其致病机理进行进一步探讨。
病毒基因组全长片段的克隆是反向遗传操作技术的关键环节,全长cDNA克隆的稳定性严重制约病毒拯救的效率。本试验在筛选全长质粒中存在着大量质粒片段丢失情况,用DH5a感受态细胞先后转化筛选数百次都未获得成功,改用TOP10感受态细胞时,将转化后氨苄筛选平板温度降低到30℃进行培养,挑取阳性菌落后在30℃环境中液体摇菌培养,最终筛选出完整的全长质粒。这种病毒基因组插入载体转化大肠杆菌后易出现突变、重排、缺失、插入和替换现象,原因之一可能是重组质粒中的某些基因对宿主菌有毒性,使有重组载体的菌死亡或者宿主菌为存活需要对重组载体进行“改造”,从而导致了全长基因克隆的不稳定[11]。
表达细胞色素C的重组狂犬病毒可以加速细胞凋亡,进而增强免疫应答并降低致病性。在病毒基因组表达细胞因子可以潜在增强病毒的免疫应答,进而起保护作用[12],为下一步定向改造犬瘟热病毒提出另一路线。以构建CDV全长cDNA质粒为基础,进行基因突变或与其它疫苗株及野生毒株基因置换,以及天然免疫相关细胞因子的插入研究等,可以建立CDV免疫原性和致病性的研究平台,同时引入外源基因进行表达,提高疫苗的保护率等方面的研究正在进行。
[1]鞠会艳,高玉伟,夏咸柱,等.犬瘟热病毒小熊猫株核蛋白和融合蛋白基因克隆及序列分析[J].东北农业大学学报.2010,41(5):112-119.
[2]程世鹏,易立.犬瘟热病原学研究进展[J].特产研究,2009(1):59-62.
[3]郭利,冯娜,夏咸柱,等.狂犬病病毒Evelyn-Rokitnicki-Abelseth疫苗株反向遗传系统的建立 [J].微生物学报,2008,49(7):949-954
[4]王煜,张七斤.RNA病毒反向遗传学的研究方法和应用[J].畜牧兽医科技信息,2008(4):14-16.
[5]胡孔新,于建石,李德新,等.麻疹病毒全长cDNA构建及其感染性的研究[J].病毒学报,2004,20(3):210-213.
[6]Fuerst T R,Niles E G,Studier F W,et al.Eukaryotic transient expression system based on recombinant vaccinia virus that synthesizes bacteriophage T7 RNA polymerase[J].Proc Natl Acad Sci USA,1986,83(21):8122-8126.
[7]徐向明,朱善元,张泉,等.犬瘟热病毒DNA疫苗接种犬的免疫保护[J].中国兽医学报,2008,28(9):1011-1014.
[8]Collins P L,Whitehead S S,Burkreyev A,et al.Rational design of live-attenuated recombinant vaccine virus for human respiratory syncytial virus by reverse genetics[J].Adv Virus Res,1999,54(39):423-451.
[9]Faber M,Li J,Kean RB,et al.Effective preexposure and postexposure prophylaxis of rabies with a highly attenuated recombinant rabies virus[J].Proc Natl Acad Sci U S A,2009,106(27):11300-11305.
[10]Faber M,Pulmanausahakul R,Hodawadekar S S,et al.Overexpression of the rabies virus glycoprotein results in enhancement of apoptosis and antiviral immune response[J].J Virol,2002,76(7):3374-3381.
[11]吴波平,时洪艳,冯力,等.反向遗传操作研究进展[J].东北农业大学学报,2008,39(1):134-138.
[12]王化磊.表达免疫刺激因子的重组狂犬疫苗对狂犬病的暴露前及暴露后预防研究[D].长春:吉林大学,2010.

