血清乙酰肝素酶与2型糖尿病代谢性指标的相关性研究
赵 越,余江毅,安晓飞
乙酰肝素酶 (heparanase,HPSE)是一种能特异性水解硫酸乙酰肝素 (heparan sulfate,HS)的内源性糖苷酶[1],由HS与核心蛋白组成的硫酸乙酰肝素蛋白多糖 (heparanase sulfate proteoglycan,HSPG)广泛存在于细胞表面、细胞外基质和基底膜中。相关研究表明,HPSE高表达可降解HS[2-3],破坏细胞外基质和基底膜的完整性[4],并释放结合在HS上的多种活性分子[5],与糖尿病 (diabetes mellitus,DM)血管病变尤其是糖尿病肾病 (diabetic nephropathy,DN)蛋白尿的产生关系密切[6]。
最近研究发现,糖尿病患者尿液中HPSE活性较健康者明显升高[7],高糖状态和氧化应激可能是诱导内皮细胞中HPSE表达及活性升高的重要因素[8]。但目前关于糖尿病代谢异常与血清HPSE表达水平的关系,相关临床研究尚不多见。本研究用酶联免疫吸附法 (enzyme linked immunosorbent assay,ELISA)测定120例2型糖尿病 (type 2 diabetes mellitus,T2DM)患者的血清HPSE水平,分析其与糖尿病代谢指标(血糖、血压、血脂、腰围等)的关系,初步探索T2DM代谢异常对血清HPSE的可能作用。
1 资料与方法
1.1 病例纳入标准 入选标准:(1)符合《中国2型糖尿病防治指南 (2007年版)》T2DM诊断标准[9];(2)年龄50~75周岁,性别不限;(3)无慢性并发症,或仅有轻度微血管并发症 (尿清蛋白排泄量<200μg/min或<300 mg/d;无明显视网膜病变或只有轻度非增生性糖尿病视网膜病变);(4)血压≤140/90 mm Hg(1 mm Hg=0.133 kPa);(5)体质指数(BMI)≤30 kg/m2。排除标准:(1)空腹血糖 (FBG)≥13.9 mmol/L,或近1个月内出现糖尿病危急重症如酮症酸中毒、糖尿病高渗状态;(2)已有大血管并发症,如冠心病、脑血管意外、下肢血管病变等;(3)具有严重的原发性心、肝、肺、肾、血液系统疾病或影响其生存的严重疾病。
1.2 一般资料 选取2008年3—9月在江苏省中医院内分泌科门诊就诊的T2DM患者120例,其中男58例,女62例;平均年龄 (61.7±6.5)岁;糖尿病病程平均 (6.0±4.5)年。1.3 方法 对纳入的T2DM患者测定其血清HPSE及相关代谢指标水平,分析血清HPSE与各指标间的相关性。参考《中国2型糖尿病防治指南 (2007年版)》中相关代谢性指标的控制目标将各指标分层,比较血清HPSE在分层后不同组别间的差异。
主要观察指标:血清HPSE;腰围、BMI;血糖 [FBG、餐后血糖 (PBG)]、糖化血红蛋白 (HbA1c);收缩压、舒张压;胆固醇 (TC)、三酰甘油 (TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇 (LDL-C)。
血清HPSE检测方法:使用人乙酰肝素酶酶联免疫分析试剂盒 (USCNLIFE;产品编号:E0711h)检测血清HPSE水平,检测方法为ELISA改良双抗体夹心法。
主要检测仪器:HPSE检测采用BIO-RAD Model-1575洗板机、BIO-RAD Model-680酶标仪;生化指标检测采用Olympus-AU2700全自动生化分析仪。
1.4 统计学方法 采用SAS 9.0统计软件进行统计分析。符合正态分布的计量资料以表示,采用t检验。不符合正态分布时可改用其他统计方法或进行数据转换。相关分析采用Pearson单因素相关分析。采用双侧检验,以P≤0.05为差异有统计学意义。
2 结果
2.1 血清HPSE与糖尿病代谢指标的相关性 120例T2DM患者血清 HPSE为 (1.32±1.37)U/L,腰围为 (84.3±8.1)cm,BMI为 (24.0±2.7)kg/m2,FBG为 (7.0±1.9)mmol/L,PBG为 (10.3±3.8)mmol/L,HbA1c为 (6.5±1.3)%,收缩压为 (130.0±13.3)mm Hg,舒张压为 (76.8±9.3)mm Hg,TC为 (4.78±0.84)mmol/L,TG为 (1.49±0.94)mmol/L,HDL-C为 (1.28±0.31)mmol/L,LDLC为 (2.86±0.66)mmol/L。血清HPSE与上述代谢指标均无相关性 (P>0.05,见表1)。
2.2 T2DM患者血清HPSE水平在不同代谢指标分层间的比较FBG≥5.6 mmol/L组患者血清HPSE水平显著高于FBG<5.6 mmol/L组,差异有统计学意义 (p<0.05);其余糖尿病代谢指标分层间血清HPSE水平比较,差异均无统计学意义(P>0.05,见表2)。
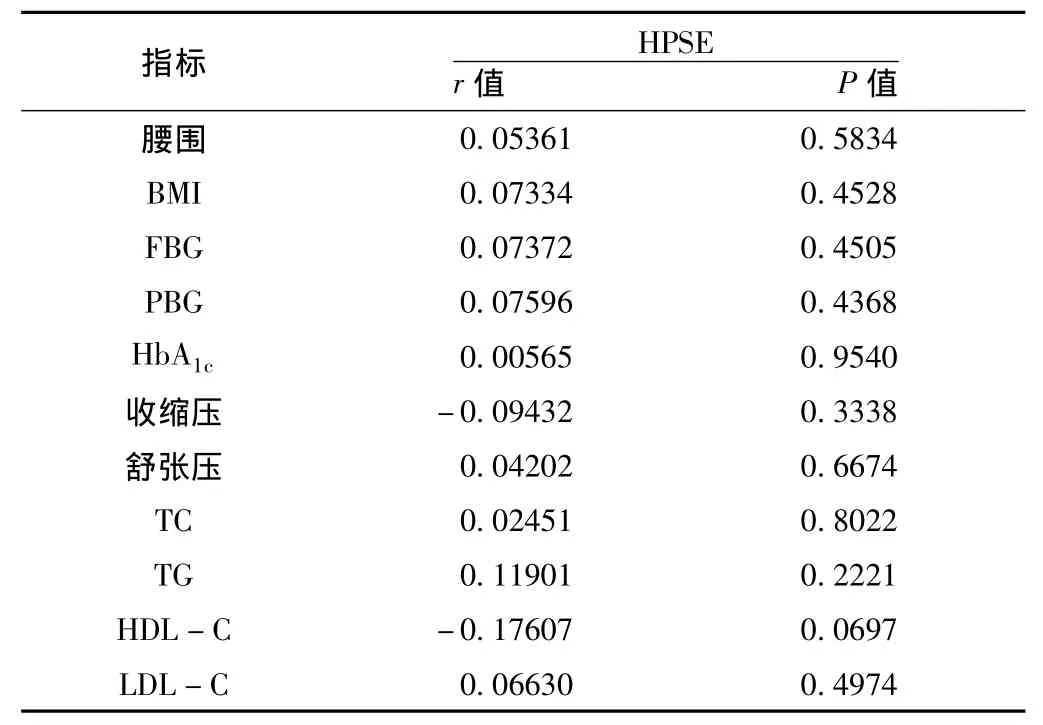
表1 120例T2DM患者血清HPSE与糖尿病代谢指标的相关分析结果Table 1 The correlation analysis between serum HPSE and the metabolic index in 120 type 2 diabetic patients
3 讨论
有研究报道,高糖和氧化应激压力增加可使猪主动脉内皮细胞HPSE表达水平和活性明显升高[8],其机制可能是高糖激活了Sp1、Egr-1、Ets等转录因子导致 HPSE基因转录增加[10]。而糖尿病正是以长期血糖升高为主要表现的一组代谢异常综合征,糖尿病患者高血糖和各种引起氧化应激压力增加的危险因素与HPSE水平之间应具有一定相关性。本研究结果显示,血清HPSE水平与FBG、PBG、HbA1c、腰围、BMI、收缩压、舒张压、血脂均无相关性。而在对各种危险因素进行不同的分层后进一步比较不同组别的HPSE水平时发现,血清HPSE水平在FBG<5.6 mmol/L组显著低于FBG≥5.6 mmol/L组 〔(0.92±1.25)U/L与 (1.52±1.41)U/L,p<0.05〕;其余各危险因素分层后比较,血清HPSE水平均未见明显差异。
FBG水平较高的T2DM患者血清HPSE水平也较高,这为血糖调节HPSE高表达从而参与糖尿病血管病变的假设提供了一定的证据,但仍存在以下几点问题:(1)本研究缺乏与正常人群的对照,因此尚不确定糖代谢异常的T2DM患者较正常人群血清HPSE水平是否升高。(2)血清HPSE在FBG以5.6 mmol/L为切点的分层比较有明显差异,而在FBG以6.1 mmol/L为切点的分层比较未见明显差异。由此提示,血糖升高诱导HPSE表达增加是否存在一个激发域值,当血糖高于某个域值时,即可激活转录因子使HPSE表达增加及活性HPSE向细胞外转移增多,而在低于这个域值时,血糖的变化不会引起HPSE的改变,但目前研究尚未见此方面的发现和报道。(3)相关研究显示,30 mmol/L葡萄糖培养内皮细胞1周后,在细胞裂解液中检测到HPSE表达及活性较空白对照组、高糖加胰岛素组明显升高[8]。30 mmol/L葡萄糖是在实验室条件下使用的特殊手段,与本调查中FBG平均 (7.07±2.01)mmol/L、PBG平均 (10.27±3.87)mmol/L的血糖水平有较大差距,是否只有在如此高水平的葡萄糖浓度下才能诱导HPSE转录增加?其他葡萄糖水平对HPSE转录影响如何?表达增加的HPSE是否会从溶酶体释放到血清中?上述问题尚无明确的答案。因此,目前的研究结果尚不能得出血糖升高可调节T2DM患者血清HPSE表达增加的结论,但血糖可能是T2DM患者血清HPSE升高的重要危险因素。

表2 不同糖尿病代谢指标分层间血清HPSE水平比较 (U/L)Table 2 The comparison of serum HPSE in groups divided by different DM metabolic index levels
综上所述,本研究在现有的关于HPSE研究结论的基础上,分析了T2DM患者血清HPSE与血糖、血压、血脂等代谢指标之间的关系,初步探索了血清HPSE受血糖影响的可能依据,若能在后续的研究中克服一些资料和方法学上的局限,采用更为科学、合理的设计,可能会获得更有意义的结果。
1 Nasser NJ.Heparanase involvement in physiology and disease [J].Cell Mol Life Sci,2008,65(11):1706 -1715.
2 Singh A,Satchell SC,Neal CR,et al.Glomerular endothelial glycocalyx constitutes a barrier to protein permeability[J].JAm Soc Nephrol,2007,18(11):2885 -2893.
3 Morita H,Yoshimura A,Inui K,et al.Heparan sulfate of perlecan is involved in glomerular filtration [J].J Am Soc Nephrol,2005,16(6):1703-1710.
4 Ramón L,Gilabert- Estellés J,CastellóR,et al.mRNA analysis of several components of the plasminogen activator and matrix metalloproteinase systems in endometriosis using a real-time quantitative RT-PCR assay[J].Hum Reprod,2005,20(1):272-278.
5 Ferrara N,Kerbel RS.Angiogenesis as a therapeutic target[J].Nature,2005,438(7070):967 -974.
6 Wijnhoven TJ,van den Hoven MJ,Ding H,et al.Heparanase induces a differential loss of heparan sulphate domains in overt diabetic nephropathy[J].Diabetologia,2008,51(2):372-382.
7 Katz A,Van - Dijk DJ,Aingorn H,et al.Involvement of human heparanase in the pathogenesis of diabetic nephropathy[J].Isr Med Assoc J,2002,4(11):996 -1002.
8 Han J,Woytowich AE,Mandal AK,et al.Heparanase upregulation in high glucose-treated endothelial cells is prevented by insulin and heparin [J].Exp Biol Med(Maywood),2007,232(7):927 -934.
9 中华医学会糖尿病学分会,中国2型糖尿病防治指南制订委员会.中国2型糖尿病防治指南 (2007年版)[M].2007.
10 Maxhimer JB,Somenek M,Rao G,et al.Heparanase-1 gene expression and regulation by high glucose in renal epithelial cells:a potential role in the pathogenesis of proteinuria in diabetic patients [J].Diabetes,2005,54(7):2172-2178.

