用液相色谱-串联质谱法测定人血清中加巴喷丁的含量
刘罡一,贾晶莹,刘海明,陆 川,张梦琪,余 琛*
(1.上海市徐汇区中心医院中心实验室,上海 200031;2.上海医药临床研究中心分析化学部,上海 200233)
1 仪器和试药
1.1 仪器 3200 Qtrap串联质谱仪(美国Applied Biosystems公司);液相色谱仪:包括 SIL-20ACH T自动进样器、LC-20AD输液泵、DGU-20A3在线脱气仪(日本岛津公司);CP225D分析天平(德国Sartorius公司);Mikro冷冻高速离心机(德国Hettich公司);Vortex-2涡旋混合器(美国Scientific Industries公司)。
1.2 药品和试剂 加巴喷丁(纯度≥98%,批号TRC-020031001,加拿大T RC公司),内标磺胺二甲异嘧啶(纯度 99.7%,批号 1024X,美国Sigma公司);甲醇、乙腈、甲酸为色谱纯;实验用水为双蒸水(上海市徐汇区中心医院中心实验室自制)。
2 方法和结果
2.1 色谱条件 XBridge Phenyl(150 mm×
2.1 mm,5 μ m)色谱柱(美国 Waters公司);流动相:0.02%甲酸的乙腈溶液-0.02%甲酸的水溶液(15∶85),流速:0.3 ml/min,柱温:室温,进样量:5 μ l。
2.2 质谱条件 电喷雾离子源,正离子扫描;气帘气:30,碰撞气:7,GS1:50,GS2:50,离子源电压:5000 V,离子源温度:550℃;多离子反应监测(MRM)扫描分析,加巴喷丁和内标磺胺二甲异嘧啶离子对分别为m/z 172→154.1和m/z 279→124。数据采集与处理采用Analyst 1.4.2软件(美国应用生物系统公司)。
2.3 质谱分析 加巴喷丁和内标磺胺二甲异嘧啶在电喷雾离子化方式下,主要生成[M+H]+准分子离子峰,分别为m/z 172和m/z 279。选择性对上述离子峰进行二级质谱分析,加巴喷丁的主要碎片离子为m/z 154.1(脱去一分子H2O),内标的主要碎片离子为m/z 124(脱二甲氨基嘧啶),并将其作为定量分析时监测的产物离子。典型的碎片离子图见图1。
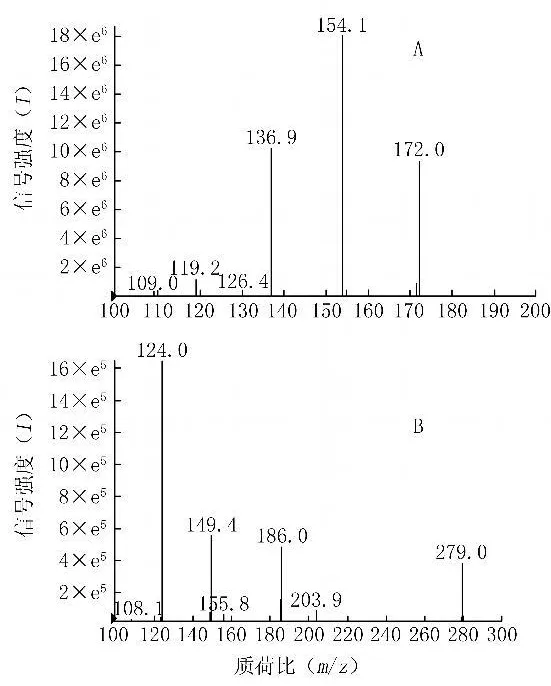
图 1 加巴喷丁(A)及内标磺胺二甲异嘧啶(B)的质谱图Figure 1 The mass spectrum photograms of gabapentin(A)and internal standard sulphadimethyl iso-pyrimidine(B)
2.4 血清样品处理 精密称取加巴喷丁和磺胺二甲异嘧啶适量,分别加甲醇配制成浓度为1.0 mg/ml的加巴喷丁标准储备液和0.9 mg/ml的磺胺二甲异嘧啶标准储备液。取 100 μ l血清,加入浓度为900 ng/ml内标工作溶液 10 μ l,乙腈 200 μ l,涡旋30 s,室温 1.5×104r/min(离心半径 11 cm)离心2 min,吸取上清液作为进样液。
2.5 线性关系考察 在血清中依次加入加巴喷丁标准储备液,配制成相当于加巴喷丁血清浓度为50 、100 、250、1 250、2 500、5000 ng/ml的血清样品,按2.4项下操作,取 5 μ l进样分析。以待测物浓度为x,待测物峰面积和内标峰面积的比值为Y,其加权(1/x)线性回归后,加巴喷丁的回归方程为:Y=0.008463x-0.019 22(r=0.999 6)。结果表明,加巴喷丁在50~5000 ng/ml浓度范围内线性关系良好。加巴喷丁的最低定量限为50 ng/ml(S/N>10∶1)。
2.6 方法专一性 取6个不同来源人的空白血清,每个来源的空白血清分别配制成含加巴喷丁低、中浓度(150、2000 ng/ml)质控血清样品各3份和3份空白血清,共计54份样品,按照2.4项下处理步骤操作并进样分析。结果表明,内源性物质对加巴喷丁和内标的测定无干扰(见图2)。6个不同来源人血清低、中浓度质控测定结果的准确度均在91.8%~105.1%,RSD均<6%,基质对测定结果影响很小,方法专一性强。
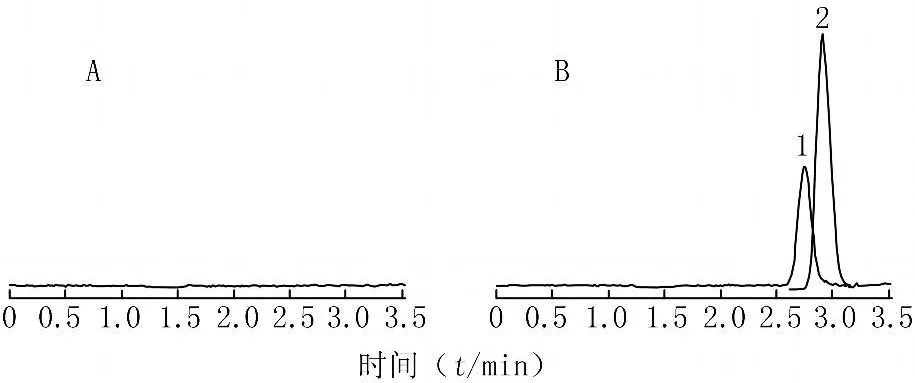
图2 人血清中加巴喷丁及内标磺胺二甲异嘧啶的HPLC谱图Figure 2 HPLC photograms of gabapentin and internal standard sulphadimethyl iso-pyrimidine in human serum
2.7 提取回收率 测定低、中、高浓度(150、2000、4000 ng/ml)的质控血清各6份,得到峰面积B1,另取空白血清按2.4项方法进行处理,加入适量加巴喷丁和内标的工作溶液,配制成与质控血清理论进样浓度相同的溶液进样分析,得到峰面积B2;以B/B2的值计算提取回收率。结果表明,加巴喷丁在低、中、高浓度和内标浓度为900 ng/ml时的提取回收率分别为 108.5%、97.7%、107.7%和109.9%,RSD%分别为 9.8%、3.3%、5.5%和11.5%。
2.8 精密度实验 取低、中、高浓度的质控血清各6份,连续制备3批,按照2.4项下方法操作并进样分析,以当日的标准曲线计算质控血清样品的浓度,计算相对回收率为92.4%~110.4%,批内、批间RSD均<10%(n=6)。
2.9 稳定性考察 取低、中、高3种浓度的质控血清样品,按2.4项下方法处理后,分别在室温下放置0、6、12和18 h时进样测定。样品冻融稳定性是将血清样品置-20℃避光保存,然后在室温下自然解冻,按2.4项下方法处理后进样,如此反复2次。结果表明,预处理好的血清质控样品在室温放置18 h内稳定,血清质控样品经过2次冻融后仍稳定,RSD均<10%(n=3)。
3 讨 论
国外有文献报道用LC-MS/MS法[4]测定人血清中加巴喷丁含量,采用液液萃取法进行样品预处理,需要用氮气吹干,过程繁琐、耗时。本研究在该方法的基础上进行优化,采用乙腈直接沉淀蛋白质进行样本处理,操作过程更加简便。在摸索条件时发现,在流动相中加入0.02%甲酸,能够提高离子化效率,改善峰形,同时灵敏度也有所提高。
本研究建立的LC-MS/MS测定人血清中加巴喷丁含量的方法是本实验室抗精神类药物和抗抑郁类药物治疗药物监测平台的一部分,该平台包括有32种药物的监测,根据临床常用以及市场上能购买到的标准品或对照品选择药物。在平台开发后,作者也开展了一些治疗药物监测以及生物利用度研究,但由于本院使用加巴喷丁的病人很少,所以没有临床样本监测。今后计划与上海地区各家精神卫生中心联系,希望能获得一些临床样本开展治疗药物监测,检验本方法的实用性。
[1] 龚志毅,叶铁虎,郝绒绒,等.加巴喷丁治疗带状疱疹后神经痛的有效性和安全性研究[J].中国疼痛医学杂志,2008,14(2):72-77.Gong ZhiYi,Ye TieHu,Hao Rong Rong,et al.The efficacy and safety of gabapentin in postherpetic neuralgia[J].Chin J Pain Med,2008,14(2):72-77.Chinese with abstract in Enlish.
[2] Bahrami G,Mohammadi B.Sensitive microanalysis of gabapentin by high-performance liquid chromatography in human serum using pre-column derivatization with4-chlo ro-7-nitrobenzofurazan:application to a bioequivalence study[J].J Chromatogr B Analy t Technol Biomed Life Sci,2006,837(1-2):24-28.
[3] Gambelunghe C,Mariucci G,Tantucci M,et al.Gas chromatog raphy-tandem mass spectrometry analysis of gabapentin in serum[J].Biomed Chromatog r,2005,19(1):63-67.
[4] Carlsson K C,Reubsaet J L E.Sample preparation and determination of gabapentin in venous and capillary blood using liquid chromatog raphy-tandem mass spectrometry[J].J Pharm Biomed Anal,2004,34(2):415-423.

