尿素与多效唑配施对苯磺隆胁迫下土壤酶活性的影响
吴济南,王丽玲,王惟帅,杜慧玲
(山西农业大学文理学院,030801,山西太谷)
土壤酶是催化有机物分解的一类具有蛋白质性质的生物催化剂,土壤酶主要来源于土壤微生物和植物根系的分泌物及动植物残体分解释放的酶[1],参与土壤中各种有机质的分解、合成与转化,以及无机物质的氧化与还原等过程,是土壤生态系统代谢的一类重要动力,在很大程度上反映土壤物质循环与转化的强度,常被用来作为土壤生态系统变化的预警和敏感指标[2]。而土壤酶活性易直接或间接受自然或者人为因素的影响[3]。农药是土壤生态系统中最常见的一种异源物质,很容易影响土壤酶活性[4],因此,土壤酶活性作为一项生态毒理学指标,可用来判断外来物质对土壤的污染程度以及可能对生态环境造成的影响。
苯磺隆(Tribenuron-methyl)由芳环、磺酰脲桥和三嗪环组成,为内吸传导型选择性磺酰脲类除草剂,于20世纪80年代由美国杜邦公司开发,具有高效、广谱、用量少、使用方便、低残留等优点,是目前麦田广泛使用的除草剂之一。多效唑为低毒植物生长延缓剂,能够抑制茎杆伸长,缩短节间,增加作物抗倒伏能力和抗逆性。在小麦生产上,为有效防止小麦后期倒伏,为小麦的高产奠定基础,常使用多效唑和追施尿素方法。杜慧玲等[5]通过盆栽试验研究了苯磺隆对土壤酶活性的影响,结果表明,土壤脲酶活性对表征苯磺隆污染具有一定的指示作用。王正贵等[6]研究了除草剂苯磺隆对麦田土壤酶活性的影响。而苯磺隆与多效唑、尿素配施对土壤酶活性的影响尚未见报道。笔者采用盆栽试验,研究除草剂苯磺隆与多效唑、尿素配施对土壤脲酶、碱性磷酸酶和蛋白酶的影响,旨在为环境质量评价指标体系的建立以及经济合理地使用苯磺隆,减少环境污染提供科学的理论依据。
1 研究区概况
山西农业大学试验地位于晋中盆地的太谷县,E 112.57°,N 37.43°,属暖温带大陆性气候,年平均气温9.8℃,无霜期175 d,降雨量462.9 mm,地下水资源可开采量9 600 m3。农业基础条件好。试验地为石灰性褐土,质地为中壤,未使用过除草剂。
2 材料与方法
2.1 供试材料
供试土壤采自山西农业大学试验地。土壤理化性状为:有机质质量分数16.85 g/kg,全氮质量分数0.96 g/kg,碱解氮质量分数12.87 mg/kg,有效磷质量分数15.58 mg/kg,速效钾129.41 mg/kg,pH值8.3。采集0~20 cm土壤,晾干后过3 mm筛,充分混匀,选择30 cm×26 cm的塑料盆,每盆装土15 kg。
供试冬小麦(Triticum aestivum)品种为农大190,由山西农业大学试验农场提供;10%苯磺隆可湿性粉剂,沈阳化工院生产;15%多效唑可湿性粉剂由江苏盐城市磺隆实业有限公司生产;尿素(N≥46%)由山西焦化集团有限公司生产。
2.2 测定方法
脲酶活性采用苯酚钠比色法测定;蛋白酶活性采用茚三酮显色比色法测定;磷酸酶采用磷酸苯二钠比色法测定[1]。
2.3 试验设计与实施
试验采用3因素完全随机设计,其中苯磺隆有3个水平(B、B1和B2,分别为0、5.0和100.0 mg/kg),多效唑有2个水平(X和X1,分别为0和750 g/hm2),尿素有2个水平(N和N1,分别为0和300 kg/hm2),共12个处理组合:1)对照(B=0,X=0,N=0)(CK);2)低浓度苯磺隆(B1);3)高浓度苯磺隆(B2);4)多效唑(X1);5)低浓度苯磺隆+多效唑(B1X1);6)高浓度苯磺隆+多效唑(B2X1);7)尿素(N1);8)低浓度苯磺隆+尿素(B1N1);9)高浓度苯磺隆+尿素(B2N1);10)多效唑+尿素(X1N1);11)低浓度苯磺隆+多效唑+尿素(B1X1N1);12)高浓度苯磺隆+多效唑+尿素(B2X1N1)。每个处理3次重复。
于小麦返青后拔节前按试验设计浓度喷施,处理后1、3、7、14、28、60 d 进行采样,测定土壤脲酶、碱性磷酸酶、蛋白酶活性。
2.4 数据处理
试验数据采用SAS 8.1软件进行方差分析,用Duncan新复极差法进行平均数的显著性检验。
3 结果与分析
3.1 尿素、多效唑配施对苯磺隆胁迫下土壤脲酶的影响
由土壤脲酶方差分析结果表1可以看出,用药后1~60 d,苯磺隆、多效唑(除第3 d)、尿素的主效应对土壤脲酶活性的影响达极显著差异水平,苯磺隆与尿素二因素以及苯磺隆、多效唑与尿素3因素互作除第1 d外均达极显著差异水平。
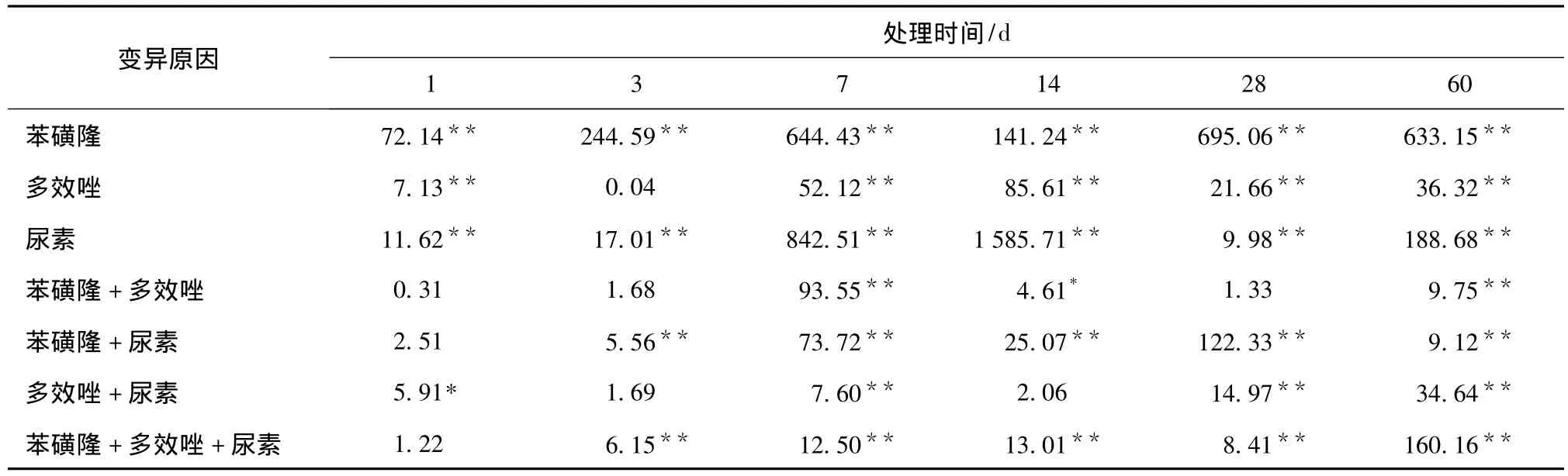
表1 土壤脲酶方差分析结果Tab.1 F-value variance analysis results on soil urease
尿素、多效唑配施对苯磺隆胁迫下土壤脲酶活性的影响,各处理之间的多重比较结果见表2。可以看出:与对照相比,B1、B2处理,在最初14 d呈抑制效应,且抑制作用随着苯磺隆浓度的增大而增大,1~7 d抑制率随着时间的延长而增大,第7 d达到最大,分别为59.4%和74.8%;28~60 d呈激活效应,第60 d,B1处理基本恢复到对照水平,B2处理极显著地高于对照,激活率高达183.0%;B1X1处理在1~7 d表现为抑制效应,抑制效应小于B1处理,14~60 d呈激活效应,比B1处理激活效应提前;B2X1处理与B2处理相比,在第3 d和第7 d抑制率显著提高,第3 d由60.0%提高为78.8%,第7 d由74.8%提高为88.0%,第60 d激活率为109.2%,小于B2处理;B1N1处理,除第1 d呈轻微的抑制效应外,第3~60 d均呈激活效应,差异水平达极显著;B2N1处理在1~7 d呈较弱的抑制效应,之后呈极显著的激活效应;B1N1X1与B1相比,B2N1X1与B2相比,同一时间酶活性均显著增加。在整个处理过程,与对照相比,B1和B2脲酶活性平均增加了-11.0%和 -7.27%,而B1N1X1和B2N1X1处理,脲酶活性平均增加29.8%和38.4%。说明配施尿素和多效唑,可以缓解甚至消除苯磺隆对脲酶活性的抑制作用。
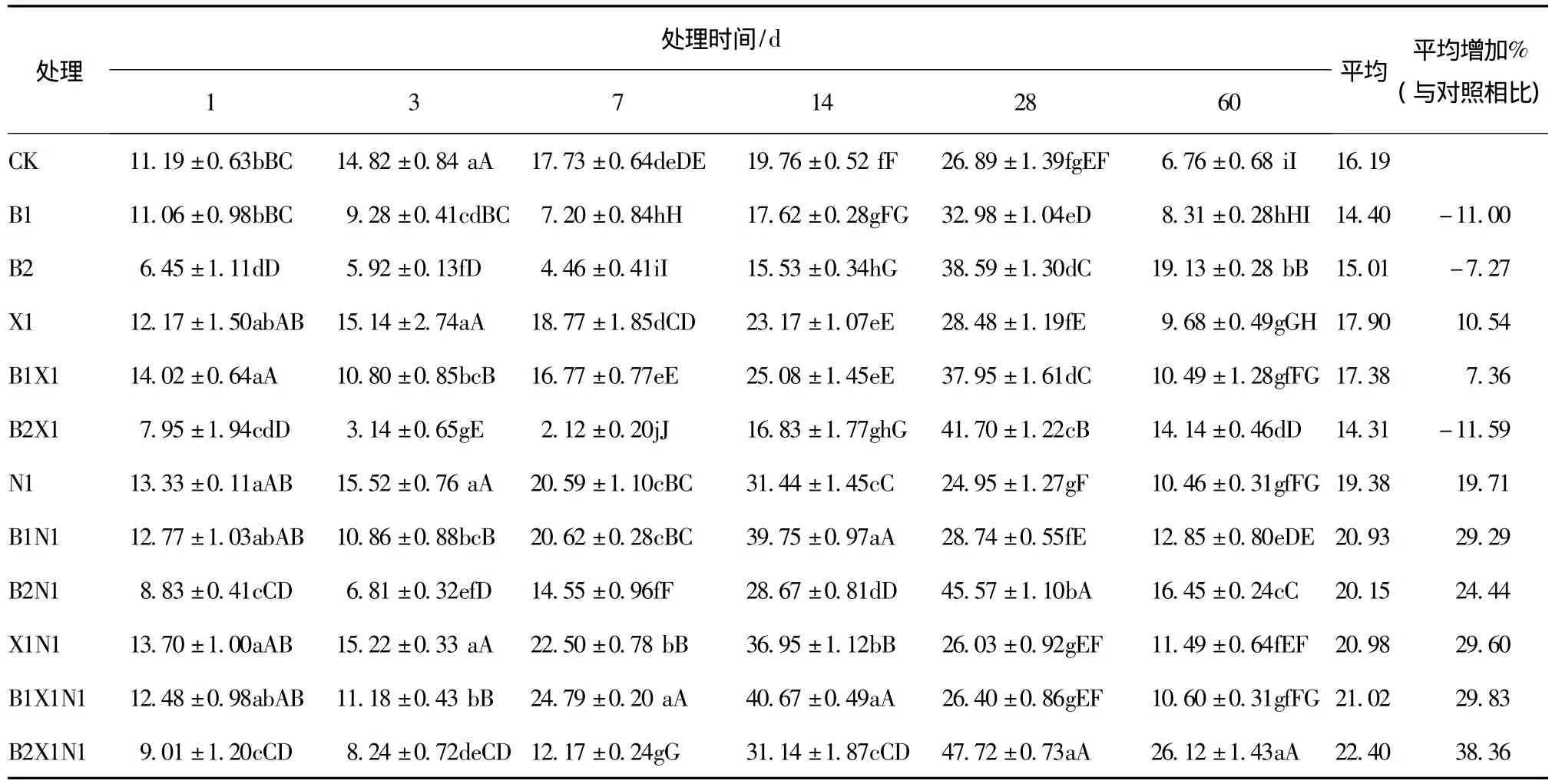
表2 不同处理间土壤脲酶多重比较结果Tab.2 Multiple comparisons results of soil urease between different treatments mg/(g·h)
3.2 尿素、多效唑配施对苯磺隆胁迫下土壤碱性磷酸酶的影响
土壤磷酸酶有酸性、中性和碱性3类,测定的最适pH值分别为5.0、7.0和9.8。由于供试土壤为石灰性碱性土壤,故只进行了碱性磷酸酶的研究。
土壤碱性磷酸酶方差分析结果表3表明,1~60 d,苯磺隆对土壤碱性磷酸酶活性的主效应以及苯磺隆与尿素2因素互作均达显著或极显著差异水平,苯磺隆与多效唑互作除第1 d和第28 d,多效唑与尿素互作除第60 d不显著外,其余时间均达显著或极显著水平,苯磺隆、多效唑与尿素3因素互作在处理的最初7 d达极显著。
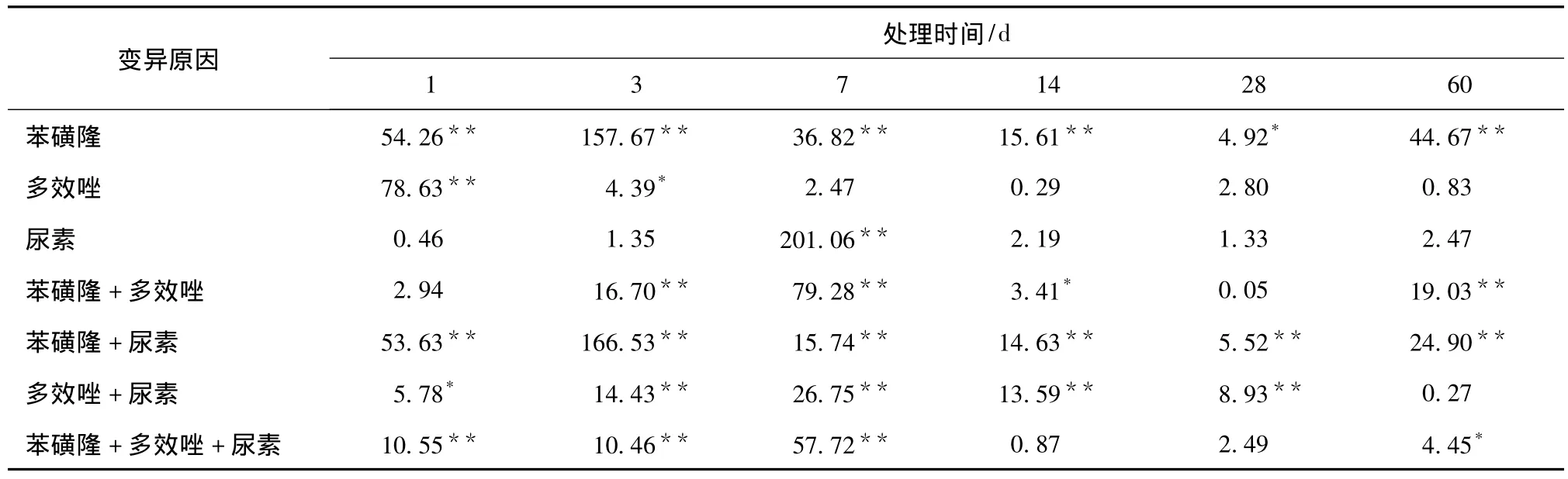
表3 土壤碱性磷酸酶方差分析结果Tab.3 F-value variance analysis results on soil alkaline phosphatase
尿素、多效唑配施对苯磺隆胁迫下土壤碱性磷酸酶的影响,各处理之间的多重比较结果见表4。可知:低浓度苯磺隆对碱性磷酸酶活性表现为激活—抑制—激活作用,高浓度苯磺隆表现为抑制—激活作用,第60 d极显著地高于对照,是对照的2.49倍;尿素、多效唑配施后表现为抑制—激活作用,各处理在第1~28 d碱性磷酸酶活性随着时间的延长而增大,其中14~28 d磷酸酶活性变化不大,之后急剧降低,处理结束时极显著地高于对照;在整个处理过程中,与对照相比,B1、B1X1、B1N1、B1N1X1各处理碱性磷酸酶活性平均增加分别为3.22%、1.39%、-2.42%、-4.88%,B2、B2X1、B2N1、B2N1X1各处理碱性磷酸酶活性平均增加为-9.79%、-2.39%、3.95%、-4.56%。说明低浓度苯磺隆对碱性磷酸酶具有激活效应,配施尿素和多效唑,低浓度苯磺隆与尿素和多效唑表现为拮抗作用,减弱了其激活效应;高浓度苯磺隆对碱性磷酸酶具有抑制作用,尿素、多效唑可以缓解甚至消除高浓度苯磺隆对碱性磷酸酶活性的抑制作用,高浓度苯磺隆与多效唑表现为拮抗作用,与尿素表现为加和作用。
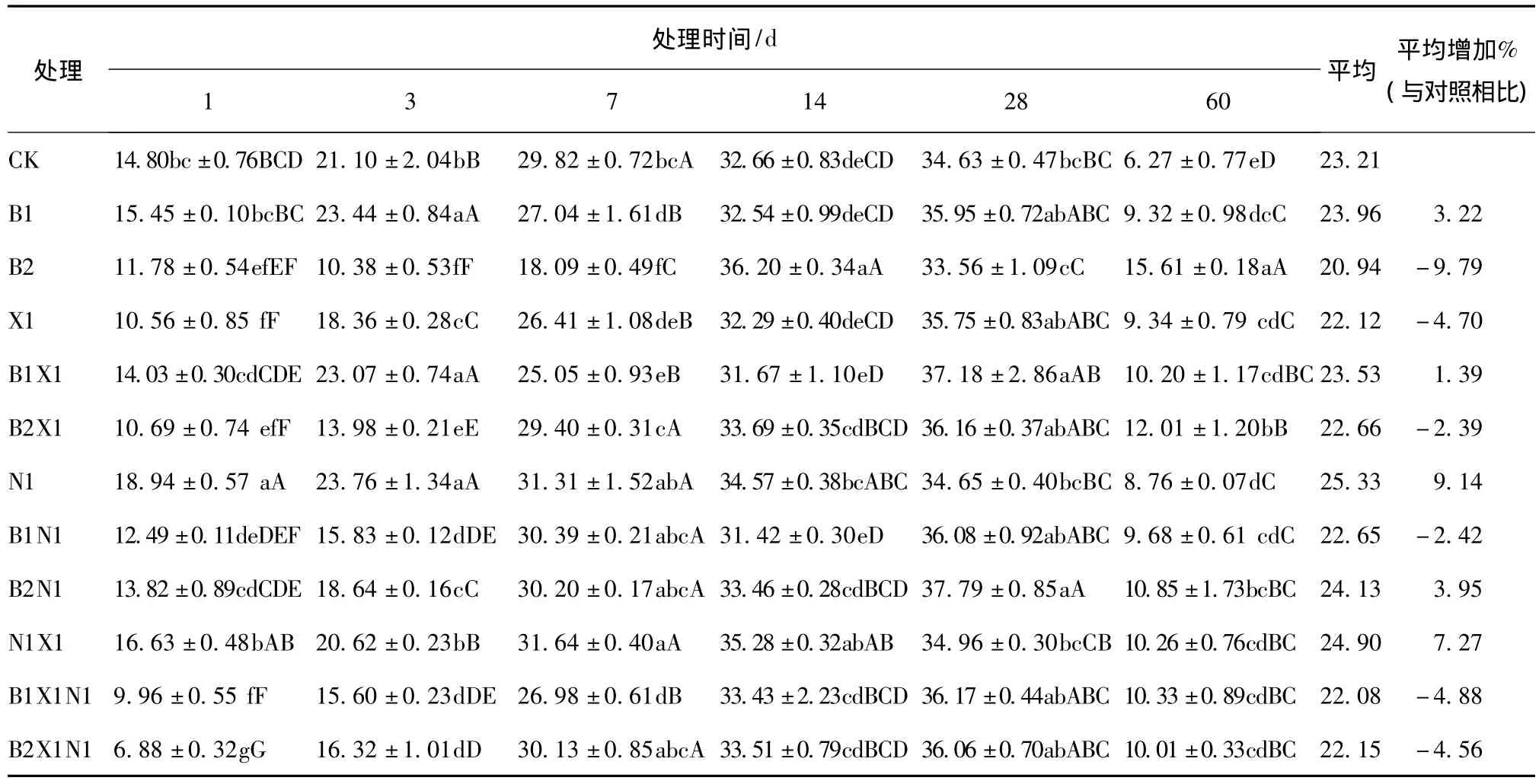
表4 不同处理间土壤碱性磷酸酶多重比较结果Tab.4 Multiple comparisons results of soil alkaline phosphatase between different treatments μg/(g·h)
3.3 尿素、多效唑配施对苯磺隆胁迫下土壤蛋白酶的影响
土壤蛋白酶方差分析结果见表5。可以看出,苯磺隆、尿素、多效唑主效应以及交互效应对土壤蛋白酶的影响在不同处理时间大多不显著,特别是第1 ~7 d。
尿素、多效唑配施对苯磺隆胁迫下土壤蛋白酶的影响,各处理之间的多重比较结果见表6。可知:除B1和B1N1处理外,其余苯磺隆以及苯磺隆配施尿素、多效唑各处理对土壤蛋白酶活性的影响表现为先抑制后激活,B1处理表现为激活—抑制作用,直到处理结束还没有恢复到对照水平;B1N1处理第1天表现为极显著的激活作用,之后为抑制作用;B2X1处理在第28天酶活性最强,与对照相比激活率为65.94%。在整个处理过程中,与对照相比,各处理酶活性平均降低顺序为B1N1(6.92%)<B1X1(7.07%)<B1(8.37%)<B1N1X1(20.26%)。说明低浓度苯磺隆同时与尿素和多效唑施用对土壤蛋白酶抑制作用增强,第7天抑制作用最强,抑制率为59.74%,低浓度苯磺隆与尿素和多效唑表现为拮抗作用。高浓度苯磺隆各处理酶活性与对照相比平均降低顺序为B2X1(0.00%)<B2N1X1(2.54%)<B2N1(9.61%)<B2(25.1%)。说明高浓度苯磺隆配施尿素、多效唑显著降低了对土壤蛋白酶的抑制作用,高浓度苯磺隆与尿素表现为协同作用,与多效唑表现为拮抗作用。
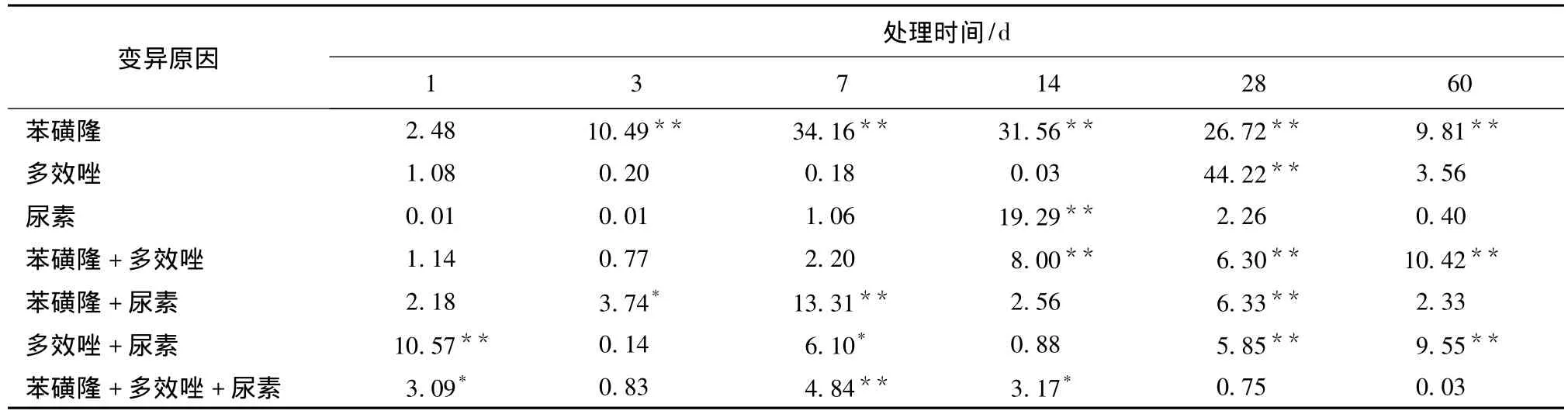
表5 土壤蛋白酶方差分析结果Tab.5 F-value variance analysis results on soil protease
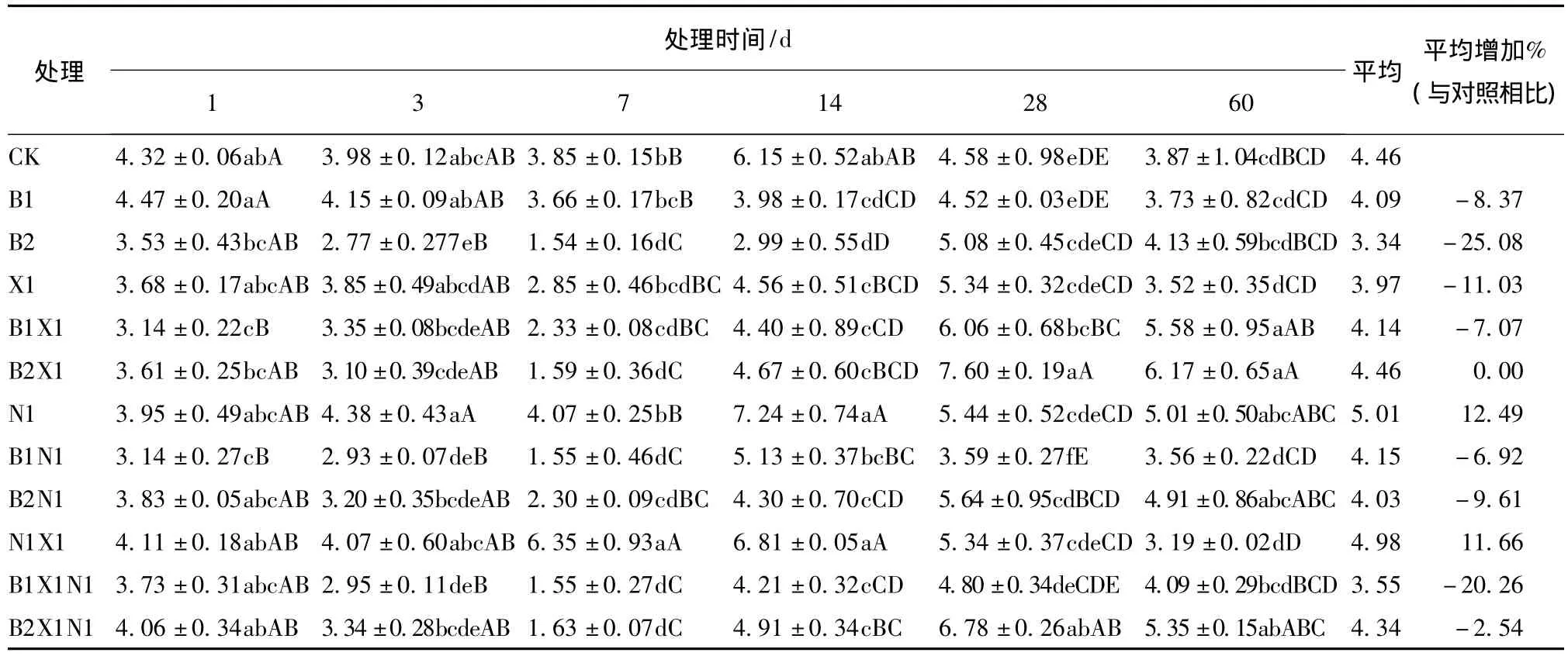
表6 不同处理间土壤蛋白酶多重比较结果Tab.6 Multiple comparisons results of soil protease between different treatments μg/(g·h)
4 结论与讨论
1)在整个处理过程中,苯磺隆与尿素和多效唑配施对脲酶活性表现为先抑制后激活,且随着浓度增加抑制和激活增强。与对照相比,对于脲酶活性主要表现为激活效应,具体顺序为:B2N1X1>B1N1X1>B1N1>B2N1>B1X1>B2X1>B1>B2。
2)碱性磷酸酶活性表现为高浓度苯磺隆具有抑制作用,低浓度苯磺隆具有轻微的激活效应。低浓度苯磺隆与尿素、多效唑混用酶活性降低,酶活性平均增加顺序为:尿素(9.14%)>尿素+多效唑(7.27%)>低浓度苯磺隆(3.22%)>低浓度苯磺隆+多效唑(1.39%)>低浓度苯磺隆+尿素(-2.42%)>多效唑(-4.70%)>低浓度苯磺隆+尿素+多效唑(-4.88%)。高浓度苯磺隆与尿素、多效唑混用减弱了对酶活性的抑制作用,顺序为:尿素(9.14%)>尿素+多效唑(7.27%)>高浓度苯磺隆+尿素(3.95%)>高浓度苯磺隆+多效唑(-2.39%)>高浓度苯磺隆+尿素+多效唑(-4.56%)>多效唑 (-4.70%)>高浓度苯磺隆(-9.79%)。
3)苯磺隆对土壤蛋白酶活性表现为抑制作用,且随着浓度的增大抑制作用增强,B1、B2处理平均抑制率分别为8.37%和25.08%。添加多效唑、尿素(除B1X1N1处理外)可减弱苯磺隆对土壤蛋白酶的抑制作用。
农药对土壤酶活性的影响与施用的土壤类型、土壤环境、气候条件、农药结构、农药用量及施用时间、研究方法以及取样时间等诸多因素有关[7]。土壤脲酶能促进土壤尿素分子中酰胺碳氮键的水解,生成的氨是植物氮素营养来源之一,在氮肥利用和土壤氮素代谢方面有重要的意义[8]。农药对土壤脲酶的影响已有许多报道[9-11]。本研究表明,苯磺隆对脲酶活性为先抑制后激活,随着苯磺隆浓度的增加抑制和激活作用均增强。说明抑制作用是一种暂时现象,微生物能很快适应外来有机物的干扰,并利用苯磺隆作为碳源,使酶活性增强。配施尿素、多效唑能够缓解对脲酶的抑制作用。这是因为苯磺隆及其降解产物与尿素、多效唑分子间形成范德华力和氢键,降低了苯磺隆对土壤脲酶的毒性,且随着处理时间的延长,为微生物提供了较多碳源和能源,从而激活了脲酶活性。
土壤磷酸酶是能促进有机磷酯或无机磷酸盐转化为植物可利用的无机磷酸,可为植物生长提供有效磷素。李兆君等[12]的研究结果表明,甲磺隆结合残留对土壤酸性磷酸酶和过氧化氢酶具有明显的抑制作用。马爱军等[13]报道,毒死蜱与乙草胺单一污染和复合污染对酸性磷酸单酯酶以及碱性磷酸单酯酶的影响表现为先激活后抑制的效应。本研究表明,低浓度苯磺隆对碱性磷酸酶的影响表现为先激活后抑制再激活的效应。这是由于微生物能够利用苯磺隆作为碳源和能源刺激自身的生长,从而使碱性磷酸酶活性被激活;但随着苯磺隆的降解,可利用的碳源和能源减少,碱性磷酸酶活性暂时降低,随着小麦的生长,根际环境的变化又有利于酶活性的恢复或增强。配施多效唑、尿素,碱性磷酸酶活性降低,说明低浓度苯磺隆与多效唑表现为协同作用,与尿素以及尿素+多效唑表现为拮抗作用。高浓度苯磺隆配施多效唑、尿素对碱性磷酸酶仍然呈抑制作用,这是由于苯磺隆等有机污染物改变了土壤酶的构象等。
土壤蛋白酶是氮素转化的重要酶类,能水解各种蛋白质和肽类等化合物为氨基酸,因此,土壤蛋白酶的活性与土壤氮素营养的转化状况存在极重要的关系[14]。滕春红等[10]研究氯嘧磺隆对蛋白酶的影响结果表明,低浓度氯嘧磺隆对蛋白酶有轻微的激活作用,而高浓度氯嘧磺隆对蛋白酶有抑制作用。本研究表明,低浓度苯磺隆最初3d刺激了酶活性,之后对酶活性呈抑制作用;高浓度苯磺隆在处理后的第14天表现为抑制作用,第28~60天表现为激活作用。这是因为低浓度苯磺隆刺激了微生物活性,而高浓度苯磺隆对微生物有不良影响。处理初期,由于苯磺隆分子中的磺酰脲桥被蛋白酶水解,使酶分子的活性部位减少,从而抑制了底物与酶分子结合,进而降低了酶活性,之后,有机物分解增加了碳源和氮源,从而提高了微生物的活性。从酶活性平均增加现象可见,配施多效唑、尿素减弱了苯磺隆对土壤蛋白酶的抑制作用,但B1N1X1处理对酶活性的抑制作用增强,其作用机制有待进一步研究。
[1]关松荫.土壤酶及其研究法[M].北京:农业出版社,1986:14,260-274
[2]周礼恺.土壤酶学[M].北京:科学出版社,1987:118-159
[3]Gianfreda L,Bollag J M.Influence of natural and anthropogenic factors on enzyme activity in soil.In:Stotzky G,Bollag J M.Soil Biochemistry[M].New York:Marcel Dekker,1996:123-193
[4]Min H,Ye Y F,Chen Z Y.Effects of butachlor on microbial populations and enzyme activities in paddy soil[J].J Environ Sci Health,Part B,2001,36(15):581-595
[5]杜慧玲,吴济南,王丽玲,等.苯磺隆对土壤酶活性的影响[J].核农学报,2010,24(3):585-588
[6]王正贵,封超年,郭文善,等.除草剂苯磺隆对麦田土壤酶活性的影响[J].麦类作物学报,2010,30(2):391-394
[7]林晓燕,王玮,赵宇华,等.苄嘧磺隆对淹水稻田土壤呼吸和酶活性的影响[J].浙江大学学报:农业与生命科学版,2008,34(1):109-113
[8]李永红,高玉葆.土壤中单嘧磺隆对谷子生长及土壤微生物若干生化功能的影响[J].农业环境科学学报,2004,23(4):633-637
[9]陈国峰,杨红.除草剂使它隆对土壤酶活性及呼吸强度的影响[J].生态环境,2008,17(3):1016-1020
[10]滕春红,陶波.除草剂氯嘧磺隆对土壤酶活性的影响[J].农业环境科学学报,2006,25(5):1294-1298
[11]Perucci P,Dumontet S,Bufo S A,et al.Effect of organic amendment and herbicide treatment on soil microbial biomass[J].Biology and Fertility of Soils,2000,32:17-23
[12]李兆君,徐建明,梁永超,等.甲磺隆结合残留对土壤酶活性的影响[J].生态毒理学报,2008,3(5):499-506
[13]马爱军,何任红,蒋新宇,等.毒死蜱与乙草胺单一污染和复合污染对土壤酶活性及微生物生物量碳的影响[J].生态与农村环境学报,2008,24(2):57-60
[14]郑洪元,张德生,郑莲嫡.土壤中具有蛋白酶活性的酶-腐殖质复合物的提取及其性质的研究[J].土壤学报,1985,22(4):357-364

