绝经女性6个月健身秧歌锻炼前后血清雌激素、细胞因子和骨密度的变化
肖兰 周勇 李靖
1 西安石油大学体育系(西安 710065) 2 陕西师范大学体育学院 3 第四军医大学西京医院全军骨科研究所
女性进入绝经期后卵巢功能减退,雌激素水平大幅下降,容易产生内分泌失调、心血管疾病、骨质疏松、乳腺和子宫内膜癌等疾病。中等强度运动可改善绝经女性卵巢分泌雌激素的功能,提高雌二醇和孕酮的水平[1-3];雌激素对骨代谢有重要调节作用[4],故适宜运动对骨密度有积极影响。有研究发现[5,6],雌激素调节骨髓细胞产生细胞因子,进而调控骨改建。健身秧歌是中老年女性较普及的运动,但其对绝经女性细胞因子、骨密度及雌激素水平影响的研究尚未见报道。本研究观察了6个月健身秧歌锻炼前后绝经女性血清雌激素、细胞因子及骨密度的变化,旨在探讨该运动对绝经女性相关生理机能的影响。
1 对象和方法
1.1 研究对象
来自西安第四军医大学、西安交通大学医学院和西安石油大学,自愿参加健身秧歌锻炼的绝经女性38名,经肺活量、心率、血压及常规血液指标检测,选取其中身体健康且能坚持6个月秧歌锻炼者30名(年龄56±5.6岁,绝经时间7.8±3.1年)作为研究对象。
1.2 研究方法
锻炼方案和运动强度控制:自2009年5月~2009年12月,经2周学习第一套健身秧歌基本动作后,开始正式健身秧歌锻炼。锻炼时间为每天下午5:30~6:20,每周5次,每次50 分钟左右。锻炼过程分5个阶段,即准备活动(全身各关节的柔韧性练习)、健身秧歌锻炼(一个整套)、间歇休息、健身秧歌锻炼(两个整套)和整理活动(放松练习),各阶段时间分别为10分钟、6分 48秒(配套音乐时间为6分48秒)、5分钟、13分36秒和10分钟。运动强度以心率为评价指标,控制在130次/分以内。在运动中以音乐节奏、运动步法、心率和主观感觉疲劳等综合调控锻炼强度。
为检验运动强度及监控锻炼,在研究对象中随机抽取6名,采用芬兰产Polar遥测心率仪,测量6名受试者锻炼前和锻炼过程中10分钟、13分24秒、16分48秒、21分48秒、28分36秒、35分24秒 和45分24秒(放松练习后)等8个时间点的心率。
1.3 测量指标及方法
分别于锻炼前和锻炼6个月后进行两次测试,尽量保证前后两次实验条件相当。于锻炼前和锻炼6个月后分别在晨起空腹状态下抽取前臂肘静脉血10 ml,经3000 r/min离心10 min分离血清,EP管分装,置于–20℃冰箱保存、集中待检。
雌激素指标包括雌二醇(E2)、孕酮(P)、卵泡刺激素(FSH)和黄体生成素(LH),采用西安产XH-6010型激素测试仪,应用放射免疫法测试,试剂盒由天津生物工程有限公司提供。
血清细胞因子包括白细胞介素-1(IL-1)、白细胞介素-4(IL-4)、白细胞介素-6(IL-6)、肿瘤坏死因子(TNF-),采用放免法测试,试剂盒购自北京福瑞生物工程公司。
采用美国LUNAR公司生产的DPX-L型双能X线骨密度(BMD)测定仪测定腰椎L2-4、股骨颈、桡骨远端1/3处和尺骨远端1/3处骨密度。
1.4 统计学分析
采用SPSS 13.0软件统计分析所有数据。计量资料以(± s)表示,各指标6个月锻炼前后比较采用t检验,P < 0.05表示具有显著性差异。
2 结果
2.1 锻炼中的心率
在每次锻炼过程中,安静状态、准备部分、第一次整套健身秧歌(两个即刻心率值)、间歇休息、第二次整套健身秧歌(两个即刻心率值)和整理部分相应的心率分别为 76±3(次 /min)、85±2(次 /min)、124±3( 次 /min)、124±1( 次 /min)、84±2( 次 /min)、124±3(次 /min)、124±1(次 /min)和 78±2(次 /min)。整个运动过程中的心率在85~124次/min。
2.2 血清雌激素、细胞因子和骨密度
表1显示,6个月秧歌健身锻炼后,绝经妇女血清雌激素E2、P水平较锻炼前显著升高(P <0.01),FSH、LH水平显著下降(P < 0.05);细胞因子IL-1和TNF-较锻炼前显著下降(P < 0.01),IL-6显著下降(P < 0.05);相关部位骨密度较锻炼前均有不同程度增加,其中,腰椎L2-4和股骨颈骨密度较锻炼前显著增加(P < 0.05)。
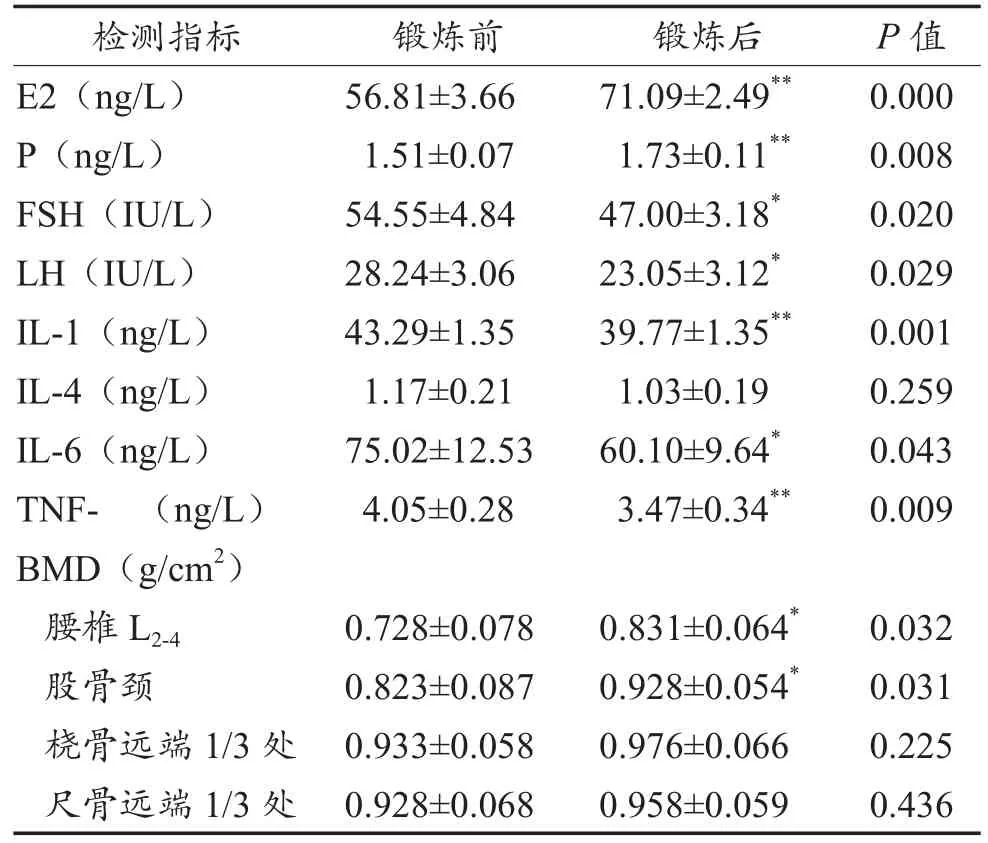
表1 6个月秧歌健身锻炼前后受试者雌激素、细胞因子和骨密度的变化(n=30)
3 讨论
为了充分了解和控制运动强度,我们测试了整个锻炼过程中的运动即时心率,结果表明其范围在85~124次/min。参照文献关于合适的运动强度一般为最高心率(220-年龄)的52%~78%(最高心率的60%)的建议[2,3],本实验中的健身秧歌锻炼为中等强度,符合体育锻炼生理要求中的运动强度原则。
女性绝经后,卵巢功能减退,雌激素水平显著下降,下丘脑-垂体-卵巢轴之间的平衡失调,雌激素对脑垂体的反馈抑制减弱,导致脑垂体促性腺激素分泌增加,从而影响下丘脑与脑垂体的调节机制及其分泌腺与垂体间的平衡关系,最终影响植物性神经中轴及其支配下的各脏器功能[7]。本实验结果显示,6个月健身秧歌锻炼后,受试者雌二醇和孕酮水平均显著升高,卵泡刺激素和黄体生成素水平较锻炼前均显著下降。健身秧歌运动以腰为轴,肩、臂配合,通过“扭、摆、走”秧歌步伐,以腰部扭动带动双臂的摆动,并与步法协调配合,运动节奏有缓有急,情绪热烈,动作活泼奔放,可刺激锻炼者感觉性脑神经和运动性脑神经,促进神经内分泌系统的紧张性。故健身秧歌锻炼可改善绝经女性中轴神经系统功能,影响下丘脑分泌并促进下丘脑-垂体-卵巢轴适应。
有研究报道,女性绝经后卵巢功能减退,雌激素分泌下降,导致IL-4、IL-6、TNF-等分泌增加[8]。运动可增加副交感神经张力和乙酰胆碱分泌,抑制IL-1、TNF-产生和释放[9-11]。同时,运动提高细胞质Ca2+浓度,激活IL-6基因转录[12]。本实验结果表明,适宜强度的健身秧歌锻炼抑制绝经后女性血清细胞因子水平升高,可能与健身秧歌运动刺激和兴奋锻炼者的中轴神经系统有关。秧歌锻炼时,通过中轴神经系统与肢体的协调以及神经信号的重复反馈,增强了副交感神经张力和乙酰胆碱分泌,调节细胞因子水平。
运动使骨量增加,减少骨丢失,机械应力可促进骨细胞的增殖,加强其活性和骨矿化过程[13]。应力可引起骨组织产生特异性形变,刺激骨细胞,使骨组织内DNA和胶原蛋白合成增加[14]。机械负荷促进骨细胞将基质所承受的机械压力转换为化学信号,再传给成骨和破骨细胞,以调节骨的建造和改建过程[15,16]。本实验结果显示,6个月健身秧歌锻炼后,相关部位骨密度较锻炼前均有不同程度提高,其中腰椎L2-4和股骨颈骨密度显著提高。受试者通过运动充分锻炼了身体各关节和相应的肌肉,特别是腰椎。运动时,腰椎和髋部的运动负荷主要受到自身重力、地面反作用力以及维持运动姿势平衡的肌肉的牵拉力和压力等;下肢股骨则承受走、摆、跳中地面的反作用力及相应肌肉的牵拉力。长期运动负荷和肌肉牵拉力有效提高了成骨细胞活性,利于骨形成和骨重建,从而提高该部位的骨密度。同时,运动增强心血管和内分泌调节机能,促进血液循环和血钙运输,增强体内钙的代谢平衡和成骨细胞的合成。
4 小结
6个月中等强度健身秧歌锻炼可改变绝经女性雌激素分泌,E2、P水平升高,FSH、LH下降,降低血清细胞因子IL-6、IL-1和TNF-水平,提高腰椎L2-4和股骨颈骨密度。
[1]邓先强,董俊球.健走运动对绝经后妇女雌激素及血脂的影响. 西安体育学院学报,2006,23(4):86-87.
[2]张铁明,谭延敏. 秧歌舞锻炼对老年女性健身作用的实验研究. 武汉体育学院学报,2006,40(5):49-52.
[3]姜树东,宋修妮,邹霞. 健身秧歌舞对中老年妇女心脏功能的影响. 北京体育师范学院学报,2000,12(3):44-47.
[4]耿红,郑陆,阎守扶. 运动−雌激素−骨代谢关系的研究进展. 首都体育学院学报,2008,20(5):57-60.
[5]陈红英,万天真. 绝经后骨质疏松症与血清IL-6、雌激素浓度的关系的临床研究. 河南大学学报(医学科学版),2001,20(3):24-25.
[6]韦朝晖,周美荷. 绝经后骨质疏松症患者细胞因子、骨密度及雌激素水平的关系. 放射免疫学杂志,2008,21(1):49-50.
[7]Margaret E,Rossella E,Nancy A,et al. Endocrine aspects of women’s sexual function. J Sex Med,2010,7(1):561-585.
[8]Deborah V,Novack EB. Osteoclasts take center stage.Cell Metabolism,2007,6(4):254-256.
[9]Phillips MD,Flynn MG,McFarlin BK,et al. Resistive exercise blunts LPS-stimulated TNF-and IL-1. Int J Sports Med,2008,29(2):102-109.
[10]Undurti ND. Anti-in fl ammatory nature of exercise. Nutrition,2004,20(3):323-326.
[11]唐晖,谢敏豪. 运动引起肌源性IL-6分泌的研究进展.中国运动医学杂志,2006,25(1):60-66.
[12]Yanagisawa M,Suzuki N,Mitsuil N,et al. Effects of compressive force on the differentiation of pluripotent mesenchymal cells. Life Sci,2007,81(5):405-412.
[13]周勇. 传统体育对绝经女性骨密度的影响. 北京体育大学学报,2004,27(3):354-356.
[14]Robling AG,Turner CH. Mechanotransduction in bone:genetic effects on mechanosensitivity in mice. Bone,2002,31(5):562-569.
[15]Astrid L,Daniela K,Robert B,et al.Signal transduction pathways involved in mechanotransduction in bone cells. Biochem. Biophys. Res. Commun.,2006,349(1):1-5.
[16]Lidan Y,Sara T,Peling L,et al.Osteocytes as mechanosensors in the inhibition of bone resorption due to mechanical loading. Bone,2008,42(1):172-179.

