抗中性粒细胞胞质抗体相关性间质性肾炎
徐 峰 曾彩虹
病例摘要
病史 49岁女性患者,因“乏力、贫血、血清肌酐(SCr)升高7月余”于2011年1月入院。
2010年6月患者感乏力,疑“感冒”自服中成药,症状无改善,当地医院检查发现肝酶及SCr升高(具体不详),予中药汤剂治疗后肝酶下降,但SCr无改善。2010年 7月测血压偏低,最低 90/40 mmHg,尿检示蛋白 ±,隐血阴性,SCr 344.8 μmol/L,尿素氮24.7 mmol/L,血红蛋白 75 g/L,丙氨酸转氨酶175 U/L,天冬氨酸转氨酶330 U/L,球蛋白波动于 34.0~45.0 g/L,自身抗体阴性,补体正常,血轻链κ、λ偏高,骨髓穿刺检查示骨髓增生活跃,未见明显浆细胞增多。予以护肝、保肾、间断输血等治疗,仍感乏力,伴夜尿增多,复查肝酶降至正常,SCr波动于150.3 μmol/L左右。近1个月前再次出现咳嗽、咳痰,无发热、胸痛。2011-01-04至我院就诊,SCr 132.6 μmol/L,白蛋白 46.6 g/L,球蛋白42.6 g/L。病程中无水肿、肉眼血尿、高血压,无皮疹、腹痛、黑便、脱发、口腔溃疡,无口干、眼干。精神、睡眠差,食欲一般,近期夜尿4~5次。2010年6月起病以来体重减轻约3~4 kg。
既往史:平素体质欠佳,1991年发现“胆汁反流性胃炎”,服用消炎利胆片及中药汤剂治疗;2001年出现月经周期紊乱,数月来潮1次,服用中药调理仍不规则,2003年完全绝经。2005年开始自觉频繁“感冒”,服中成药治疗。2009年发现低血钾,间断服氯化钾缓释片,乏力好转后停药,未规律诊治,血钾情况不详。否认肝炎、结核等传染病史。
家族史:父母有“高血压”史,父亲有“中风”史,母亲及妹妹均过早绝经。
体格检查 体温36.6℃,血压100/70 mmHg,体质量指数(BMI)20.83 kg/m2,慢性病容,轻度贫血貌,需搀扶行走,步态拖曳,扁桃体无肿大,颈部触诊未见甲状腺肿大和包块,心、肺、腹无异常发现;双下肢无水肿及皮疹,四肢肌力5级,肌张力正常,生理反射正常,病理反射未引出。
实验室检查
尿液 尿蛋白定量0.18 g/24h,尿沉渣红细胞计数 1.0 万/ml,C3 2.4 mg/L,α2-MG 2.55 mg/L,NAG 酶 33 U/(g·cr),RBP 0.23 mg/L,溶菌酶 0.97 mg/L,NGAL 23.56 μg/L,KIM-l 0.53 μg/L,IL-18 32.27 ng/L,尿渗量 536 mOsm/(kg·H2O),24h 尿葡萄糖0.19 mmol/L,尿氨基酸 59.5 mg/24h,胱抑素C 0.03 mg/L,eGFR 39.23 ml/(min·1.73m2),钠滤过分数1.89%,肾衰指数2.61。
血常规 血红蛋白106 g/L,白细胞4.44×109/L,血小板145×109/L,网织红细胞0.010。
血生化 白蛋白 40.7 g/L,球蛋白 35.8 g/L,尿素氮 5.9 mmol/L,SCr 132.6 μmol/L,尿酸 557 μmol/L,胱抑素 C 2.50 mg/L,丙氨酸转氨酶 81 U/L,天冬氨酸转氨酶 66 U/L,乳酸脱氢酶 139 U/L,总胆固醇 4.26 mmol/L,三酰甘油 1.27 mmol/L,钠 138.6 mmol/L,钾 3.3 mmol/L,氯 103.2 mmol/L,TCO224.4 mmol/L,C 反应蛋白 0.1 mg/L,空腹血糖4.69 mmol/L。
ANCA检测 荧光法:pANCA阳性 1∶320,cANCA 阴性。ELISA 法:MPO-ANCA、PR3-ANCA 阴性。ANCA抗体谱:组织蛋白酶G阴性,弹性蛋白酶阳性,蛋白酶3阴性,乳铁蛋白阴性,髓过氧化物阴性,细菌渗透增强蛋白阴性。
免疫学 抗心磷脂抗体IgM阳性82.83 MPLU/ml,ANA、A-dsDNA、A-Sm、A-RNP、SSA、SSB 阴性,补体 C3 0.782 g/L,C4 0.162 g/L,IgG 22.6 g/L,IgA 2.39 g/L,IgM 3.17 g/L,IgE < 20 IU/ml,ASO<25 IU/ml,RF <20 IU/ml,狼疮样抗凝因子阴性。乙肝标记物:HbsAb(+),HbeAb(+),HbcAb(+),HCV抗体阴性。外周血淋巴细胞亚群CD4+556 个/μl,CD8+827 个/μl,CD3+1 500 个/μl,CD20+108 个/μl。甲状腺功能:T3 1.68 nmol/L,T4 106.81 nmol/L,FT3 3.92 pmol/L,FT4 12.2 pmol/L,TSH 2.34 mIU/L,甲状腺球蛋白 13.3 Ug/L。抗甲状腺球蛋白抗体11.2(正常值阴性),甲状腺微粒体抗体10.5(正常值阴性),甲状腺过氧化物酶抗体125.9 IU/ml(正常值<100 IU/ml),促甲状腺激素受体抗体3.0 IU/ml(正常值0~14.0 IU/ml)。溶血检查:直接、间接抗人球蛋白试验阴性,酸化溶血检查阴性,血清结合珠蛋白65 mgHb%,游离血红蛋白1.9 mg%。循环内皮细胞27个/ml。黏附分子VCAM 1 606.02 ng/ml,血栓调节蛋白 9.62 ng/ml,VW因子 207.6%,E选择素:80.7 ng/ml。自身免疫性肝炎相关抗体阴性。免疫固定电泳未见单克隆免疫球蛋白条带。
骨髓穿刺 大致正常骨髓象。骨髓活检病理:骨髓增生活跃,伴局灶纤维组织(网状纤维)轻度增生,免疫组化CD138染色见极少量阳性反应细胞(<2%),κ、λ链染色阴性。网染示网状纤维轻度增生,刚果红染色未见阳性沉积物。
肾脏超声 左肾96 mm×36 mm×48 mm,右肾99 mm×27 mm×49 mm,双肾轮廓规则,包膜连续完整,皮质回声正常,肾皮质厚度不清,皮髓界限清楚,双肾内未见肾盂肾盏扩张。
其他辅助检查 副鼻窦CT:(1)两侧上颌窦及筛窦炎;(2)两侧下鼻甲肥大;颈部CT:甲状腺右叶占位,考虑腺瘤可能性大;甲状腺超声:双侧甲状腺多发性包块,腺瘤可能。胸部CT:平扫未见明显异常。
心电图:大致正常心电图;心脏超声:左室舒张功能降低。头颅、骨盆X平片:(1)头颅未见明显异常;(2)骨盆未见明显异常。消化系统超声:(1)肝囊肿;(2)胆囊息肉;(3)胰脾、门静脉彩色多普勒检查未见异常。眼底检查:结膜、巩膜等均未见明显异常,泪膜破裂时间、滤纸试验均阴性。肌电图检查:未见明显异常。
肾活检
光镜 皮质肾组织2条,肾小管间质病变较重,表现为间质大量浆细胞、单个核细胞弥漫浸润,偶见多核巨细胞,大量小管炎(图1A),多处灶性肾小管上皮细胞扁平、刷状缘脱落,管腔内少量蛋白管型,偶见偏振光下具有折光性的嗜碱性结晶物。数处灶性肾小管萎缩、基膜增厚,间质纤维化++。34个肾小球,18个球性废弃,未废弃肾小球病变轻微,仅见节段系膜区轻度增宽,系膜细胞和基质增多,多数袢开放尚好,少数节段袢皱缩明显,包囊腔内见渗出,囊壁节段增厚、分层(图1B)。小叶间动脉弹力层增厚、分层,管周毛细血管内较多单个核细胞聚集。

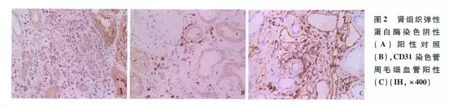
免疫荧光和免疫组化 肾小球4个。冰冻切片荧光染色IgA、C3呈节段散在分布于系膜区。IgG、IgM阴性。肾小管基膜未见免疫复合物、补体沉积。球门区血管、管周毛细血管、间质血管未见免疫复合物、补体沉积。肾小球、肾小管及其基膜和间质血管κ、λ轻链染色均阴性。Ⅳ型胶原α3、α5染色肾小球、肾小球基膜未见缺失,该患者肾组织未见明显中性粒细胞浸润,抗中性粒细胞弹性蛋白酶抗体阴性(图2A),对照组间质中性粒细胞阳性(图2B),CD31管周毛细血管阳性(图2C)。
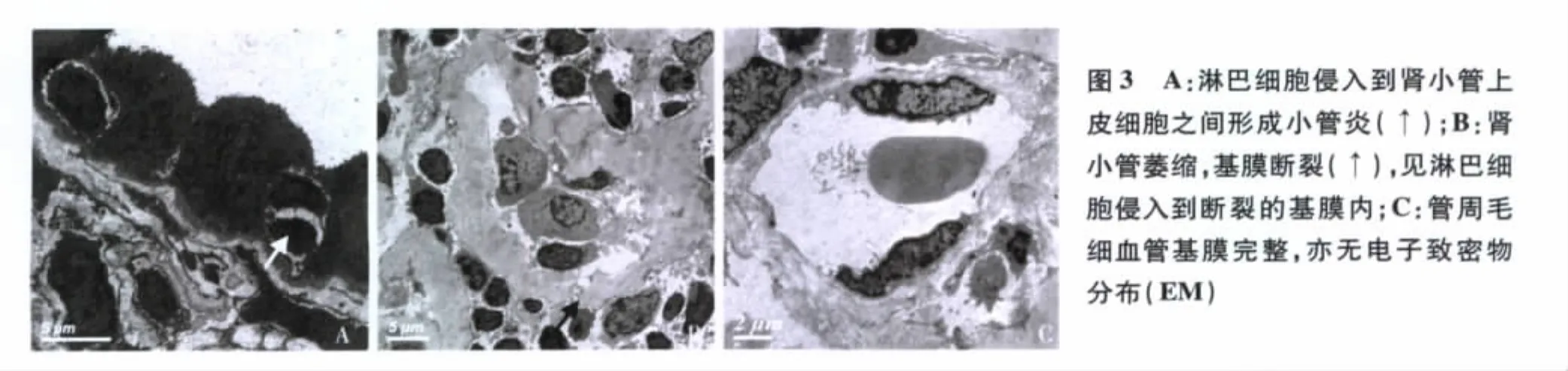
超微结构 电镜下观察1个肾小球,袢开放欠佳,多数基膜扭曲、皱缩,袢开放区的毛细血管袢基膜无分层,基膜厚度280~580 nm,内皮下、上皮侧无电子致密物沉积。系膜区略增宽,无电子致密物分布。少数足细胞胞质微绒毛化,足突节段融合30~40%。近端小管和远端小管见淋巴细胞性小管炎(图3A),数处毁损的小管仅残留基膜,并见基膜断裂(图3B),小管基膜未见电子致密物沉积。间质区域显著增宽,大量淋巴细胞浸润,亦见浆细胞。管周毛细血管基膜未见断裂,亦无电子致密物沉积(图3C)。
小结:(1)间质性肾炎伴小灶性肾小管间质慢性病变;(2)肾小球节段轻度系膜增生伴球性废弃(52.9%)。
治疗及随访 给予环磷酰胺(共1.6g)、甲泼尼龙(24 mg/d)治疗,2011-02-22 复查 pANCA 滴度下降为1∶160。同年6月13日复查pANCA转为阴性,弹性蛋白酶 ANCA阴性,尿蛋白定量 0.17 g/24h,尿沉渣红细胞计数6万/ml(多形型),血白蛋白 36.6 g/L,球蛋白 20.2 g/L,尿素氮 4.6 mmol/L,SCr 88.4 μmol/L。收住院行重复肾活检。
重复肾活检(2011-06-13)
光镜 皮质及皮髓肾组织各1条。肾小管间质慢性病变轻~中度,灶性小管萎缩、基膜增厚(图4A),部分非萎缩小管基膜亦增厚,少量蛋白管型;肾小管间质急性病变较第一次肾活检明显减轻,间质少量单个核及浆细胞浸润,小管炎和管周毛细血管炎(图4B)。20个肾小球中1个球性废弃、囊内见纤维素样渗出。余肾小球节段系膜区轻度增宽,毛细血管袢开放尚好,袢内单个核细胞浸润3~5个/球,囊壁节段增厚。入球小动脉平滑肌细胞空泡变性。

图4 灶性肾小管萎缩,非萎缩小管节段基膜增厚,间质灶性单个核细胞浸润(A),少量小管炎(B)(A:PAS,×200;B:PAS,×400)
免疫荧光 肾小球6个,冰冻切片荧光染色IgA+,节段分布,少量呈颗粒状沉积于系膜区。IgG、IgM、C3阴性。
电镜 观察1个肾小球。毛细血管袢开放尚好,节段基膜扭曲、皱缩,基膜厚330~675 nm。肾小球系膜区未见明显增宽,系膜区未见明确电子致密物分布。足细胞足突节段性融合30% ~40%,胞质少量微绒毛化,胞质内见吞噬溶酶体。肾间质少量淋巴细胞、浆细胞浸润,管周毛细血管内亦见淋巴细胞聚集。肾小管基膜未见电子致密物沉积。
综合临床病理考虑ANCA相关性间质性肾炎。
讨 论
该患者有以下特点:中年女性,有多种药物接触史,临床表现为贫血、肾功能减退,尿检阴性,存在pANCA、抗心磷脂抗体和甲状腺相关自身抗体阳性。首次肾活检组织学表现为以急性病变为主的间质性肾炎,同时也伴有中度慢性病变;肾小球球性废弃达52.9%,未废弃的肾小球病变轻微,未见节段袢坏死和新月体,间质血管亦无坏死性病变;免疫荧光见肾小球IgA、C1q少量沉积;电镜观察亦见大量小管炎和间质大量浸润细胞,肾小球、肾小管及管周毛细血管未见电子致密物分布。患者临床抗核抗体阴性,补体亦正常,SSA、SSB阴性,亦无口干、眼干等症状,结合病理以间质损伤为主的特点,亦无血栓的形成,可以排除系统性红斑狼疮、干燥综合征、抗磷脂抗体综合征、肾小管间质性肾炎-眼色素膜炎综合征等疾病。需重点鉴别间质性肾炎的病因。
多种药物可以导致ANCA阳性和间质性肾炎,如奥美拉唑、吲哚美辛、环丙沙星、西咪替丁、肼苯哒嗪、苯妥英等[1-4],以 MPO-ANCA 阳性常见,也可产生针对蛋白酶3(PR3)、乳铁蛋白、弹性蛋白酶的ANCA。但是药物导致的ANCA亲和力较低,停药后ANCA水平迅速降低或消失。组织学观察肾间质常有嗜酸性粒细胞浸润,有些药物导致的肾损害还会出现肾小管腔内结晶,有时结晶周围可见多核巨细胞形成。免疫荧光通常为阴性,少数药物可出现肾小管和肾小球基膜IgG和补体少量颗粒状或线样沉积。该患者肾间质大量浸润细胞,以浆细胞和单个核细胞为主,1处尚见结晶空隙和多核巨细胞。免疫荧光肾小球仅见少量IgA、C3、C1q沉积,无服用上述导致ANCA阳性药物史。
丙基硫氧嘧啶是导致ANCA阳性的最常见的药物之一。我们曾报道了12例丙基硫氧嘧啶相关血管炎的肾损害,其中11例为MPO-ANCA阳性,1例为MPO/PR3-ANCA双阳性,临床均表现蛋白尿、血尿(5例肉眼血尿)和肾功能不全。肾活检10例为寡免疫复合物节段坏死性肾炎伴新月体形成,2例为节段坏死性肾炎伴膜性病变[5]。该患者实验室检查虽然有甲状腺自身抗体阳性,超声和CT提示腺瘤,但甲状腺功能正常,且无甲状腺功能亢进的临床表现,追问病史,未使用丙基硫氧嘧啶。此外患者出现肾功能不全时已停药一段时间,检测pANCA仍存在阳性,同时还存在心磷脂抗体阳性,因此无法单纯用药物性肾损害来解释。但患者用药史较复杂,是否存在其他药物导致ANCA阳性,尚不能完全排除。
该患者ANCA高滴度阳性是否间质性肾炎的原因?ANCA相关性血管炎临床常表现肾功能进行性下降,常伴蛋白尿及血尿,肾组织形态学以节段坏死性肾小球肾炎和新月体肾炎常见,可同时伴有肾小管炎和间质大量炎细胞浸润[6,7]。Wegener肉芽肿病理改变可表现为肉芽肿性间质性肾炎,以上皮样细胞聚集为主,少数见多核巨细胞,肉芽肿中心区域常见纤维素样坏死,且肉芽肿常位于肾小球和血管周围,同时肾小球伴有节段袢坏死和新月体形成。本例临床无鼻窦、肺等肾外受累,肾活检组织学无肾小球坏死性病变和新月体,肾间质未见肉芽肿样病变,因此并不支持Wegener肉芽肿。
回顾文献发现,部分ANCA阳性的患者可单纯表现为间质性肾炎,而不伴有严重肾小球病变。Nakabayashi等[8]报道 3 例 MPO-ANCA 阳性的患者,肾小球病变轻微,无新月体及袢坏死,肾组织主要表现间质性肾炎,可见间质、管周毛细血管和小管的单个核细胞浸润,偶见小管基膜断裂,电镜下见管周毛细血管壁断裂。该作者认为有一类ANCA相关性血管炎累及管周毛细血管和小管间质,通过肾组织MPO-ANCA和内皮细胞标记CD31及IV型胶原染色发现,小管和管周毛细血管内的中性粒细胞抗MPO-ANCA阳性,而部分管周毛细血管CD31染色阴性,小管和管周毛细血管节段IV型胶原阴性,推测由于活化和浸润的中性粒细胞释放大量MPOANCA,蛋白水解酶和氧自由基,导致内皮细胞损伤,失去CD31表面标记,进而使管周毛细血管基膜断裂。Wen等[9]报道了1例ANCA阳性患者,第一次肾活检时表现为间质性肾炎,肾小球病变轻,重复肾活检时肾小球出现节段袢坏死和新月体。Schönermarck等[10]报道一例 75 岁女性,轻度肾功能不全,伴少量镜下血尿和蛋白尿(0.7 g/d),高滴度的PR3-ANCA阳性,肾活检提示间质性肾炎,肾小球基本正常伴少数球性废弃,该作者认为间质性肾炎是ANCA相关性疾病的一种少见表现形式。
从以上报道可见,ANCA相关的肾损害并不总是表现为肾小球节段坏死性病变伴新月体形成,也有少数表现为间质性肾炎,而肾小球基本正常。该患者血pANCA阳性,ELISA法检测 MPO-ANCA和 PR3-ANCA阴性,ANCA针对细菌渗透增强蛋白、弹性蛋白酶、溶菌酶、组织蛋白酶、乳铁蛋白等抗原的ANCA也可为pANCA[11],因此进一步进行ANCA酶谱的检测,发现弹性蛋白酶ANCA阳性。因此最终诊断考虑为ANCA相关性间质性肾炎。我们也观察了患者间质炎症是否因管周毛细血管损伤引起,但未发现管周毛细血管壁的断裂,肾组织CD31(内皮细胞标志物)的染色未见管周毛细血管内皮细胞表达缺失。肾组织Ⅳ型胶原染色肾小管基膜未见缺失,仅在超微结构下观察到1处肾小管基膜出现断裂。肾组织抗中性粒细胞弹性蛋白酶ANCA染色阴性。
引起间质性肾炎的常见原因还有感染、血液系统肿瘤、轻链沉积病、单克隆免疫球蛋白沉积性疾病(MIDD),但结合临床和实验室检查及肾组织相关染色,以上原因均可排除。
患者经甲泼尼龙和环磷酰胺冲击治疗后,SCr 132.6 μmol/L 降至 91.1 μmol/L,pANCA 滴度由1∶320下降至1∶160,最后转阴,说明免疫抑制治疗对其有效。
患者于6月13日行重复肾活检,组织学提示肾小管间质急性病变较第一次明显减轻,肾小球病变轻,仍未见袢坏死和新月体形成,而ANCA亦转阴,进一步证实间质性肾炎与ANCA相关。
1 Singer S,Parry RG,Deodhar HA,et al.Acute interstitialnephritis,omeprazole and antineutrophil cytoplasmic antibodies.Clin Nephrol,1994,42(4):280.
2 Sakai N,Wada T,Shimizu M,et al.Tubulointerstitial nephritis with anti-neutrophil cytoplasmic antibody following indomethacin treatment.Nephrol Dial Transplant,1999,14(11):2774.
3 Shih DJ,Korbet SM,Rydel JJ,et al.Renal vasculitis associated with ciprofloxacin.Am J Kidney Dis,1995,26(3):516 -519.
4 Kitahara T,Hiromura K,Sugawara M,et al.A case of cimetidineinduced acute tubulointerstitial nephritis associated with antineutrophil cytoplasmic antibody.Am J Kidney Dis,1999,33(2):E7.
5 陈樱花,胡伟新,贺红光,等.丙基硫氧嘧啶相关血管炎肾损害的临床病理特征及转归.肾脏病与透析肾移植杂志,2010,19(3):219-224.
6 胡伟新,黎磊石.系统性血管炎肾脏损害.黎磊石,刘志红.//中国肾脏病学.北京:人民军医出版社,2008,P523-548.
7 Savige J,Davies D,Falk RJ,et al.Antineutrophil cytoplasmic antibodies and associated diseases:a review of the clinical and laboratory features.Kidney Int,2000,57(3):846 -862.
8 Nakabayashi K,Sumiishi A,Sano K,et al.Tubulointerstitial nephritis without glomerular lesions in three patients with myeloperoxidase-ANCA-associated vasculitis.Clin Exp Nephrol,2009,13(6):605 -613.
9 Wen YK,Chen ML.Transformation from tubulointerstitial Nephritis to Crescentic Glomerulonephritis:An Unusual Presentation of ANCAAssociated Renal Vasculitis.Renal Fail,2006,28(2):189 -191.
10 Schönermarck U,Schirren CA,Mistry-Burchardi N,et al.Interstitial nephritis and high titers of PR3-ANCA:an unusual manifestation of ANCA-associated disease.Clin Nephrol,2005,64(5):383 -386.
11 辛 岗,赵明辉,刘丽萍.抗中性粒细胞胞质抗体的检出率及其靶抗原研究,中华风湿病学杂志,2003,7(1):30-33.

