互穿网络改性的蛋白质印迹海藻酸钙微球的制备与表征
英晓光,张凤菊,张立广,成国祥
(1. 天津大学材料科学与工程学院,天津 300072;2. 福州大学化学化工学院,福州 350108)
分子印迹技术已广泛应用于各种结构和功能材料的制备和分离过程[1].国内较早的关于分子印迹聚合物及技术(MIP&T)的论述见于黄文强等[2]的综述.制备球形聚合物微球的方法主要有分散聚合、沉淀聚合、多步溶胀悬浮聚合和表面模板聚合等[3].随着研究的深入,生物大分子印迹聚合物材料在众多生物技术研究领域中发挥着更为复杂的功能[4].以常规聚合方法制备蛋白质印迹聚合物材料面临诸多困难,因蛋白质分子具有体积庞大、结构复杂、可结合位点多以及容易变性失活等特性.水凝胶材料的疏松网络结构以及温和的凝胶化过程使之成为制备大分子印迹基材的首选.此外光引发聚合等温和成型方法也是制备 MIP常用方案.将孔结构引入分子印迹聚合物是针对 MIP结构调整和性能优化的重要设计,为溶质的扩散提供了良好的空间,同时也是质量交换的重要场所.多孔结构的 MIP更加适合大分子特别是蛋白质分子印迹聚合物的制备及应用[1].
海藻酸钙凝胶具有凝胶条件温和、凝胶化过程迅速等特点.牛血清白蛋白(BSA)印迹的多孔海藻酸钙凝胶微球对模板分子具有特异重结合性能[5].然而海藻酸盐含水量高、机械强度低、抗溶胀性能差.交联剂戊二醛与 β二羟基形成六元环的缩醛反应可以完成糖苷链和脂肪链上羟基之间的交联[6],然而用戊二醛处理过的海藻酸盐凝胶微球强度不足,干燥之后发生团聚[7].在海藻酸盐凝胶体系中引入少量的第2种组分并进行交联,可以构成互穿网络结构,如戊二醛交联海藻酸钠-羟乙基纤维素[8-9]以及戊二醛交联海藻酸钠-聚乙烯醇(PVA)共混膜等[10-11].纤维素醚是天然高聚物纤维素的衍生物,具有较好的水溶性.笔者将研究少量不同种类的纤维素醚在交联剂戊二醛作用下,在海藻酸钙基材中形成的互穿网络(interpenetrateing networks,IPNs)对微球性质的影响;进而使用IPNs改性凝胶制备蛋白质及乳液双印迹微球,研究这种改性方法对该体系的重结合行为产生的影响.
1 实验部分
1.1 试剂与材料
海藻酸钠(Alginate,Alg,Mn=35,000,Mw=218,000),化学纯,北京市旭东化工厂生产;羟乙基纤维素(hydroxyl ethyl cellulose,HEC)HD30000、甲基纤维素(methyl cellulose,MC)55HD12000、羟丙基甲基纤维素(hydroxyl propyl methyl cellulose,HPMC)60HD20000,医用级,山东赫达股份有限公司生产;牛血清白蛋白(bovine serum albumin,BSA)、卵白蛋白(Ovalbumin,OVA),Fluka Chemie Gmbh;戊二醛(glutaraldehyde)50%水溶液、三氯甲烷、正己烷,化学纯,天津大学科威公司生产;Span80、Span85,化学纯,中国医药公司北京采购站提供;三羟甲基氨基甲烷[Tris,Tris(hydroxymethyl)aminomethane,C4H11NO3],分析纯,中国医学科学院生物医学工程研究所提供.
1.2 制备过程
1.2.1 纤维素醚溶液的配制
海藻酸钠溶液(质量分数为 3%)3份各 100,mL分别与7.5,mL MC(质量分数为2%)、7.5,mL HEC(质量分数为2%)和7.5,mL HPMC(质量分数为2%)充分搅拌至混合均匀,静置脱泡,得到各种纤维素醚质量分数为5%(干重)的均一黏稠混合溶液.
1.2.2 蛋白质及乳液双印迹改性微球的制备
配制20,μmol/L的BSA溶液18,mL,缓慢搅拌中加入0.06,g海藻酸钠粉末,使其充分溶解;加入2,mL, 2%纤维素醚溶液,配制成3%(质量分数)海藻酸钠-0.2%(质量分数)纤维素醚溶液.乳液模板的引入采用如下方法:在混合均匀的BSA-海藻酸钠-纤维素醚溶液中加入1,g液体石蜡、0.1,g Span85、0.4,g Tween80,电磁搅拌1,h(400,r/min),成为均一稳定的乳液.
用反相悬浮交联法[5,12],将乳液制备成海藻酸钙凝胶(Ca-Alginate,Ca-Alg)微球(microspheres,Ms).具体方法如下:将乳液加入由三氯甲烷和正己烷组成的反相悬浮体系,待悬浮液滴粒径稳定后(约30,min),逐滴加入2%CaCl2水溶液;在经过约30,min,凝胶化过程完成后,从悬浮介质中分离,洗净待用.
将微球置于含有 3%(质量分数)CaCl2和 5%(质量分数)新制戊二醛微酸性溶液(pH=5.85)中,于室温下浸泡32,h,制得戊二醛交联的甲基纤维素-海藻酸钙凝胶(MC-Alg)、羟乙基纤维素-海藻酸钙凝胶(HECAlg)和羟丙基甲基纤维素-海藻酸钙凝胶(HPMCAlg)改性微球.使用梯度乙醇溶液及乙醚溶液将微球中的乳液模板移除,进而在 150,mL,pH=7.5、浓度为0.05,mol/L的Tris-HCl缓冲液中浸泡约48,h,期间定时更换缓冲液并测试其中蛋白质浓度以确定洗脱进程.待模板分子完全移除,即可得到 BSA及乳液双印迹微球(dually imprinted microspheres,dIMs).
1.3 性能测试
1.3.1 红外光谱实验
将干燥的改性微球样品研成粉末,利用红外光谱仪(FTS3000)测定其红外吸收谱图.
1.3.2 溶胀性能实验
将各种改性微球烘干脱水后,置于生理盐水(NaCl 0.9%)中溶胀,每隔一定时间取出微球称重,令微球初始干重为 m0(单位:g),溶胀后的质量为 m(单位:g),则溶胀比 y(无量纲)的计算式为y =.绘制时间-溶胀度曲线.
1.3.3 机械强度实验
在等量 30,mL的 NaCl溶液(0.9%)中加入 5块沸石,并分别放入相同数量的改性微球,置于振荡培养箱(HZQ-F)中恒温(25,℃)等频(150,r/min)振荡 25 h;之后将微球及破损物取出,置于光学显微镜(Axiovert,25)下观察其破碎情况并与完整形态比较.
1.3.4 印迹微球的重结合实验及印迹效率计算
精确称取洗脱蛋白质模板的微球1.500,g浸泡于20,mL 20,μmol/L的BSA溶液中,并置于25,℃、转速100,r/min的振荡培养箱(HZQ-F)中,每隔一定时间以U-1800型紫外可见分光光度计测定上层清液浓度,浓度和重结合量Q(单位:g)之间的关系为
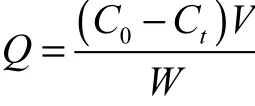
式中:C0是BSA初始质量浓度,mg/mL;Ct是BSA不同时刻的质量浓度,mg/mL;V是 BSA 溶液体积(20 mL);W 是微球质量(1.500,g).根据下式可以计算出印迹效率(imprinting efficiency,IE):

式中 Q0是 BSA分子在非印迹微球上的非特异性重结合量,g.
1.3.5 模板洗脱率的计算
由于戊二醛可能将蛋白质交联,导致模板难以洗脱,因此须计算洗脱的模板占使用模板总量的比例(或生成有效印迹的数量占总印迹数量的比例).测定前 3次模板洗脱所用缓冲液体积及其中的蛋白质浓度,计算洗脱模板的总量;与制备印迹所使用的蛋白质模板总量对比,即可获得模板洗脱率.
1.3.6 离子交换色谱表征
为了证实印迹微球在 2种模板分子溶液中重结合行为的差异性,即印迹选择性,采用高效液相离子交换色谱法分析重结合前后溶液成分的变化.色谱柱规格为Φ2.1,mm×200,mm,填料为交联羟丙基纤维素(SP-纤维素 HP),采用自动沉降法填柱;缓冲液为各种浓度的磷酸钠溶液(0.02~0.6,mol/L),以及磷酸二氢钾-磷酸氢二钠缓冲溶液;0.5,mol/L,NaCl溶液以及 0.5,mol/L,NaOH 溶液;流动相最高流速为2,mL/min,最高柱压为 570,psi(即 3.9,MPa,1标准大气压(atm)=14.696磅/吋2(psi));检测器条件为230,nm、室温下紫外检测.
2 结果与讨论
在互穿网络改性的海藻酸钙水凝胶微球的分子印迹及重结合实验中,共价交联的纤维素醚的种类及含量对微球的重结合行为将产生不同程度的影响.图1所示为BSA及乳液印迹海藻酸钙凝胶微球光学显微形貌.

图1 牛血清白蛋白及乳液印迹海藻酸钙印迹微球Fig.1 BSA and emulsion imprinted Ca-Alg Ms
2.1 红外光谱
纤维素醚和戊二醛形成互穿网络,通过红外光谱可以检测到共价键的生成.红外测试分别对未改性的海藻酸钙凝胶(Ca-Alg)和3种纤维素交联改性之后的海藻酸钙凝胶(HEC-Alg、HPMC-Alg和MC-Alg)样品进行(如图 2所示).改性之后(b、c、d谱线)3种凝胶的 C—O—R’CR—O—C 缩醛官能团的吸收峰(1,031,cm-1)和—CO—羰基的吸收峰(1,610,cm-1)均比改性之前a强度增大,这是因为戊二醛在纤维素醚分子的羟基之间形成缩醛和半缩醛,从而导致这2种官能团含量增加.
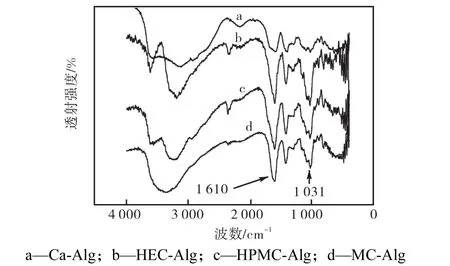
图 2 不同种类纤维素互穿网络改性的海藻酸钙凝胶红外光谱Fig.2 FTIR of Ca-Alg hydrogel with IPNs of different kinds of cellulose
2.2 溶胀性能
图3为微球溶胀过程中溶胀度随时间的变化曲线,所有样品在起初200,min内的溶胀速率较快,而这以后HEC-Alg和HPMC-Alg凝胶微球的溶胀度变化很小,并于400,min左右达到平衡.对于未经过与纤维素醚混合或未用戊二醛溶液处理过的样品,整个溶胀过程的吸水量持续上升,直到微球破损.未改性的Ca-Alg凝胶微球的最终质量约为初始值的10倍,而HEC-Alg改性微球溶胀后的质量仅为初始值的4倍.

图3 不同海藻酸钙凝胶微球的溶胀度曲线Fig.3 Swelling ratio-time curves of different Ca-Alg Ms
微球溶胀被抑制是戊二醛和纤维素醚共同作用的结果.纤维素醚和海藻酸钙分子中的羟基形成氢键;戊二醛进而与纤维素醚分子上其他羟基发生缩醛反应,在凝胶中形成互穿网络结构,起到抑制溶胀的作用.纤维素醚单独与海藻酸盐凝胶复合仅仅依靠氢键的作用,而海藻酸钙分子六元环上的羟基对缩醛反应的活性很低,与戊二醛起缩醛反应的量极少,都不能有效抑制溶胀.在光镜下观察 Ca-Alg凝胶微球和 HEC-Alg改性微球的形貌,可以比较出交联对溶胀的抑制效果.Ca-Alg微球溶胀速率较高,且在接近溶胀平衡时出现破损;而 HEC-Alg改性微球溶胀速率较小,即使在溶胀末期也未出现破损情况.
2.3 机械强度
将相同条件下,Ca-Alg微球和 HEC-Alg改性微球在生理盐水中进行振荡破损实验,并统计破损个数,结果列于表1.比较后发现未改性的Ca-Alg微球在振荡 25,h后有较多数量的破损;而 HEC-Alg改性微球相对破损数量较少,保持了较好的球形和完整性.这是因为用 HEC改性之后,互穿网络中的共价交联点和分子间作用使微球的机械强度提高,抵御碰撞破损的能力增强.

表1 海藻酸钙和羟乙基纤维素互穿网络改性海藻酸钙微球的振荡破损实验结果Tab.1 Oscillation test results of Ca-Alg Ms and Ms modified by IPNs
2.4 模板洗脱率
通过紫外-可见分光光度计测定 3次洗脱液中蛋白质的含量,可以确定蛋白质模板的洗脱率,如表 2所示.第 3次的洗脱液中几乎检测不到蛋白质,可认为模板已完全移除.模板的洗脱率(或印迹的生成率)可以用洗脱液中蛋白质总量与制备过程中使用的模板质量的比值表示.根据表 2,82.20%的蛋白质模板被洗脱,其他的模板则被包埋在基材内部.

表2 BSA分子印迹微球模板的洗脱率Tab.2 Eluting ratio of template in molecular imprinted Ms
2.5 双印迹凝胶微球的重结合行为
2.5.1 振荡体系下的重结合实验
图 4所示为 25,℃、转速 100,r/min的振荡培养箱环境里,单位质量的印迹微球在 BSA溶液中的重结合量随时间的变化曲线.未改性的两组微球对OVA 的最大重结合量(20.867,17.747)比两组 HECAlg改性微球样品高(13.493,11.480).这可能是因为纤维素的混入造成海藻酸钙凝胶网络致密,使蛋白质分子渗入阻力增大;或是因为纤维素分子占据、替换和遮盖了海藻酸钙网络上印迹的有效位点,从而降低了微球对分子的结合效率.
从印迹效率(IE)计算结果(见图 5)也可得知,由于实验后期微球溶胀程度很大,印迹结构变形,逐渐失去特异性重结合能力,原先的特异性重结合能力被非特异性重结合所取代.经由 HEC改性的微球样品,无论是否含有乳液孔穴,印迹效率最大值均高于各自未改性的空白对照组样品.由计算可知,经由HEC改性后,双印迹和分子印迹微球最大印迹效率分别由1.889和1.794提高到1.922和1.820.
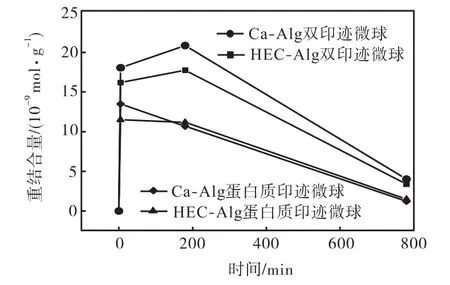
图4 振荡培养环境中的重结合量曲线Fig.4 Rebinding quantity in oscillation environment
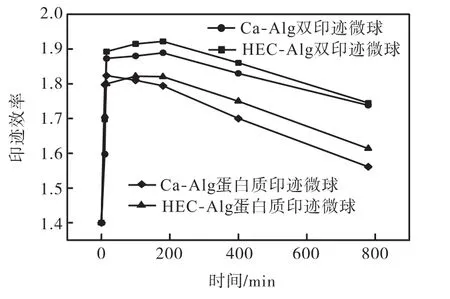
图5 振荡培养环境中的印迹效率Fig.5 Imprinting efficiency in oscillation environment
2.5.2 静置体系下的重结合实验
将Ca-Alg双印迹微球及HEC-Alg双印迹微球各自浸泡于20,mL 含有BSA,20,μmol/L、CaCl20.5%的溶液中,测量吸光度并计算重结合量随时间的变化规律.由图6可以看出经由HEC交联改性的微球最大重结合量明显高于未改性微球,释放速率低于未改性微球.同时通过计算发现,改性微球的印迹效率高于未改性微球(见图7);且经HEC改性后,双印迹微球最大印迹效率由2.19提高到2.70.在这次实验中改性微球具有比未改性微球更高的重结合量和印迹效率,与振荡体系中得出的结论不一致,这种现象与微球重结合机理和2种实验体系不同有关.
微球的互穿网络改性对重结合行为的影响可以归结为扩散因素和微环境改变两方面.振荡培养箱的机械运动促使扩散速率加快;未经改性的海藻酸钙微球网络结构松散、孔隙较大,而经交联改性的微球网络结构紧密、孔隙较小,决定了前者的内外扩散速率要大于后者,微球内部的蛋白浓度达到较高值,结合←→解离平衡浓度也达到较高值,造成在振荡体系下,改性微球的重结合量低于同组未改性微球的重结合量.
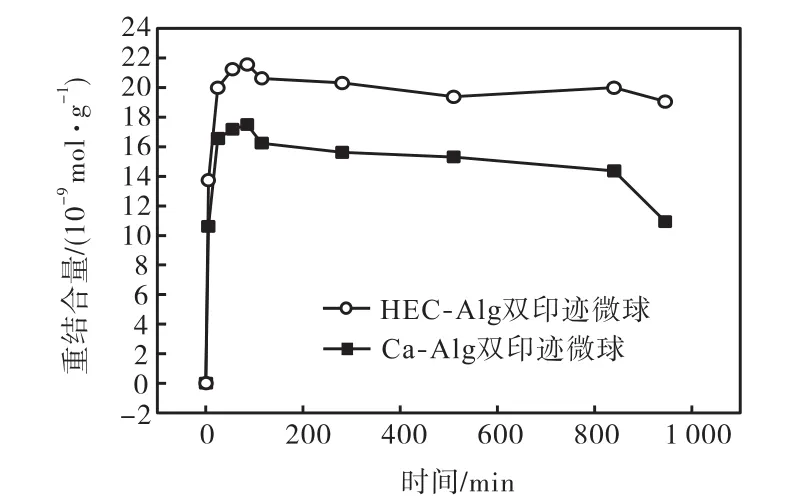
图6 静态培养环境中的双印迹微球重结合量Fig.6 Rebinding quantity of dually imprinted Ms in static environment

图7 静态培养环境中的双印迹微球印迹效率Fig.7 Imprinting efficiency of dually imprinted Ms in static environment
在静置体系中扩散速率较小,此时决定重结合速率的是结合-解离过程.未经改性的微球网络疏松,容易达到重结合平衡,但随着微球本体溶蚀程度加剧,不可能长期保持较高的重结合量,转而进入解离阶段;改性微球网络结构紧密,孔隙较小,虽然受内扩散制约,不易达到吸附平衡,但随着时间的增长,重结合量会持续增加,且可以长时间保持,微球便呈现出较高的最大重结合量和较低的解离速率.
2.5.3 重结合行为的离子交换色谱表征
为了研究改性微球的印迹选择性,将 BSA分子印迹凝胶微球在牛血清白蛋白及卵白蛋白溶液中进行重结合实验,对溶液进行离子交换色谱分析,结果如图 8所示.用互穿网络改性印迹微球浸泡过的溶液,其中 1种组分的 UV吸收强度呈现出显著变化;而未经改性的印迹微球,2种组分的吸收强度的变化均不明显.这说明互穿网络改性对提高印迹选择性有较好的效果.
为方便计算,将2种蛋白的最大紫外吸收强度设为10,其他样品的强度与之作商得到相对吸收强度,如表3所示,其中分离系数α表征印迹微球在双组分溶液中的特异重结合性能.经过互穿网络改性后的印迹微球,其分离系数显著提高(18.88),证实了改性对增强印迹孔穴稳定性和位点构象精确性起到的促进作用.
互穿网络的引入不仅改善了凝胶基材的机械性能,同时也改变了基材内部微环境的亲疏水性.海藻酸盐水凝胶体系中,由纤维素醚和戊二醛共价交联的聚合物链段导致基材整体的疏水性增加,进而影响到印迹空穴和位点的疏水性.对于构象复杂的蛋白质分子,外围区域的亲水性结构使之易结合在亲水性微环境的基材上.而蛋白质分子内部的疏水性区域也可能在特定环境中成为重结合的有利因素.
海藻酸盐凝胶基材因其富含亲水集团和脂肪链柔软的结构特点,对于完成结构复杂、体积庞大的蛋白质分子的印迹和洗脱过程十分有利.因为蛋白质分子精细的构象和多官能团的外围轮廓需要基材链段的构象调整.然而模板的洗脱以至后续的重结合操作却无法避免印迹精确结构的损坏.在海藻酸钙水凝胶体系中引入共价交联的纤维素醚类互穿网络,可以通过比 Ca2+交联更强的共价键以及聚合物链段之间的分子间作用,限制基材的溶胀并提高其机械强度,有效保护了印迹位点的精确构象.

图8 OVA-BSA溶液与BSA印迹微球进行重结合前后色谱峰变化Fig.8 Chromatographic peaks of OVA-BSA solution before and after rebinding with BSA imprinted Ms
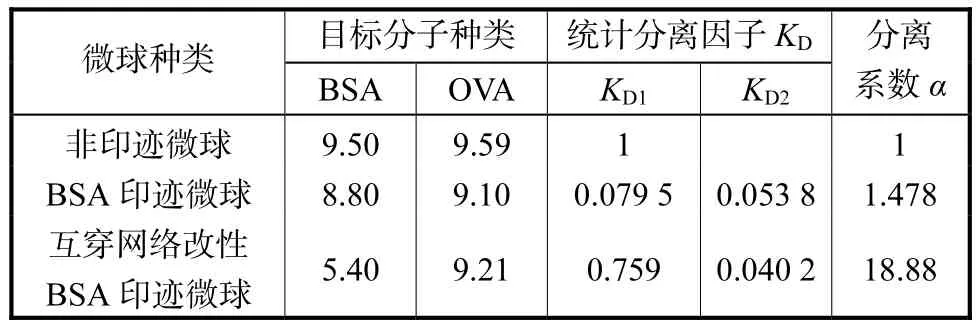
表3 BSA印迹微球重结合实验方案及离子交换色谱吸收峰相对强度Tab.3 Rebinding tests of BSA imprinted Ms and the relative intensity of ion-exchange chromatography
3 结 语
由于纤维素醚与海藻酸盐的羟基间的氢键作用,纤维素醚分子可较好地溶解于海藻酸盐溶液中.采用将少量纤维素醚加入海藻酸盐凝胶体系,并用戊二醛对纤维素醚分子进行共价交联,形成互穿网络结构,达到使机械强度提高、抗溶胀性能增强、释放时间延长的目的.在不同种类的纤维素醚衍生物中,0.2%(质量分数)的羟乙基纤维素与 5%戊二醛对海藻酸钙凝胶体系的改性效果最佳.
重结合实验表明,在振荡体系下,改性的微球重结合量略低于未改性微球.其原因是改性微球致密的网络成为制约内外扩散的主要因素,降低了重结合量.在静置体系下,改性微球的重结合量和印迹效率均高于未改性微球,其原因是此时微球的溶蚀成为重结合量的决定因素.改性微球的交联网络延缓了微球解体和目标分子解离的进程.这种改性方法对于抑制微球溶蚀、破碎并维持蛋白质分子重结合量起到一定的作用.另外,考虑到因共价交联互穿网络的引入而改变的微环境亲疏水性,笔者认为依靠分子热运动接近并与基材结合的蛋白分子,有可能改变其外围结构的亲疏水性,使之适合改性的印迹结构.
[1]史瑞雪,郭成海,张东江,等. 运用电化学方法制备分子印迹聚合物膜[J]. 高分子材料科学与工程,2003,19(6):213-215.
Shi Ruixue,Guo Chenghai,Zhang Dongjiang,et al. The preparation of molecularly imprinted polymer membrane by electrochemical method[J].Polymer Materials Science and Engineering,2003,19(6):213-215(in Chinese).
[2]黄文强,何炳林. 模板聚合物及其在有机化合物分离中的应用[J]. 离子交换与吸附,1988,4(3):225-234.
Huang Wenqiang,He Binglin. Application of polymers prepared by imprinting with templates for separation of organic compounds[J].Ion Exchange and Adsorption,1988,4(3):225-234(in Chinese).
[3]Lu Shulai,Cheng Guoxiang,Zhang Honggang,et al.Preparation and characteristics of tryptophan-imprinted Fe3O4/p(trim)composite microspheres with magnetic susceptibility by inverse emulsion-suspension polymerization[J].Journal of Applied Polymer Science,2006,99(6):3241-3250.
[4]Zhang Fengju,Cheng Guoxiang,Ying Xiaoguang. Emulsion and macromolecules templated alginate based polymer microspheres[J].Reactive and Functional Polymers,2006,66(7):712-719.
[5]Zhang Fengju,Cheng Guoxiang,Gao Zhi,et al. Preparation of porous calcium alginate membranes/microspheres via an emulsion templating method[J].Macromolar Materials and Engineering,2006,291(5):485-492.
[6]Pang Xingshou,Cheng Guoxiang,Lu Shulai,et al. Synthesis of polyacrylamide gel beads with electrostatic functional groups for the molecular imprinting of bovine serum albumin[J].Analytical and Bioanalytical Chemistry,2006,384(1):225-230.
[7]Toti U S,Aminabhavi T M. Different viscosity grade sodium alginate and modified sodium alginate membranes in pervaporation separation of water+acetic acid and water+isopropanol mixtures[J].Journal of Membrane Science,2004,228(2):199-208.
[8]Naidu B V K,Sairam M,Raju K V S N,et al. Thermal,viscoelastic,solution and membrane properties of sodium alginate/hydroxyethylcellulose blends[J].Carbohydrate Polymers,2005,61(1):52-60.
[9]Naidu B V K,Krishna R K S V,Aminabhavi T M. Pervaporation separation of water+1,4-dioxane and water+tetrahydrofuran mixtures using sodium alginate and its blend membranes with hydroxyethylcellulose:A comparative study[J].Journal of Membrane Science,2005,260(1/2):131-141.
[10]Kurkuri M D,Nayak J N,Aralaguppi M I,et al. Sorption/diffusion of aqueous mixtures of 1,4-dioxane/ tetrahydrofuran through blend membranes of poly(vinyl alcohol)and sodium alginate:Their compatibility and pervaporation separation studies[J].Journal of Applied Polymer Science,2005,98(1):178-188.
[11]Dentini Mariella,Rinaldi Gianluca,Barbetta Andrea,et al.Acid gel formation in(pseudo)alginates with and without G blocks produced by epimerising mannuronan with C5 epimerases[J].Carbohydrate Polymers,2006,63(4):519-526.
[12]Ying Xiaoguang,Zhang Fengju,Zhang Liguang,et al.Effect on rebinding behavior with different composition and structure of the dually imprinted alginate polymer microspheres using proteins and o/w emulsion drops as dual templates[J].Journal of Applied Polymer Science,2010,115(6):3516-3526.

