十二钼酸铵结晶工艺对比研究
王 磊,厉学武,唐军利,唐丽霞
(金堆城钼业股份有限公司技术中心,西安710077)
0 前言
十二钼酸铵(AMM)是钼酸铵的一种,具有Keggin型结构,晶体形貌规整,纯度高,粒度小,是制备超纯、超细钼粉的一种较理想的原料[1]。自十二钼酸铵第1篇专利[2]问世以来,化学、化工研究人员对十二钼酸铵进行了细致入微的研究,如陕西师范大学提出了用高氯酸制备十二钼酸铵[3],金堆城钼业股份有限公司研究人员运用一种无机酸制备十二钼酸铵[4-5]等。
低聚态钼酸铵(二钼酸铵、四钼酸铵、七钼酸铵及八钼酸铵)在酸性溶液中被拆分,然后拆分的钼酸铵单元按照一定秩序组合形成十二钼酸铵晶体,在钼酸铵组成单元的拆分、组合过程中,大部分杂质残留在结晶母液中,达到钼酸铵净化、提纯的目的。
钼酸盐在酸性溶液中有很强的缩合倾向。MoO24-中的Mo-O键较弱,因而MoO24-在酸性溶液中脱水缩合,形成复杂的多钼酸根离子,溶液的酸性越强,缩合程度越大[6],具体见表1。
一定氢离子浓度下,钼酸根缩合为二钼酸铵根离子及不同钼酸盐缩聚析出十二钼酸铵的方程式见式(1)~(5)。

表1 溶液pH值与钼酸根离子之间的关系

在前人研究的基础上,本文系统考察了文献资料介绍的十二钼酸铵结晶工艺,包括使用王水制备十二钼酸铵、高氯酸制备十二钼酸铵以及硝酸制备十二钼酸铵,对比不同结晶工艺生成的十二钼酸铵晶体形貌,粒度、元素含量以及晶体的衍射曲线,为十二钼酸铵产业化研究提供参考。
1 实验部分
1.1 实验原料
二钼酸铵(ADM)、四钼酸铵(AQM)及七钼酸铵(APM),其技术指标见表2,试剂氨水,NH3含量为25%~28%,分析纯试剂硝酸,HNO3含量为65%~68%,HCl含量为36%~38%的试剂纯盐酸,试剂高氯酸,工业纯水。

表2 二钼酸铵、四钼酸铵及七钼酸铵技术指标
1.2 仪器
1 000 mL玻璃烧杯,50 mL、500 mL量筒,玻璃温度计,布氏漏斗,MH3000型电子调温加热套,Ⅱ-1精密增力电动搅拌器,DHG-9240A型电热恒温鼓风干燥箱,2×Z-1型旋片真空泵。
1.3 结晶工艺路线
自第1项十二钼酸铵专利公开至今,钼化学、化工研究人员发表了许多有关十二钼酸铵制备及十二钼酸铵应用研究文献资料,共产生了4条制备十二钼酸铵工艺路线。
工艺路线1:王水制备十二钼酸铵:38 g二钼酸铵、42.4 g七钼酸铵溶于400 mL纯水中,加热至70℃得到钼酸铵溶液。用150 mL的王水加入钼酸铵溶液中。将100 mL稀氨水加入钼酸铵溶液,形成浅黄色的溶液。将40 mL硝酸加入上述溶液中,并且在70℃下保温5~10 min。结晶,约15 min后形成浅黄色沉淀,沉淀物在溶液中静置1~24 h,固液分离。最后用200 mL摩尔浓度为0.1 mol/L的HNO3洗涤滤饼,而后滤饼放入110℃烘箱内烘干,样品记为a。
工艺路线2:高氯酸制备十二钼酸铵:取20 g七钼酸铵和16.5 g二钼酸铵加入333 mL工业纯水中,搅拌溶解得到钼酸铵溶液。用50℃水浴加热钼酸铵溶液,缓慢加入140 g高氯酸,搅拌反应1 h左右得到十二钼酸铵前驱体。向前驱体中加入50 mL氨水,35 mL纯水,再加入42 mL硝酸,搅拌40 min,陈化1 h。最后用硝酸浓度为0.1 mol/L的硝酸溶液100 mL洗涤3次,滤饼放入110℃环境中烘干,样品记为b。
工艺路线3:盐酸制备十二钼酸铵:取一定量的四钼酸铵配制钼酸铵溶液,配制的钼酸铵溶液含59.2 g/L的氨、钼含量大于200 g/L。取500 mL钼酸铵溶液,用1 250 mL纯水稀释,然后用250 mL的盐酸酸化,产生浅黄色溶液。加热浅黄色溶液至70℃,在此温度下保温2 h,形成十二钼酸铵沉淀。过滤进行分离沉淀,然后用200 mL纯水洗涤滤饼,放入110℃烘箱烘干,样品记为c。
工艺路线4:分别取240 mL工业纯水和160 mL试剂硝酸注入三口烧瓶内,开启搅拌装置进行搅拌,开启加热装置加热硝酸溶液至75℃时,向溶液中加入四钼酸铵115 g,保温1.5 h,自然冷却至室温(20℃)后进行真空抽滤,取150 mL工业纯水分3次洗涤滤饼,滤饼放在100℃烘箱烘干,样品记为d。
2 结果与讨论
2.1 晶相分析
由图1合成样品的XRD谱图知,a、b、c及d的衍射峰强度几乎相同,同时其衍射峰的位置一致,与十二钼酸铵的标准衍射谱图衍射峰位置吻合,由此说明合成样品a、b、c及d是十二钼酸铵,同时,工艺路线1至工艺路线4无任何区别。

图1 合成样品的XRD分析
2.2 形貌分析
图2是合成样品的扫描电镜照片,图2中a、b晶体横截面积较大且相差并不大,c晶体横截面积最大,而d晶体横截面积最小,说明工艺路线4合成的晶体粒度较小,工艺路线3合成的晶体粒度最大,这是由于样品a、b及c是从过饱和度较小的溶液中结晶中析出的,而样品d是从过饱和度大的溶液析出的,溶液的相对过饱和度越大,越有利于成核,不利于晶核成长[7],结晶析出的晶体粒度越小。

图2 合成样品的扫描电镜照片
2.3 元素分析
表3数据显示,工艺路线1和工艺路线2用相同原料,但是结晶析出的十二钼酸铵杂质含量不同,工艺路线1制备的十二钼酸铵中钾含量高,其他杂质含量差别不大,工艺路线3和工艺路线4用相同原料,但是工艺路线4制备的十二钼酸铵杂质含量较高,集中体现在钾含量偏高。另外,对比合成样品与原料元素含量,合成样品杂质含量均低于原料杂质含量。
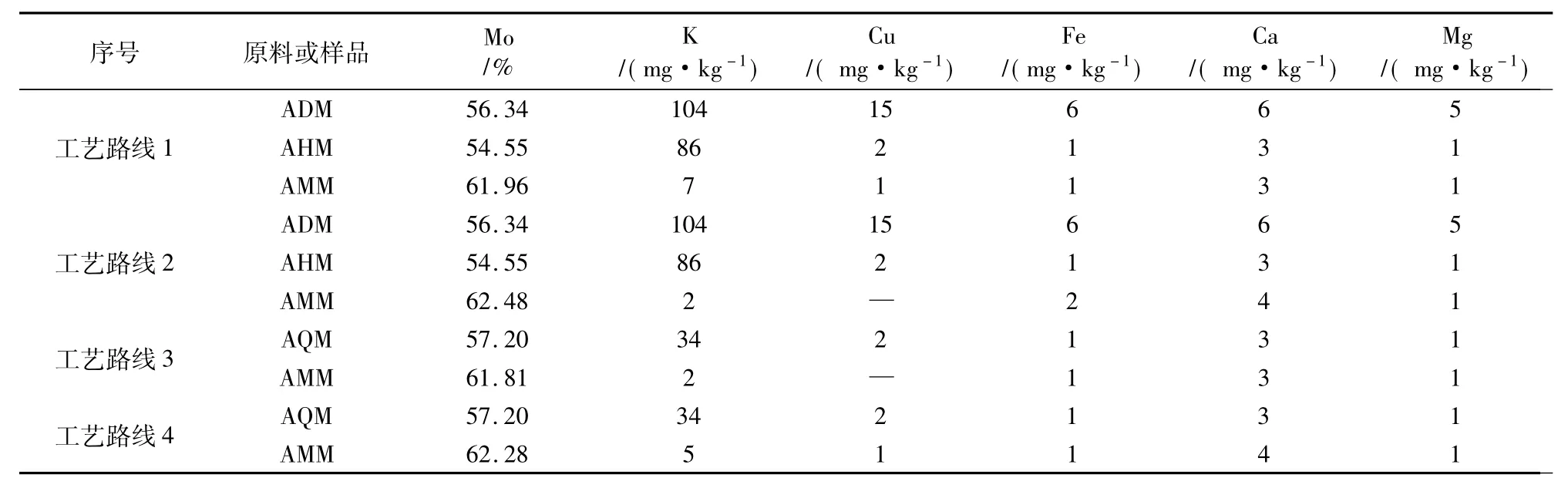
表3 工艺路线所用原料及合成样品的元素含量
3 结论
(1)合成样品的XRD衍射峰的位置和衍射峰强度图显示,工艺路线对十二钼酸铵的晶体结构没有影响。
(2)合成样品的扫描电镜显示,工艺路线1至工艺路线3制备的十二钼酸铵粒度大,而工艺路线4制备的十二钼酸铵粒度相对较小,但是均呈现规整的六棱柱状。
(3)合成样品的元素含量显示,所有工艺路线均具有净化、提纯钼酸铵的功能,但是工艺路线2和工艺路线3净化、除杂能力最强。
[1]张文钲.钼酸铵研究进展[J].中国钼业,2005,29 (2):29-32.
[2]Raj P.Singh,Thomas A.Wolfe,David L.Houk.Ammonium dodecamolybdate and method of making[P].US6793907.2004.
[3]陈亚芍,赵丽芳.十二钼酸铵的制备方法[P].ZL200710017390.3,2009.
[4]唐丽霞,厉学武,武洲,等.十二钼酸铵制备及工艺参数考察[J].中国钼业,2009,33(5):24-27.
[5]厉学武,唐军利,唐丽霞,等.氢离子对合成十二钼酸铵的影响[J].中国钼业,2010,34(5):32-34.
[6]天津大学无机化学教研室.无机化学[M].北京:高等教育版社,1999.
[7]马荣骏.湿法冶金原理[M].北京:冶金工业出版社,2007.
——非均布滤饼的局部比阻与平均比阻的测定与计算方法

