高维持剂量氯吡格雷在冠脉分叉病变双药物洗脱支架植入术后有效性和安全性对照研究
杜大勇, 赖晓辉, 李运田, 黄 海, 李庆勇, 柳 杨, 石丽威, 张俊堂 (解放军305医院心血管
疾病诊疗中心, 北京 100017;*通讯作者,E-mail:lyt305@126.com)
众多研究证实,接受冠状动脉支架治疗的患者使用阿司匹林联合75 mg/d氯吡格雷,可显著降低术后早期及晚期缺血事件。双联抗血小板治疗成为经皮冠状动脉介入(percutaneous coronary intervention,PCI)围术期和术后辅助药物治疗的基石。
冠状动脉分叉病变是目前PCI的一个难题[1,2],双金属裸支架植入再狭窄率高,已被淘汰;双药物洗脱支架(drug eluting stents,DES)技术植入分叉病变处术后再狭窄方面显著降低,但支架内亚急性和晚期血栓的发生率明显增高[3-5],成为分叉病变介入治疗的“瓶颈”。因此,非常有必要探讨强化抗血小板治疗有效性和安全性,而有关氯吡格雷高维持剂量在PCI中的应用少见报道。本研究采用前瞻、随机对照方法,评价150 mg高维持量氯吡格雷在分叉病变双DES植入术患者中疗效和安全性。
1 资料及方法
1.1 研究对象 2007-06~2009-12间共146例冠脉真分叉病变患者采用双DES植入技术而入选本研究。排除标准包括:预计寿命<1年,接受过PCI或冠状动脉搭桥术(coronary artery bypass grafting,CABG),出血素质,心功能Ⅳ级,肌酐清除率小于25 ml/min,6个月内有脑血管意外,氯吡格雷或阿司匹林禁忌,DES过敏,白细胞计数小于4×109/L或血小板计数小于100×109/L,活动性肝病以及在PCI术前、术中使用过血小板糖蛋白Ⅱb/Ⅲa受体拮抗剂。
1.2 PCI技术 每例患者仅允许植入Excel的DES,根据Lefevre分型[6]均属于真分叉病变,主干及分支血管目测直径分别≥2.5 mm和≥2.0 mm,主干血管病变可以被两个最长的DES完全覆盖,每例患者只能有一个分叉病变。入选患者在PCI术中支架近段和远端出现夹层时,可以再植入额外的支架完全覆盖病变,禁止使用金属裸支架和其他类型DES。
1.3 PCI术后抗血小板药物和其他药物治疗方案及分组 所有入选患者在入院时接受3-5 d氯吡格雷75 mg/d及阿司匹林100 mg/d常规治疗,在PCI术后按研究方案计算机产生随机数字号的奇偶性将入选患者随机分为两组,并签署知情同意书。对照组氯吡格雷(波立维,赛诺菲-安万特,法国)每日75 mg维持量,实验组为150 mg高维持剂量,以及100 mg阿司匹林治疗,持续到术后1个月。此后所有患者接受每日75 mg氯吡格雷直到DES植入术后12个月。研究期间所有患者伴随疾病治疗方案不变。高血压患者的血压在药物治疗后控制于≤140/90 mmHg。糖尿病的治疗糖化血红蛋白(HbAlC)控制在6.5%以内。
1.4 终点及随访 所有患者在首次PCI手术后1、6及12个月接受随访,此后每年随访1次,直到2010年12月。主要终点包括全因死亡、致死及非致死心肌梗死(myocardial infarction,MI)以及靶血管血运重建(target vessel revascularization,TVR,包括PCI及CABG)。心肌梗死(MI)是诊断参照心肌梗死溶栓治疗(thrombolysis in myocardial infarction,TIMI)试验标准:①在≥2个连续胸前导联或≥2个肢体导联中新出现的异常Q波(大于40 ms,0.1 mV),而不是前次MI的演变;②肌酸激酶同工酶CK-MB水平升高至正常上限的3倍以上,如果PCI前CK-MB(或总CK)水平高于正常上限,则必须较PCI前水平升高至少50%,并且CK-MB(或总CK)水平在本次MI发生前已有降低;③对随机分组前即有CK-MB升高且无降低趋势的患者,须有与MI相符的复发性心绞痛或新出现心电图改变,伴随CK-MB高于峰值50%,或接受CABG的患者CKMB水平高于正常上限10倍。靶血管血运重建(TVR)是指包括支架近端及远端5 mm在内的支架段存在直径狭窄≥50%的病变,并且需要血运重建治疗。
支架内血栓栓塞是指患者出现急性冠脉综合症、冠状动脉造影证实存在靶血管闭塞、支架内或者邻近支架部位存在充盈缺损的血栓、或者没有血管造影的结果但是靶血管支配区域出现急性心肌梗死,或难以用非心源性因素解释的猝死。
次要终点包括严重及轻微出血事件、严重血小板减少(<20×109/L)以及输血。出血事件为30 d内发生的出血事件,包括严重出血和轻微出血。严重出血定义:致死的或临床明显的出血,如颅内出血或导致Hb下降≥50 g/L,需输血或住院处理的消化道大出血。轻微出血定义:除大出血外的便血、大便潜血阳性、牙龈出血或直径<2 mm的皮下出血以及尿常规检查有红细胞。
1.5 统计学分析 采用SPSS13.0软件进行统计学处理。计量资料数据用±s表示,采用t检验;计数资料均以百分比表示,采用χ2检验或Fisher精确性检验。主要终点采用Kaplan-Meier方法和Logrank检验,P<0.05认为差异有统计学意义。
2 结果
2.1 临床及造影、支架植入基线资料比较 2007-06~2009-12间共入选146例成功进行分叉病变双支架植入的患者,其中75例于术后接受高维持剂量氯吡格雷治疗,71例接受常规维持剂量氯吡格雷治疗。两组临床基线资料包括年龄、性别、吸烟、糖尿病、高血压、LVEF等均无明显差异,接受其他心血管药物治疗如β受体阻滞剂、钙离子拮抗剂、他汀类、血管紧张素转换酶抑制剂等的比例亦无差异(见表1)。两组基线造影、病变血管类型及其参数以及PCI手术特征具有可比性,两组患者最终对吻扩张(FKBI)成功率在97%以上(见表2)。

表1 两组患者临床基线特征Tab 1 The baseline of patients in 2 groups
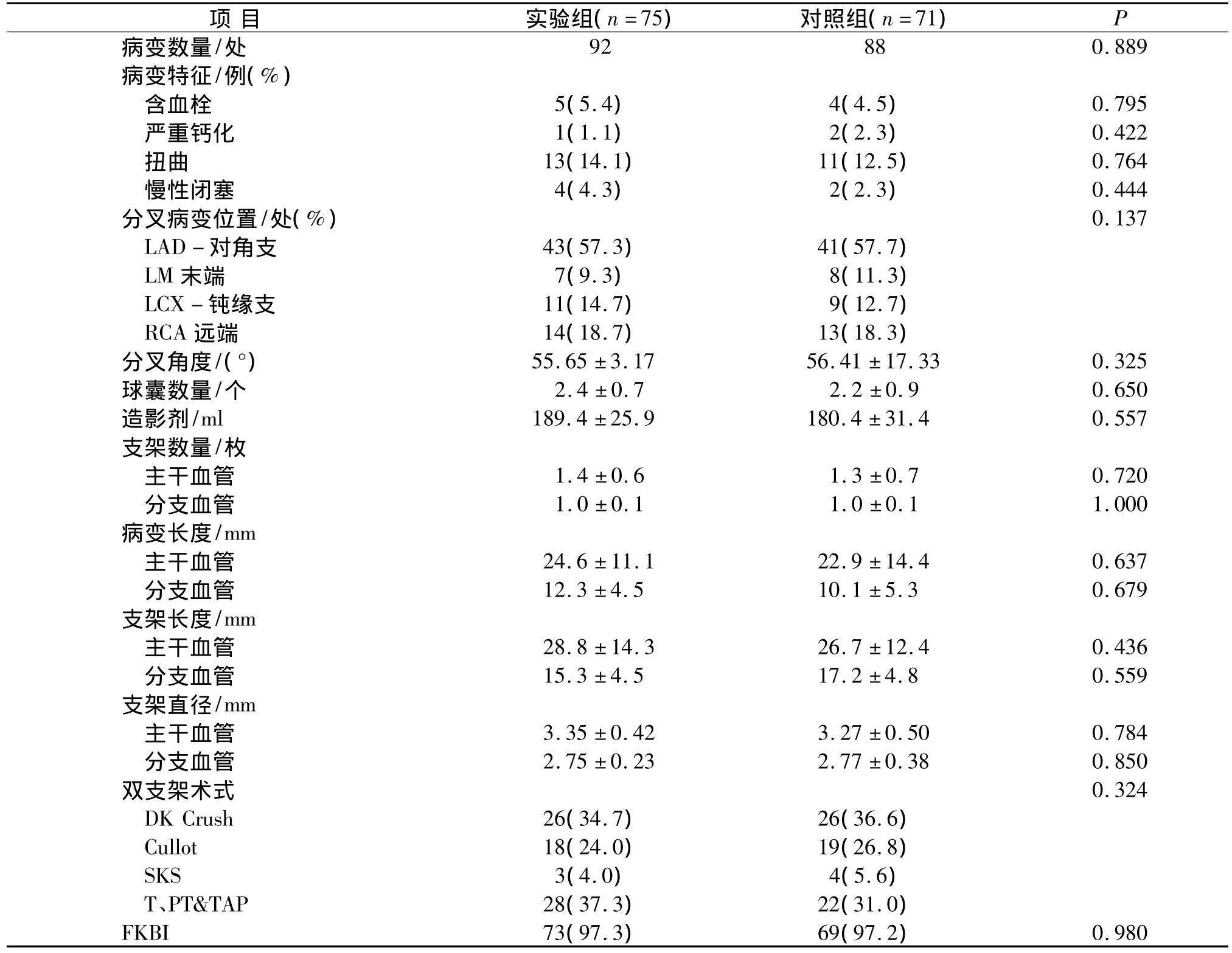
表2 两组患者冠脉病变特征及支架植入参数Tab 2 Characteristics of coronary artery lesions and parameters for stent implantation
2.2 近期随访结果 两组30 d主要和次要终点发生率均无统计学差异,但实验组主要终点发生率有降低趋势,实验组和对照组分别有4例(5.33%)和5 例(7.04%)发生主要终点事件(P=0.284),两组非致死性心梗[4(5.33%)vs 4(5.63%),P=0.892]、致死性心梗[0(0)vs 1(1.41%),P=0.654],TVR[2(2.67%)vs 3(4.23%),P=0.167]发生率均无显著差异。实验组支架内血栓栓塞显著低于对照组[0(0)vs 2(2.82%),P=0.049]。实验组与对照组30 d严重出血[1(1.33%)vs 0(0),P=0.345]及轻微出血事件发生率[1(1.33%)vs 1(1.41%),P=0.906]亦无统计学差异。
2.3 远期随访结果 全部患者随访12-24个月,平均(18.8±4.3)个月,6-12月进行冠脉造影复查106例,占72.6%;临床随访率100%。两组心梗[6(8.0%)vs 11(15.5%),P=0.045]及 TVR[5(6.67%)vs 9(12.68%),P=0.038]发生率亦有统计学差异。实验组支架内血栓栓塞显著低于对照组[1(1.33%)vs 3(4.23%),P=0.042]。实验组共7例(9.33%)患者发生主要终点事件,对照组为13例(18.31%),实验组主要终点事件绝对风险较对照组降低8.99%(P=0.037)。但两组全因病死率[1(1.33%)vs 2(2.82%),P=0.873]无统计学差异。Kaplan-Meier分析显示平均随访18个月时两组累计无事件生存率有统计学差异(Log rank,P=0.032 4),见图1。

图1 无事件生存率Kaplan-Meier曲线Fig 1 Kaplan-Meier curve for event-free survival
2.4 次要终点 平均(18.8±4.3)个月随访时,两组总的出血事件发生率无统计学差异。实验组与对照组严重出血事件发生率分别为1.33%和0(P=0.343),轻微出血发生率分别为 2.67% 和 2.82%(P=0.873)。因出血并发症需输血治疗者在实验组和对照组分别为 1例(1.33%)和0例(P=0.343)。两组患者未发生严重血小板减少症。
3 讨论
冠脉分叉病变是指冠脉主支、分支部位分别或同时存在严重狭窄的病变,主要包括前降支-对角支、回旋支-钝缘支、右冠状动脉远端分叉和左主干分叉病变,约占所有冠状动脉介入治疗的15% -16%[7]。目前分叉病变介入治疗是冠脉介入领域的一个难题,操作复杂、成功率较低,术中和术后主要心脏不良事件和靶病变血运重建率高,其机制与再狭窄和支架内血栓有关[1,2]。药物洗脱支架(DES)的应用,尽管使PCI的再狭窄率大幅度降低,但病理学证实动脉分叉部位是粥样硬化斑块、血栓和炎症易发部位[3],而且双DES时支架金属丝、多聚物涂层对局部的刺激、过敏和炎症反应[4,5],药物使内皮化过程延迟[5],再加之25% -40%患者存在氯吡格雷抵抗[8],都会使该部位血栓的发生率增加。有报道常规双联抗血小板药物治疗时分叉病变双 DES 时,支架内血栓的发生率达 2.6% -5%[9,10]。而研究发现支架内血栓形成后30 d的死亡率高达25% -40%[10],非致命心肌梗死的发生率则高达60% -70%[11],成为分叉病变双 DES治疗的难以避免的“灾难”。因此,非常必要探索应用高维持剂量氯吡格雷强化抗血小板治疗在分叉病变双DES治疗患者的有效性和安全性。
当前指南只是规定支架血栓高危患者(如无保护的左主干病变、左主干分叉病变、单支开放冠状动脉病变等)可给予强化的氯吡格雷治疗,若其血小板抑制水平低于50%,给予氯吡格雷150 mg的维持剂量[12]。近期一些研究结果表明,采用150 mg氯吡格雷维持量治疗1个月对血小板功能的抑制作用明显强于接受75 mg维持量治疗者[13]。本研究对分叉病变双DES患者采用随机对照方法对比150 mg与75 mg氯吡格雷维持量疗效和安全性的临床研究,平均18个月的随访结果表明支架内血栓发生率明显减少,其获益于强化抗血小板功能;虽然在近期MACE未见显著改变,但呈下降趋势,而对远期MACE显著降低,这种早期高维持剂量氯吡格雷的获益滞后现象,可能与氯吡格雷抑制炎症反应和平滑肌增生,从而在早期影响再狭窄发生的早期关键环节有关[14]。
此外,高维持剂量氯吡格雷在联合抗血小板治疗中发挥更强效抗栓作用的同时,出血并发症的发生有所增加。在出血的发生率方面,两组患者分别为3.0%和2.82%,除实验组1例出现消化道出血外均为轻微出血,高维持剂量氯吡格雷与标准化治疗在出血并发症发生率相近,初步证实了高维持剂量氯吡格雷的安全性。因此,从总体上来看高维持剂量氯吡格雷在临床上明显减少支架内血栓发生率,显著降低MACE发生,相当安全。
本研究结果提示,高维持量氯吡格雷治疗在分叉病双DES植入患者临床应用具有可行性,但其对简单病变PCI、低危患者是否有益还有待证实。本研究的局限性在于样本量不大,早期高维持量氯吡格雷治疗延迟获益的机制还有待进一步研究。
[1] Colombo A,Moses JW,Morice MC,et al.Randomized study to evaluate sirolimus-eluting stent implanted at coronary bifurcation lesions[J].Circulation,2004,109:1244 - 1249.
[2] Iakovou I,Ge L,Colombo A.Contemporary stent treatment of coronary bifurcations[J].J Am Coll Cardiol,2005,46:1446 -1455.
[3] Finn AV,Joner M,Nakazawa G,et al.Pathological Correlates of Late Drug-Eluting Stent Thrombosis.Strut Coverage as a Marker of Endothelialization[J].Circulation,2007,115(18):2435 -2441.
[4] Iakovou I,Schmidt T,Bonizzoni E,et al.Incidence,predictors,and outcome of thrombosis after successful implantation of drug-eluting stents[J].JAMA,2005,4:2126 -2130.
[5] Joner M,Finn AV,Farb A,et al.Pathology of drug-eluting stents in humans:delayed healing and late thrombotic risk[J].J Am Coll Cardiol,2006,48:203 -205.
[6] Lefevre T,Louvard Y,Morice MC,et al.Stenting of bifurcation lesions?:classification,treatments,and results[J].Catheter Cardiovasc Interv,2000,49:274 -283.
[7] Safian RD,Freed M.The manual of interventional cardiology[M].3rd ed.Birmingham,Michigan:Physician’s Press,2001:141-156.
[8] Mobley JE,Bresse SJ,Wortham DC,et al.Frequency of nonresponse antiplatelet activity of clopidogrel during pretreatment of cardiac catheterization[J].Am J Cardiol,2004,93:456 -458.
[9] Hoye A,Iakovou I,Ge L,et al.Long-term outcomes after stenting of bifurcation lesions with the“crush”technique:predictors of an adverse outcome[J].J Am Coll Cardiol,2006,47:1949 - 1958.
[10] Rodriguez AE,Mieres J,Fermandez-Pereira C,et al.Coronary stent thrombosis in the current drug-eluting stents versus era:insights from the ERACI Ⅲ trial[J].J Am Coll Cardiol,2006,47:205-207.
[11] Kuchulakanti PK,Chu WW,Torguson R,et al.Correlates and long-term outcomes of angiographically proven stent thrombosis with sirolimus-and paclitaxel-eluting stents[J].Circulation,2006,113(8):1108 -1113.
[12] Smith SC Jr,Feldman TE,Hirshfeld JW,et al.ACC/AHA/SCAl 2005 guideline update for percutaneous coronary intervention:a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines(ACC/AHA/SCAI Writing Committee to Update the 2001 Guidelines for Percutaneeus Coronary Intervention)[J].J Am Coil Cardiol,2006,47:El-121.
[13] Von Beckerath N,Kastrati A,Wieczorek A,et al.A double blind,randomized study on platelet aggregation in patients treated with a daily dose of 150 or 75 mg of clopidogrel for 30 days[J].Eur Heart J,2009,28:1814 -1819.
[14] Yip HK,Chang LT,Sun CK,et al.Impact of clopidogrel on suppression of circulating levels of soluble CD40 ligand in patients with unstable angina undergoing coronary stenting[J].Am J Cardiol,2006,97(2):192 - 194.

