外源NO对NaCl胁迫下燕麦幼苗抗氧化酶活性和生长的影响
芦 翔,石卫东,王宜伦,汪 强,谭金芳,韩燕来
(1.河南农业大学资源与环境学院,河南 郑州 450002;2.河南省科学院地理研究所,河南 郑州 450002)
土壤盐渍化是世界性的问题,据统计,全球大约有3.8亿hm2土地存在不同程度的盐渍化,约占可耕地面积的10%。中国目前有0.2亿hm2以上盐碱地和0.07亿hm2以上盐渍化土壤,约占可耕地面积的20%,严重影响了粮食产量,成为限制农业生产的主要因素[1-3]。
一氧化氮(NO)是生物体内的信号分子,有关NO对作物抗盐性的调节作用已在多种作物进行过研究。前人的相关研究表明,外源的NO可缓解小麦(Triticumaestivum)叶片和根尖细胞的氧化损伤[4];缓解水稻(Oryzasativa)在盐胁迫和高温胁迫下叶绿素的降解,维持光系统Ⅱ稳定性[5-6];缓解盐胁迫对玉米(Zeamays)生长的抑制作用[7];减轻盐胁迫对黄瓜(Cucumissativus)幼苗的伤害[8];提高番茄(Solanumlycopersicum)幼苗对光能利用效率,促进番茄的生长[9]。燕麦(Avenasativa)是一年生具有较高的营养价值的粮饲兼用型作物。与小麦相比,燕麦对盐碱土有更好的适应性,目前被广泛认为是盐碱地改良的替代作物之一[10]。虽然前人对NO已做较多的研究,但外源NO对盐胁迫下燕麦生长的调节效应及机理研究还鲜有报道。本研究利用耐盐能力不同的2个燕麦品种为材料,探讨外源NO对盐胁迫下燕麦幼苗抗氧化酶活性及生长的影响,以了解NO缓解燕麦盐胁迫的生理机制。
1 材料与方法
1.1供试材料 供试燕麦品种白燕6号(A.sativa‘BaiYan No.6’)和内散2号(A.sativa‘NeiSan No.2’)是吉林白城农业科学院、内蒙古农牧大学的原种,引进当地后在相同条件下经一年的繁殖后备用。
1.2植株培养 取籽粒饱满、大小一致的燕麦种子,用1%次氯酸钠消毒10 min后,再用无菌水冲洗净消毒液、然后将种子放入蒸馏水中通气吸涨4 h,均匀放入铺有一层吸水纸的培养皿中,25 ℃黑暗条件下催芽。催芽3 d后,挑选露白一致的种子,用Hongland营养液进行水培,于(25±1) ℃恒温室培养,每天光照12 h,光强72.7 μmol/(m2·s),至燕麦幼苗长至四叶一心时进行试验。
1.3试验方案 采用室内水培试验,设1个对照,3个处理:1)Hoagland(CK);2)Hoagland+0.06 mmol/L 硝普钠(SNP);3)Hoagland+150 mmol/L NaCl(NaCl);4)Hoagland+0.06 mmol/L SNP+150 mmol/L NaCl(NaCl+SNP)。重复4次。处理8 d后进行植株干质量、叶绿素含量和叶片质膜透性的测定;于处理后0、2、4、6、8 d,进行叶片抗氧化酶活性和丙二醛(MDA)含量测定。培养期间为保证各营养液浓度的相对稳定,每天更换一次营养液。
1.4测定项目与方法
1.4.1植株干质量测定 取出完整植株,用蒸馏水快速冲洗去地上部分表面的灰尘,用吸水纸吸干表面水分后将材料放入90 ℃的烘箱中杀青30 min后,65 ℃烘干至质量不变,称其干质量。
1.4.2叶片叶绿素含量和质膜透性的测定 叶绿素含量的测定参照Arnon[11]的方法。质膜透性的测定参考刘宁等[12]的方法 。
1.4.3叶片超氧化物歧化酶、过氧化物酶、过氧化氢酶、抗坏血酸过氧化物酶活性和丙二醛含量测定 叶片超氧化物歧化酶(SOD)活性按照Beauchamp和Fridovich[13]的方法测定。过氧化物酶(POD)活性测定采用愈创木酚法[14]。过氧化氢酶(CAT)活性测定参照Patterson等[15]的方法。抗坏血酸过氧化物酶(APX)活性测定参照Nakano和Asada[16]的方法,叶片中MDA含量参照许长成等[17]的方法。
1.4.4数据处理及统计分析 利用Excel 2003和DPS 2000对相关数据进行统计分析。
2 结果与分析
2.1外源NO对NaCl胁迫下燕麦幼苗干质量的影响 处理后8 d,与CK相比,NaCl处理白燕6号和内散2号干质量均显著下降(P<0.05),分别下降了26.8%和45.1%(图1),表明白燕6号的耐盐性相对较好,而内散2号的耐盐性相对较弱。
与CK相比,SNP处理对燕麦幼苗生长无显著影响(P>0.05)。与NaCl处理相比,NaCl+SNP处理均显著提高了白燕6号和内散2号干质量(P<0.05),2个燕麦品种分别提高了18.3%和48.7%,说明外源NO对盐胁迫下内散2号的幼苗干质量下降的缓解作用大于白燕6号。
2.2外源NO对盐胁迫下燕麦叶片丙二醛含量的影响 CK和SNP处理时,两燕麦品种叶片中MDA含量在8 d内保持相对稳定,而NaCl胁迫后,两燕麦品种MDA含量均迅速上升,胁迫期间内散2号叶片MDA含量比白燕6号MDA含量平均值高18.5%(图2),说明NaCl胁迫下内散2号质膜氧化损伤更重。
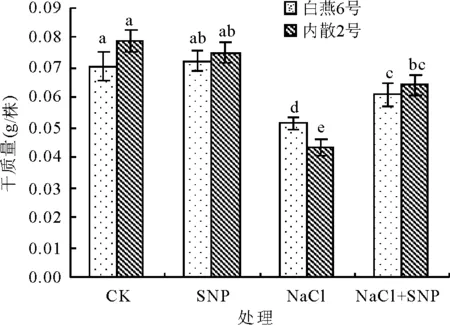
图1 外源NO对NaCl胁迫燕麦幼苗干质量的影响
与NaCl处理相比,NaCl+SNP处理显著降低了两燕麦品种叶片的MDA含量(P<0.05),特别是在处理后4和6 d,白燕6号和内散2号MDA含量均急剧下降。其中白燕6号叶片MDA含量在处理后2、4、6和8 d分别降低了14.4%、11.4%、19.1%和28.9%,平均为18.5%,内散2号叶片的MDA含量分别降低了24.9%、19.5%、23.6%和37.5%,平均为26.4%。
2.3外源NO对盐胁迫下燕麦幼苗叶片质膜透性的影响 叶片质膜透性用叶片相对电导率表示。处理后8 d,CK和SNP处理中2个燕麦品种叶片相对电导率均较低;与CK相比,NaCl处理植株叶片相对电导率显著增加(P<0.05),白燕6号和内散2号幼苗叶片相对电导率分别增加了286.2%和316.2%(图3),说明盐胁迫对内散2号的伤害更大。
与NaCl处理相比,NaCl+SNP处理燕麦幼苗叶片的相对电导率显著降低(P<0.05),其中白燕6号和内散2号的叶片的相对电导率分别降低了33.1%和34.6%。说明在盐胁迫下,外源NO能够保护叶片细胞膜结构的完整性,从而使叶片质膜透性保持在相对较低的水平。
2.4外源NO对盐胁迫下燕麦幼苗叶绿素含量的影响 处理后8 d,CK和SNP处理之间燕麦幼苗叶片叶绿素含量差异不显著(P>0.05);与CK相比,NaCl处理白燕6号和内散2号幼苗叶片叶绿素含量均显著下降(P<0.05),分别下降了62.7%和72.3%(图4),说明内散2号受NaCl胁迫影响较为严重。
与NaCl处理相比,NaCl+SNP处理能显著提高燕麦幼苗叶片叶绿素含量(P<0.05),白燕6号和内散2号叶绿素含量分别提高了71.9%和97.7%,表明外源NO对盐胁迫下燕麦叶片叶绿素含量的下降有显著的缓解作用。

图2 外源NO对NaCl胁迫燕麦幼苗叶片丙二醛含量的影响

图3 外源NO对NaCl胁迫燕麦幼苗叶片相对电导率的影响

图4 外源NO对NaCl胁迫燕麦幼苗叶片叶绿素含量的影响
2.5外源NO对盐胁迫下燕麦幼苗叶片抗氧化酶活性的影响
2.5.1外源NO对盐胁迫下燕麦幼苗叶片SOD活性的影响 CK和SNP处理,两燕麦品种叶片SOD活性在8 d内变化均相对较小,且同一燕麦品种两处理之间差异不显著(P>0.05)。NaCl处理使两燕麦品种叶片的SOD活性在短时间内均显著升高,并在处理后2 d达到最高水平,之后迅速下降,但胁迫8 d时,白燕6号叶片SOD活性仍大于对照处理,而内散2号叶片SOD活性已低于对照(图5)。
与NaCl处理相比,NaCl+SNP处理明显提高了两燕麦品种叶片的SOD活性,其中白燕6号叶片SOD活性在处理后2、4、6和8 d分别提高了12.6%、11.5%、16.3%和20.4%,平均为15.2%,内散2号叶片的SOD活性分别提高了8.5%、21.8%、9.6%、48.3%,平均为22.0%。
2.5.2外源NO对盐胁迫下燕麦幼苗叶片CAT活性的影响 CK和SNP处理,两燕麦品种叶片CAT活性在8 d内变化不大,且同一品种两处理之间差异不显著(P>0.05)。与CK相比,NaCl处理迅速降低了两燕麦品种叶片CAT活性,且随着盐胁迫时间的推移,两燕麦品种叶片CAT活性均持续下降,在胁迫8 d时,白燕6号和内散2号燕麦叶片CAT活性分别下降了48.4%和58.7%(图6)。

图5 外源NO对NaCl胁迫下燕麦幼苗叶片SOD酶活性的影响

图6 外源NO对NaCl胁迫燕麦幼苗叶片CAT酶活性的影响
与NaCl处理相比,NaCl+SNP处理显著提高了两燕麦品种叶片CAT活性(P<0.05),其中白燕6号叶片CAT活性在处理后2、4、6和8 d分别提高了19.0%、36.6%、32.2%和28.8%,平均为29.1%,内散2号叶片的CAT活性分别提高了29.2%、40.4%、32.1%和48.5%,平均为37.6%,但均低于CK和SNP处理。
2.5.3外源NO对盐胁迫下燕麦幼苗叶片POD活性的影响 处理后8 d内,CK和SNP处理两燕麦品种叶片POD活性随时间推移均呈缓慢增加趋势,处理之间差异不显著(P>0.05)。与CK相比,NaCl处理后2 d时两燕麦品种叶片的POD活性即显著升高(P<0.05),此后随时间的推移缓慢增加(图7)。
与NaCl处理相比,NaCl+SNP的处理两燕麦品种叶片的POD活性均进一步增加,其中白燕6号叶片POD活性在处理后2、4、6和8 d分别提高了8.6 %、9.5%、8.1%和5.0%,平均为7.8%;内散2号叶片的POD活性分别提高了2.4%、9.9%、7.8%和13.4%,平均为8.4%。与SNP对SOD活性、CAT活性的提高作用相比,SNP对POD活性的影响相对较小。
2.5.4外源NO对盐胁迫下燕麦幼苗叶片APX活性的影响 盐胁迫2 d时,白燕6号的叶片APX活性即比CK显著增高(P<0.05),但此后增加趋势渐缓,而内散2号在0~6 d呈缓慢增加趋势,此后变化不大(图8)。
与NaCl处理相比,NaCl+SNP的处理显著提高了白燕6号和内散2号的叶片APX活性(P<0.05),并随时间的延长提高作用趋于增强。其中白燕6号叶片APX活性在处理后2、4、6和8 d分别提高了8.6%、16.5%、8.6%和16.3%,平均为12.5%,内散2号叶片的APX活性分别提高了52.0%、38.2%、34.3%和73.3%,平均为49.5%。
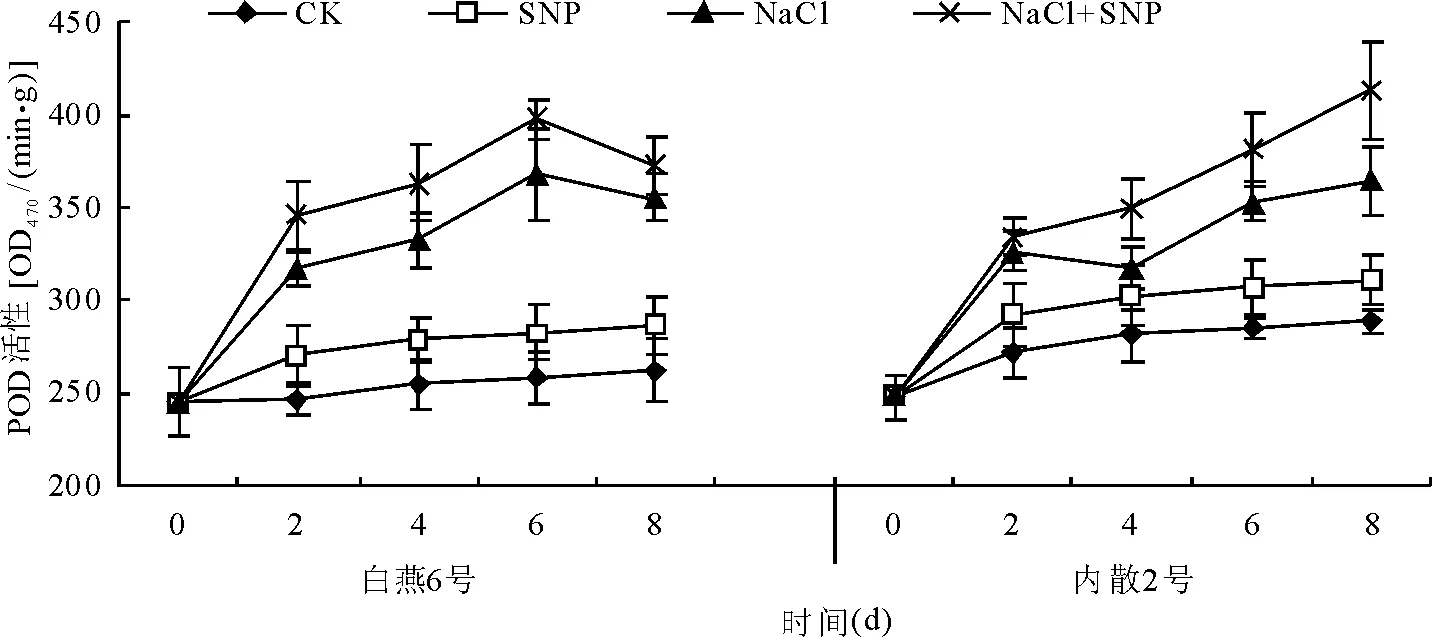
图7 外源NO对盐胁迫燕麦幼苗叶片POD活性的影响

图8 外源NO对盐胁迫燕麦幼苗叶片APX活性的影响
3 讨论与结论
3.1盐胁迫对燕麦生长的影响 盐胁迫对非盐生植物生长抑制是盐胁迫产生的普遍结果,然而由于盐分胁迫反应的复杂性,其机理并不清楚。本研究中观察到盐分胁迫引起了叶绿素含量和干物质积累的下降,对此一般认为是,植物体内叶绿素酶可引起叶绿素的降解,而盐分胁迫能增强叶绿素酶的活性,加速叶绿素分解[18];同时叶绿素是植物进行光合作用的重要物质基础,盐分胁迫可促进叶绿素的分解,进而影响到植株的光合作用及自身生长。近年来,人们又从自由基伤害学说观点来解释逆境对植物生长的影响,指出在盐分胁迫条件下,需氧植物体内活性氧代谢系统失去平衡,自由基增加,细胞内不饱和脂肪酸在生物自由基的作用下易诱发膜脂过氧化,从而使膜的透性增加,离子外渗,引起植物代谢紊乱,生长受阻[19]。质膜相对透性的大小是膜伤害的重要标志,丙二醛则是脂质过氧化的主要产物之一[20]。本研究表明,燕麦幼苗叶片丙二醛含量随着NaCl胁迫时间的推移显著增加,同时在胁迫后8 d叶片细胞质膜相对透性与对照相比显著增加。因此,结合盐胁迫下氧自由基伤害学说可以认为,NaCl胁迫可能由于促进了活性氧的积累,造成了燕麦叶片的细胞膜损伤,同时也影响到叶绿素稳定性并最终影响到植物光合作物和植株生长。此外,与多数试验观察到的丙二醛含量随盐胁迫时间延长而持续增加不同,本研究发现,随着盐胁迫时间的延长,白燕6号在盐胁迫4 d后,内散2号在盐胁迫6 d后,丙二醛含量上升趋势变缓,说明盐胁迫引起的燕麦膜伤害反应可在一定时段保持相对稳定性,使膜系统结构和功能维持某种程度的平衡,从而使叶片细胞仍能维持一定的生理功能,这一结果也可能与燕麦本身有一定的抗盐能力有关。
3.2抗氧化酶在燕麦适应盐胁迫反应的作用 植物体内超氧化物歧化酶、过氧化氢酶、过氧化物酶和抗坏血酸过氧化物酶等抗氧化酶类是植物体内重要的活性氧清除剂,在一定范围内能有效地清除活性氧,维持活性氧的代谢平衡、保护膜结构,从而使植物在一定程度上忍耐、减缓或抵御逆境胁迫伤害[21]。盐胁迫下植物的抗氧化酶活性通常会表现显著的变化,但由于不同研究者使用的研究手段、供试作物品种、胁迫强度、胁迫时间的不同而得到不尽相同的结论。陈明等[4]研究表明,盐胁迫下小麦幼苗根尖细胞中超氧化物歧化酶、过氧化物酶和抗坏血酸过氧化物酶 3种活性氧清除酶活性在盐胁迫初期均呈上升趋势,并随着胁迫时间的延长又转为下降;苏桐等[22]研究表明,盐胁迫下燕麦体内超氧化物歧化酶和过氧化物酶酶活性随时间的延长先上升后下降,而过氧化氢酶酶活性则呈下降趋势。本研究表明,NaCl处理后,超氧化物歧化酶、过氧化物酶、抗坏血酸过氧化物酶和过氧化氢酶酶活性随时间推移变化不同。其中超氧化物歧化酶酶活性随NaCl胁迫时间推移表现为快速上升后快速下降的特点,过氧化物酶和抗坏血酸过氧化物酶基本上呈持续上升的趋势,而过氧化氢酶则表现持续下降,这一结果也与苏桐等[22]的结果相似,说明燕麦在受盐胁迫时,超氧化物歧化酶可能主要在胁迫的最初阶段的氧自由基的清除中起作用,过氧化物酶和抗坏血酸过氧化物酶可在较长阶段持续起作用,而过氧化氢酶酶活性可能由于对盐胁迫较为敏感,受到胁迫后立即下降,清除氧自由基的作用相对较小。
3.3NO对盐胁迫下燕麦耐盐生理反应的调节 NO是植物体中广泛存在的一种正常代谢物或副产物,也是一种重要的信号分子,NO重要的生理作用即是参与氧自由基代谢的调控[23]。本研究表明,盐胁迫时加入硝普钠的处理,耐盐性不同的两燕麦品种叶片超氧化物歧化酶、过氧化氢酶、过氧化物酶、抗坏血酸过氧化物酶活性均有明显增加,说明不论对耐盐性高的品种或是耐盐性差的品种,硝普钠均可提高盐胁迫下植株氧自由基清除系统的活性。同时还观察到,盐胁迫时加入硝普钠的处理在提高抗氧化酶活性的同时可显著降低燕麦叶片丙二醛含量和叶片质膜相对透性,由于丙二醛是膜脂过氧化产物,叶片质膜相对透性是质膜受伤害的重要标志,因此可以推测,硝普钠很可能也是由于提高了NaCl胁迫下燕麦抗氧化酶活性,减少了活性氧的产生,从而有助于缓解NaCl胁迫对燕麦幼苗的氧化伤害作用。此外,硝普钠的加入在降低盐胁迫下叶片丙二醛含量的同时,亦增加了叶绿素含量和干物质积累,尽管有人认为,NO提高叶绿素的含量的具体原因有可能是因为激活了叶绿素生物合成过程中的某些酶类,但本研究中NO在提高了抗氧化酶活性和降低叶片丙二醛含量的同时,亦增加了叶绿素含量和干物质积累,所以也不能排除NO可直接通过降低活性氧的积累而减少叶绿素的分解从而增加干物质积累的可能。本研究还表明,盐胁迫时加入硝普钠对不同抗氧化酶活性影响不同,其中对超氧化物歧化酶、过氧化氢酶和抗坏血酸过氧化物酶活性影响较大,而对过氧化物酶活性影响相对较小,说明NO对不同抗氧化酶的调节作用是不同的,具体原因有待进一步研究。
[1]解松峰,Kansaye A,杜向红,等.30份引进大麦品种(系)苗期耐盐性综合分析[J].草业科学,2010,27(4):127-133.
[2]芦翔,汪强,韩燕来,等.盐胁迫对不同燕麦品种种子萌发和出苗影响的研究[J].草业科学,2009,26(7):77-81.
[3]Zhu J K.Plant salt tolerance[J].Trends in Plant Science,2001,6:66-71.
[4]陈明,沈文彪,阮海华,等.一氧化氮对盐胁迫下小麦幼苗根生长和氧化损伤的影响[J].植物生理与分子生物学报,2004,30(5):569-576.
[5]Uchida A,Andre T J,Takashi H.Effects of hydrogen peroxide and nitric oxide on both salt and heat stress tolerance in rice[J].Plant Science,2002,163(3):515-523.
[6]肖强,陈娟,吴飞华,等.外源NO供体硝普钠(SNP)对盐胁迫下水稻幼苗中叶绿素和游离脯氨酸含量以及抗氧化酶的影响[J].作物学报,2008,34(10):1849-1853.
[7]张艳艳,刘俊,刘友良.一氧化氮缓解盐胁迫对玉米生长的抑制作用[J].植物生理与分子生物学学报,2004,30(4):455-459.
[8]樊怀福,郭世荣,焦彦生,等.外源一氧化氮对NaCl胁迫下黄瓜幼苗生长、活性氧代谢和光合特性的影响[J].生态学报,2007,27(2):546-553.
[9]吴雪霞,朱月林,朱为民,等.外源一氧化氮对NaCl胁迫下番茄幼苗光合作用和离子含量的影响[J].植物营养与肥料学报,2007,13(4):658- 663.
[10]王波,宋凤斌.燕麦对盐碱胁迫的反应和适应性[J].生态环境,2006,15(3):625.
[11]Arnon D I.Copper enzymes in isolated chloroplasts:Polyphenol oxidase inBetavulgari[J].Plant Phsiology,1949,24:1-15.
[12]刘宁,高玉葆,贾彩霞.渗透胁迫下多花黑麦草叶内过氧化物酶活性和脯氨酸含量以及质膜相对透性的变化[J].植物生理学通讯,2000,(36):11-14.
[13]Beauchamp C,Fridovich I.Superoxide dismutase,improved assays and an assay applicable to acrylamide gels[J].Analytical Chemistry,1971(44):276-287.
[14]陈建勋,王晓峰.植物生理学实验指导[M].广州: 华南理工大学出版社,2002: 120-122.
[15]Patterson B D,Payne L A,Chen Y,etal.An inhibitor ofcatalase induced by cold chilling-sensitive plants[J].Plant Physioloy,1984(76):1014-1018.
[16]Nakano Y,Asada K.Hydrogen peroxide is scavenged by ascorbate-specific peroxidase in spinach chloroplasts[J].Plant and Cell Physiology,1981(22):867-880.
[17]许长成,赵世杰,邹琦.植物膜脂过氧化水平硫代巴比妥酸测定方法中的干扰因素[J].植物生理学通讯,1993(29):361-363.
[18]吴雪霞,朱为民,朱月林,等.外源一氧化氮对NaCl胁迫下番茄幼苗光合特性的影响[J].植物营养与肥料学报,2007,13(6):1105-1109.
[19]Zhu J K.Salt and drought stress signal transduction in plants[J].Annual Review of Plant Biology,2002,53:247-273.
[20]孙存华,李扬,贺鸿雁,等.藜对干旱胁迫的生理生化反应[J].生态学报,2005,25(10):2556-2560.
[21]Hang Y C,Chen Q,Liu Q,etal.Exogenous silicon(Si)increases antioxidant enzyme activity and reduces lipid peroxidation in roots of salt-stressed barley(Hordeumvulgare)[J].Jouranls of Plant Physiology,2003,160:1157-1164.
[22]苏桐,龙瑞军,魏小红,等.外源NO对NaCl胁迫下燕麦幼苗氧化损伤的保护作用[J].草业学报,2008,17(5):48-53.
[23]阮海华,沈文彪,叶茂炳,等.一氧化氮对盐胁迫下小麦叶片氧化损伤的保护效应[J].科学通报,2001,46(23):1993-1997.

