野菊幼苗对自然干旱胁迫的生理响应
何 淼,李文鹤,卓丽环,2
(1.东北林业大学,黑龙江 哈尔滨 150040;2.上海农林职业技术学院,上海 201600)
野菊花(Dendranthemaindicum)为菊科菊属多年生草本植物,高0.25~1.00 m,有地下长或短匍匐茎。茎直立或铺散,分枝或仅在茎顶有伞房状花序分枝。茎枝被稀疏的毛,上部及花序枝上的毛稍多或较多[1]。野生于山坡草地、河边湿地、滨海盐渍地及路旁,广布于中国东南部各地。随着城镇绿地生态环境建设的快速发展,绿地面积和灌溉用地不断增加,加剧了水资源匮乏地区与农、林、工业等的竞争用水,使水资源匮乏与人类需水量增加的矛盾越来越严重。因此,筛选具有良好观赏性状和抗旱性的绿化地被种类,应用于城市绿化建设,对于节约淡水资源、促进经济发展有重要意义[2]。
研究植物在干旱条件下的生长、生理反应及其抗旱的生理机制显得尤为重要。迄今为止,已经有许多关于植物抗旱生理方面的研究[3-9],冯佰利等[10]发现小麦(Triticumaestivum)开花后的叶片可溶性蛋白含量会下降,但不同品种叶片之间可溶性蛋白存在明显差别。王启明[11]、沈秀瑛等[12]做的许多研究已证实过氧化物酶(POD)的活性能反映植物的生长发育特点及体内代谢状况,可以作为植物生长和分化过程的一个指标,但有关干旱胁迫下野菊的生理适应性的研究鲜见报道。因此,本研究以辽宁本溪采得的野菊种子为材料,对其幼苗进行干旱胁迫,探讨干旱胁迫过程中各项生理指标的变化,分析其生理响应机制,以期为野菊的养护管理、抗旱新品种的选育提供理论依据。
1 材料与方法
1.1试验材料 试验用野菊种子于2009年11月采自辽宁省本溪市,经精选后的种子保存于4 ℃冰箱中。2010年6月在东北林业大学温室进行播种育苗,2010年8月移至园林学院实验室。
1.2试验方法 用规格一致的塑料花盆装入栽培基质(由4∶1∶1的粘土、珍珠岩、蛭石构成)。试验设3个处理组:Ⅰ组为对照组,正常浇水保证植株正常生长;Ⅱ组为复水组,进行干旱胁迫10 d后开始正常浇水;Ⅲ组为干旱组,从7月3日开始干旱胁迫,胁迫20 d后,干旱组的幼苗出现重度萎蔫,失去观赏价值,此时试验结束。每个处理3个重复,每个重复选30株大小均匀一致的植株。干旱胁迫分4个阶段,设停水5、10、15、20 d胁迫处理。在处理5、10、15、20 d后分别测定各个处理的植株生理指标。
1.3测定方法 可溶性糖含量测定用蒽酮比色法;可溶性蛋白测定用考马斯亮蓝G-250染色法;丙二醛(MDA) 测定用硫代巴比妥酸显色法;细胞质膜透性测定采用电导仪法;超氧化物歧化酶(SOD)活性测定采用氮蓝四唑(NBT)法;POD活性测定采用愈创木酚法;过氧化氢酶(CAT)测定采用高锰酸钾滴定法[13]。所有成分的含量均以干质量为基础进行计算。
1.4数据处理 对所有数据进行方差分析,处理间的差异显著性用多重比较(LSD)检验。整个计算过程在SPSS 13.0和Excel 2003软件系统下完成。
2 结果
2.1干旱胁迫下可溶性糖的变化 随着植物生长量的增加,对照组在试验的20 d内,可溶性糖的含量呈平稳的增长趋势(图1)。胁迫10 d时,复水组与干旱组野菊幼苗叶片的可溶糖含量急剧增加,与对照呈极显著差异(P<0.01)。随着时间的增加,两处理组的可溶性糖含量均呈递减的趋势,但是复水组下降的速度更快。15 d时,3组之间的可溶性糖含量呈显著差异(P<0.05),其中干旱组含量最高,为0.039 5 mg/g,对照组含量为0.034 5 mg/g,复水组含量最低,为0.026 9 mg/g。到胁迫20 d时,复水组的可溶性糖的含量升高,其含量与对照接近,说明可溶性糖对于野菊外界环境变化比较敏感。干旱组的可溶性糖含量一直呈下降趋势,胁迫20 d时,极显著低于对照组和复水组(图1)。

图1 干旱胁迫对野菊幼苗叶片可溶性糖含量的影响
2.2干旱胁迫下可溶性蛋白的变化 随着时间的增加,对照组野菊幼苗叶片的可溶性蛋白基本保持不变(图2)。但是前10 d内,复水与干旱组的可溶蛋白含量变化呈均匀下降的趋势,其含量均极显著低于对照组(P<0.01)。10 d后开始复水,复水组的可溶性蛋白含量缓慢恢复,直到试验结束,仍然极显著低于对照组。干旱组可溶性蛋白含量在10 d后开始迅速增加,15 d时仍显著低于对照(P<0.05),到20 d时与对照组间无显著差异(P>0.05)(图2)。

图2 干旱胁迫对野菊幼苗叶片可溶性蛋白含量的影响
2.3干旱胁迫下相对电导率和丙二醛的变化 对照组的电导率在试验期间基本保持不变,复水组与干旱组的变化前10 d基本一致呈上升趋势,前5 d两处理组均显著高于对照组(P<0.05),到胁迫10 d时差异达极显著(P<0.01)(图3)。从胁迫10 d开始,复水组的相对电导率开始下降,与对照接近,干旱组则急剧增高,到胁迫20 d时已经约为74.6%,极显著高于对照组和复水组(图3)。说明可能在干旱胁迫10 d开始,原生质膜透性变化较大,造成细胞内离子大量外渗,相对电导率剧增。

图3 干旱胁迫对野菊幼苗叶片相对电导率的影响
不同的处理方法,野菊体内产生MDA含量相差很大。随着时间的增加,对照组MDA的含量呈不明显的上升趋势(图4)。处理的前5 d,复水组与干旱组处理的MDA变化一致,与对照无显著差异(P>0.05)。10 d时在复水组复水之前与干旱组MDA的变化仍然一致,呈上升趋势,且极显著高于对照组(P<0.01)。15 d时复水组的MDA含量下降为稍低于对照组,且与对照之间无显著差异;干旱组的幼苗叶片中MDA的含量开始急剧上升,是对照的6倍左右(图4)。

图4 干旱胁迫对野菊幼苗叶片MDA含量的影响
2.4干旱胁迫下保护酶的响应 随着干旱胁迫时间及植物生长量的增加,对照组的野菊叶片SOD活性呈现缓慢的增长趋势,复水组和干旱组的SOD活性呈先增加后降低再增加的趋势(图5)。在干旱胁迫的前5 d,SOD活性先升高是因为植物在遭遇逆境时随着超氧自由基的增加进行的一种保护性应激反应。到干旱胁迫10 d时,SOD活性又降低并极显著低于对照组(P<0.01)。表明这个时候干旱胁迫加剧,超氧自由基的产生速率超过了机体自身的清除能力,表现出SOD活性降低。在胁迫15 d时,复水组与干旱组的SOD活性增加,两者都高于对照,且3组之间呈极显著差异,其中复水组最大。到胁迫20 d时,复水组与干旱组的SOD活性仍然呈稳步的增高,但复水组增长趋势要低于干旱组。这种变化可能是在经历了前段时间的干旱胁迫后,植物已经产生了对此的适应能力,从而表现出较强的抗旱能力。

图5 干旱胁迫对野菊幼苗叶片SOD酶活性的影响

图6 干旱胁迫对野菊幼苗叶片POD酶活性的影响
对照组野菊幼苗叶片的POD活性在试验期间活性比较稳定,复水组与干旱组的POD活性的变化趋势与SOD相同。随着胁迫时间的增长,对照组的CAT活性呈稳步上升的趋势,复水组与对照组的CAT活性变化则与SOD和POD相同,呈先升高再降低再升高的趋势(图7)。干旱胁迫5 d时,复水组与干旱组的CAT活性达最高值,且极显著高于对照组(P<0.01)。胁迫10 d时,复水组与干旱组的CAT活性下降,并极显著低于对照组。复水之后,复水组的野菊幼苗叶片CAT活性含量开始稳步上升,到胁迫20 d时CAT活性开始恢复,但仍然极显著低于对照组。干旱组在胁迫10 d后仍然呈下降趋势,但是下降趋势有所减缓,到胁迫15 d时CAT的活性开始升高,直到胁迫20 d时,其活性与对照无显著差异。这可能是因为植物逐渐对干旱产生了适应性有关。
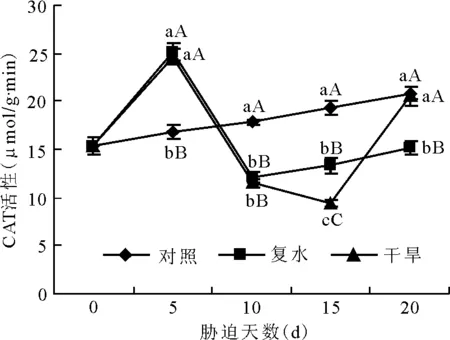
图7 干旱胁迫对野菊幼苗叶片CAT酶活性的影响
3 讨论与结论
当植物遇到干旱胁迫时,便会在体内积累低分子量的代谢物,使细胞能够维持较高的细胞质渗透压,有利于植物在干旱条件下吸收水分,植物的这种调节被称为渗透调节。参加植物的渗透调节物质环境中的无机离子和小分子的代谢物,包括脯氨酸、甜菜碱、可溶性糖、可溶性蛋白等。可溶性糖的增加能提高细胞原生质浓度、细胞膜的稳定性和植株的保水性,从而增强抗旱能力。同时植物在逆境条件下,体细胞内的活性氧不断积累加速膜脂过氧化的反应,会有丙二醛等对膜脂和细胞中许多生物功能分子有害的物质积累,降低膜的稳定性,破坏膜的功能,所以其含量的变化可以反映出细胞膜的受损程度[14]。植物的细胞膜具有选择透过性,起到保护细胞内物质不会大量外泄的作用。当植物遇到干旱等胁迫时,原生质膜的结构和功能就会发生明显变化或是遭到破坏,细胞内含物质就会大量外渗,导致植物电导率增大。相对电导率可以反映出植物细胞膜透性。在本研究中,随着干旱时间的延长,相对电导率的增大,野菊幼苗的渗透调节物可溶性蛋白含量在前期一直低于对照,可能逆境条件阻碍了可溶蛋白质的正常合成。后期开始上升向对照靠近,可溶性糖与之相反,处理前期急剧上升后期开始下降。整体上可溶性糖与可溶性蛋白变化趋势相反,这说明了渗透调节物质在应激干旱胁迫时所起作用和调节机制存在一定的差异性,其原因还有待于进一步研究。一般来说,抗旱性强的植物丙二醛含量增长慢[15]。本研究发现,干旱胁迫中野菊幼苗的丙二醛含量与电导率的变化趋势整体上相同。说明干旱胁迫会加剧丙二醛等对细胞膜有害物质的积累,对膜造成损害。干旱胁迫10 d后野菊幼苗的渗透调节发生转折。在这一时间对幼苗进行复水,所测指标并没有明显的回归,其中可溶性糖与丙二醛的含量降低到对照之下。出现以上结果,可能是因为野菊正处于生理恢复时期,又没有外界产生的抗逆的适合条件,所以有些指标反而过低,但是植物仍可自行修复。当到胁迫20 d时,细胞膜的功能已经遭到抑制或是破坏。丙二醛的增加说明膜脂过氧化的反应加剧,而且可溶性糖和可溶性蛋白的含量下降,都反映了这时野菊幼苗的整体上的衰败。
由于本研究所用的野菊是幼年期容器苗,所以耐旱程度不如露地苗,但本研究结果表明,适度干旱环境下野菊幼苗的生长良好,说明野菊耐旱性较好,是园林景观应用中地被材料的良选。
[1]中国科学院中国植物志编辑委员会.中国植物志[M].北京:科学出版社,1983:32-33.
[2]韩玉林,黄苏珍,孙桂弟.5种鸢尾属观赏地被植物的抗旱性研究[J].江苏农业科学,2007(2):79-82.
[3]马小卫.长柄扁桃抗旱机制研究[D].杨凌:西北农林科技大学,2006.
[4]祁娟,徐柱,王海清,等.旱作条件下披碱草属植物叶的生理生化特征分析[J].草业学报,2009,18(1):39-45.
[5]霍学敏,呼天明,杨培志,等.干旱胁迫对苗期紫花苜蓿3种生理指标的影响[J].草业科学,2010,27(4):89-92.
[6]唐红,孙吉雄,李福源,等.干旱胁迫对青海游憩草地质量的影响[J].草业科学,2009,26(6):159-165.
[7]Pavet V,Olmos E,Kiddle G,etal.Ascorbic acid deficiency activates cell death and disease resistance responses in Arabidopsis[J].Plant Physiology,2005,139:1291-1303.
[8]李树华,许兴,米海莉,等.水分胁迫对牛心朴子植物生长及渗透调节物质积累的影响[J].西北植物学报,2003,23(4):592-596.
[9]Wang S M,Wan C G,Wang Y R.The characteristics of Na+,K+and free praline distribution in several drought resistant plants of the Alxa Desert,China[J].Journal of Arid Environments,2004,56:525-539.
[10]冯佰利,赵琳,高小丽,等.干旱条件下冷型小麦的生理特性分析[J]. 西北农林科技大学学报(自然科学版),2005,33(3):38-42.
[11]王启明.干旱胁迫对大豆苗期叶片保护酶活性和膜脂过氧化作用的影响[J].农业环境科学学报,2006,25(4):918-921.
[12]沈秀瑛,徐卉昌,戴俊英.干旱对玉米叶SOD、CAT及酸性磷酸脂酶活性的影响[J].干旱地区农业研究,2005,23(1):56-60.
[13]李合生,孙群,赵世杰,等.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000:164-261.
[14]姜英淑,陈书明,王秋玉,等.干旱胁迫对2个欧李种源生理特征的影响[J].林业科学,2009,45(6):6-10.
[15]王传印,姜涛,张娜,等.水分胁迫下柳树的生理生化反应[J].山东林业科技,2006(5):28-29.
[16]孙存普,张建中,段绍瑾.自由基生物学导论[M].合肥:中国科学技术出版社,1999:66.
[17]袁晓晶.六个品种菊花的抗旱性研究[D].郑州:河南农业大学,2009:31-45.

