辉钼矿生物浸出研究进展
黄明清,王贻明,杨保华,2,王洪江,吴爱祥
(1.北京科技大学,北京100083)
(2.湖南涉外经济学院,湖南长沙410205)
0 引言
作为一种难熔金属,钼具有耐高温、不易膨胀和软化、导热性好等优点,广泛应用于钢铁、超合金和不锈钢生产中,以增加它们的硬度、强度、韧性及抗磨抗腐蚀性能。鉴于钼的优良性能,近年来国内外对钼的需求量和消费量一直保持在一个较高的水平(图1)。世界上的钼主要是作为铜矿的副产品而开采的,钼矿选冶大多通过传统的火法冶金实现[1~2]。然而,一方面,钼矿在火法冶炼中容易产生大量的二氧化硫、含砷蒸气等毒害物质,对环境造成了污染;另一方面,尽管我国钼矿储量大、类型多,但品位较低,选冶较困难,因而寻找一种高效的选冶方法显得越来越迫切[3]。
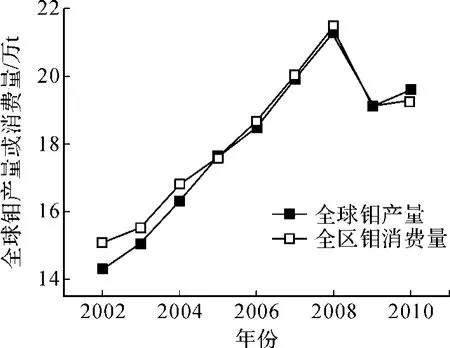
图1 2002年至2010年全球钼产量及消费量
生物浸矿以其低污染、低运营成本、工艺简单等优点而受到越来越多的关注,被认为是一种极具前途的冶金技术[4]。目前,生物浸矿已在铜、金、铅、锌、锡、锑、铀等矿中的难熔矿石、低品位矿石、表外矿处理上得到广泛应用,但成功的钼矿生物浸出工业实践却很少见于文献。钼矿生物浸出率不高的关键问题是钼矿属于酸难溶性矿石,菌种对钼离子的金属抗性较差,浸出体系氧化还原电位值较低,而且浸出金属离子容易发生沉淀。为解决这些问题,国内外学者进行了很多相关研究。1957年L.Bryner等人首次提出细菌可用于浸出钼矿;1973年,C.L.Brierley等人发现的一株极端嗜热菌比嗜中温细菌更能耐受钼离子浓度,在60℃时该菌浸出钼精矿的浸出率为3.3%~13.3%;2008年,G.J.Olson等人研究了嗜中温细菌Acidthinobacillus ferrooxidans(简称At.f)和中度嗜热细菌Leptospirillum浸出辉钼矿的影响因素和动力学,结果表明,最佳条件下钼矿最高浸出率可达85%;2009年,Kummer等人利用一株嗜中温铁氧化细菌浸出辉钼矿精矿,在25~40℃时得到最高的钼浸出率为89%;2010年,瑞典的Aura公司完成含钼、镍、钒和锌的铀矿生物浸出工业试验,结果表明,钼等金属的浸出率相对硫酸浸出有很大的提高[5~9]。
以上研究表明,生物浸出钼矿尤其是辉钼矿在技术上是可行的。针对前所提及的关键问题,本文首先将从矿物学角度分析钼矿的可浸性,探讨主要浸钼菌种和生物浸出的作用机理;其次,分析钼离子对菌种生长的影响及浸出过程中反应产物对浸出的抑制作用;再次,从基因改良、多级生物反应器浸出和溶液电位调控技术等角度对辉钼矿生物高效浸出作合理的展望,以期对钼矿生物浸出提供理论支持。
1 钼矿的生物浸出
1.1 钼矿可浸性
钼矿主要产于斑岩型矿床、矽卡型矿床、斑岩-矽卡型矿床、脉型矿床和沉积型矿床,矿物主要有辉钼矿(MoS2)、钼铅矿(PbMoO4)和钼钨钙矿(CaMoO4),其中辉钼矿是分布最广泛的矿物,目前国内外研究大多是针对辉钼矿精矿展开的。辉钼矿由二硫化钼组成,常见六方或三方晶形结构,呈页片状、鳞片状或细小分散粒状。辉钼矿的价带是由钼金属离子轨道产生的,需要经过6个连续的传递电子量为1的氧化步骤才能破坏矿石中硫原子和钼原子的化学键,在常温常压下很难被质子H+腐蚀,属于典型的酸难溶性矿石。因此,辉钼矿的浸出需要经历2个阶段,即先利用细菌的生物酶或新陈代谢产物将矿石氧化,再利用细菌的直接作用或溶液中Fe3+的化学氧化作用溶解矿石[10]。化学氧化通过硫代硫酸盐途径进行,即细菌或Fe3+先将矿石中硫化物氧化成连四硫酸盐、连多硫酸盐等中间产物,最终将中间产物氧化成硫酸盐(图2)。
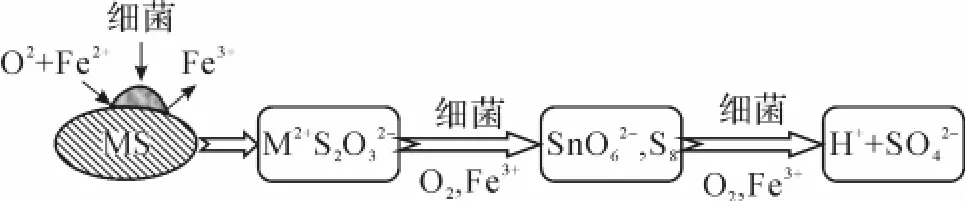
图2 生物浸出中辉钼矿硫代硫酸盐途径溶解示意图(M代表Mo,Cu,Fe等)
1.2 浸矿菌种
在辉钼矿浸出中,发现多种有浸矿能力的菌种,如At.ferrooxidans等嗜中温细菌,Leptospirillum、Thiomonas cuprina等中度嗜热菌和Sulfolobus等极端嗜热古生菌[11,12]。研究最多的为At.f,该菌革兰氏染色呈阴性,一般为杆状、棒状,生存于pH<4的含硫温泉和硫化矿床中,最佳生长温度为30~45℃,能利用Fe2+、S0、S2O2-3及还原型硫化合物进行有机化能自养,通过班森-达尔文循环固定大气中的碳。
吉兆宁等人在30℃时用嗜中温细菌浸出以辉钼矿为主的低品位原生硫化矿,摇瓶和柱浸试验结果表明,钼矿浸出率可达35.1%,菌种耐受钼离子浓度超过150 mg/L,且细菌浸出比NaClO+Na2CO3化学浸出效果好[13]。B.Nasernejad等人从伊朗的Sarcheshmeh矿山分离出一株At.f,用驯化后的菌种处理品位为24.41%的浮选钼精矿,40天后最高浸出率可达93%[11]。
1.3 生物浸出机理
细菌的主要作用是聚集化学浸出所需要的氧化剂(如某些氧化酶、Fe3+等)和提供反应场所进而催化硫化矿物的氧化。一般而言,吸附在矿石颗粒表面的细菌会产生疏松多孔的胞外聚合物EPS,菌种催化的液固反应在EPS中进行并为金属离子的外扩散提供通道[14]。
在此基础上,生物浸出机理主要有直接作用和间接作用,但对于哪种作用起主要作用,不同的学者对此争议很大。B.Nasernejad等人用0.9 K培养基培养At.f,发现32℃时该菌能直接将钼精矿溶解成钼酸盐(式1),P.Rusin等人的研究表明,At.f对辉钼矿的直接氧化作用大于Fe3+对矿物的化学氧化作用;而吴爱祥等人认为,浸出菌种主要以间接作用机制影响辉钼矿的浸出,即细菌在浸出体系中将Fe2+氧化成Fe3+,辉钼矿再与Fe3+反应而溶解(式2~3),M.A.A.Zamani等人认为在试验中无法直接观测到细菌对矿石的腐蚀,而对比添加黄铁矿前后辉钼矿的浸出速率,表明At.f是通过间接作用机制来促进钼矿的浸出[11,12,15,16]。

菌体能直接吸附在矿石颗粒表面并通过生物酶促进矿物氧化,也能通过氧化Fe2+为Fe3+而为矿物化学氧化提供氧化剂,因此,辉钼矿的生物浸出更可能是直接作用和间接作用的复合结果[17]。
1.4 钼离子对菌种生长的影响
不同种类和浓度的金属离子对浸矿细菌的生长能起到不同的促进或抑制作用,进而催化或阻碍矿石的浸出。低浓度的 Ag+、Hg2+和 Bi3+常被用作At.f浸出硫化铜矿的催化剂,高浓度的Cl-、K+则会抑制细菌的生长繁殖;而即使低浓度的钼离子通常也会对浸矿细菌有毒害作用。不同环境下分离得到的菌种耐受钼离子浓度能力不同,如J.L.Mier等人发现1m mol溶解的钼离子浓度就能抑制Sulfolobus的生长,M.A.A.Zamani等人从伊朗Sarcheshmeh矿酸性矿坑水分离到的At.f能耐受250 mg/L的钼离子浓度,而G.J.Olson等人观测到即使在4.4 g/L钼离子浓度的环境下Leptospirillum也能高效的浸出辉钼矿[18,16,7]。在大多数情况下,如果能减小或避免过高的钼离子浓度对细菌生长和浸矿的抑制,钼矿的生物浸出效果将得到很大的改善。
1.5 沉淀对浸出的抑制作用
不纯的硫化矿中碱性脉石、碳酸盐矿物的溶解及细菌的新陈代谢都会引起溶液pH的变化,进而在矿石颗粒表面形成疏松或致密的固体沉淀层。辉钼矿浸出中,常见的沉淀有因过量而无法进一步氧化的元素硫层或多硫化物,pH=1.5~2.0时钼与可溶性金属离子(如铁、钙、铝等)形成的难溶络合物,而pH>2时SO24-容易与Fe3+、K+等离子胶结生成疏松的黄钾铁矾沉淀(式4)[19~20]。
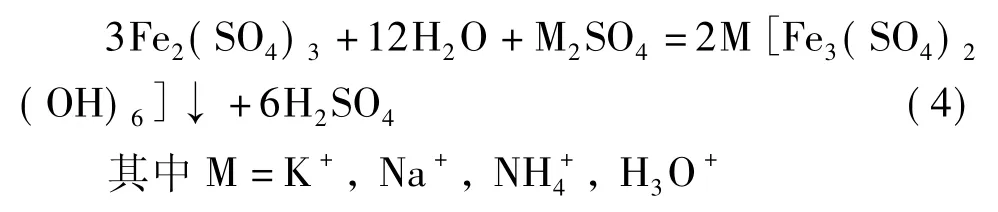
这些沉淀覆盖在颗粒表面或孔裂隙,限制了溶浸液和金属离子的内外扩散,阻碍了O2传质,也减少了细菌与矿石的接触面积。Zhan-fang Cao等人通过浸出的缩小核模型动力学分析,发现钼精矿在浸出时表面生成的元素硫层成为钼浸出的限制因素[21]。
2 辉钼矿高效浸出展望
2.1 菌种基因改良
传统的紫外线诱变、金属离子驯化等物理手段能在一定程度上提高浸矿菌种对金属离子的耐受能力,但更彻底的方法是通过生物手段改良菌种基因。如通过基因重组技术、表观遗传修饰、系统生物学技术对浸矿菌种的相关基因进行接合、转化、转导及原生质体融合,使菌种的代谢途径及目标基因的遗传学发生改变,进而选育出适合钼矿浸出的菌株[22]。D.E.Rawlings发现At.f及其细胞提取物能利用自身的钼氧化酶和细胞色素氧化酶将Mo5+直接氧化Mo6+,也能结合 Fe3+将 S0作为电子供体而还原Mo6+。这为通过基因工程定向改良浸矿菌种和提高菌种钼金属抗性能力提供了可能[14]。
2.2 多级生物反应器浸出
通常浸矿菌种对钼离子的耐受能力非常有限,菌种长期暴露在含钼离子的溶液中容易受到毒害。B.Nasernejad等人在用At.f浸出钼精矿时每隔1周用盐酸冲洗生成的沉淀并分离其中含铁钼酸盐,不溶沉淀继续在更新的培养由同一种菌株浸出,结果表明该法能大大提高菌种的生物活性[11]。该法程序非常复杂,难以在工业中应用,但它启示了通过多级反应器浸出钼矿的可能。在第1级反应器中,调节生长环境让驯化或改良后的菌种高效生长繁殖,以获得钼矿浸出所需的菌种数量和生长代谢产物;之后将培养好的菌种引入第2级反应器中浸出矿石,同时监测细菌活性和钼矿浸出速率;当浸出速率明显减缓时将浸出富液引入第3级反应器以分离纯化,同时通过第1级反应器更新第2级反应器中的浸矿菌种。
2.3 溶液电位调控技术
G.J.Olson等人的研究表明,当溶液氧化还原电位高于750~800 mV(Ag/AgCl参照电极)时钼矿才能开始浸出,高于900 mV时才有较快的浸出速率[7]。浸出体系电位一般取决于Fe3+/Fe2+比值,但由于辉钼矿静止电位只有110 mV,而且细菌受到钼离子毒害时氧化Fe2+为Fe3+的能力有限,因此很难达到如此高的电位。生产中可以:(1)通过添加黄铁矿等矿物调整辉钼矿在浸出体系中的比例,增大Fe3+/Fe2+比值,从而保持较高的溶液电位;(2)合理优化浸出体系的矿浆浓度、矿石粒度、菌种接种量、pH、温度等浸出环境,控制溶液中的Fe3+与可溶性钼离子浓度之比,以避免金属离子对细菌的毒性作用[8]。
3 结语
近年来,生物浸出钼矿的可行性得到越来越多的关注和认可。钼矿的酸难溶性,菌种耐受钼离子浓度能力差,浸出体系氧化还原电位值低和金属离子容易发生沉淀是钼矿生物浸出率不高的主要原因。目前钼矿浸出菌种有嗜中温细菌、中度嗜热菌和极端嗜热古生菌,其中对嗜中温细菌At.Ferrooxidans的研究最为广泛;细菌通过直接吸附腐蚀辉钼矿和转化Fe2+为Fe3+进行化学氧化,矿石再按硫代硫酸盐途径溶解。通过菌种基因改良、多级生物反应器浸出和溶液电位调控技术,可望实现辉钼矿的生物高效浸出。
[1]张文钲.2008年钼业年评[J].中国钼业,2008,32(6):4-11.
[2]吴贤,曹亮,张文钲.2010年钼业年评[J].中国钼业,2010,34(6):1-8.
[3]吴爱祥,周勃.我国钼资源现状与可持续发展[J].中国钼业,1998,22(4):10-13.
[4]H.R.Watling.The bioleaching of sulphide minerals with emphasis on copper sulphides-A review[J].Hydrometallurgy,2006,84(1-2):81-108.
[5]L.Bryner,R.Anderson.Microorganisms in leaching sulfide minerals[J].Industrial and Engineering Chemistry,1957,49(10):1721-1724.
[6]C.L.Brierley,L.E.Murr.Leaching:Use of a thermophilic and chemoautotrophic microbe[J].Science,1973,179(4072):488-490.
[7]Gregory J.Olson,Thomas R.Clark.Bioleaching of molybdenite[J].Hydrometallurgy,2008,93(1-2):10-15.
[8]Kummer,Wolfgang,Gutknecht,et al.Recovery of molybdenum from molybdenum bearing sulfide materials by bioleaching in the presence of iron:USA,20090320648[P].12/31/2009.
[9]Aura Energy.First bioleaching tests results successful in significantly enhancing metal extractions[Z].Sweden:ASX Announcement,2010:1-3.
[10]Edgardo R.Donati,Wolfgang Sand.Microbial Processing of Metal Sulfides[M].Netherland:Springer Verlag,2007:37-39.
[11]B.Nasernejad,T.Kaghazchi,M.Edrisi,et al.Bioleaching of molybdenum from low-grade copper ore[J].Process Biochemistry,1999,35(5):437-440.
[12]P.Rusin,L.Quintana,J.Cassels.Enhancement of copper and molybdenum bioextraction from sulfide ore through nutrient balance and the addition of Thiobacillus cuprinus[J].Mineral Engineering,1993,6(8-10):977-989.
[13]余斌,刘坚,陈何,等.金堆城低品位钼矿石可浸性研究[J].有色金属(矿山部分),2002,54(5):15-18,26.
[14]D.E.Rawlings.Characteristics and adaptability of iron-and sulfur-oxidizing microorganisms used for the recovery of metals from minerals and their concentrates[J].Microbial Cell Factories,2005,4(13):35-40.
[15]吴爱祥.用细菌从辉钼矿中浸出钼的探讨[J].中国钼业,1996,20(1):15-18.
[16]M.A.Askari Zamani,N.Hiroyoshi,M.Tsunekawa,et al.Bioleaching of sarcheshmeh molybdenum concentrate for extraction of rhenium[J].Hydrometallurgy,2005,80(1-2):23-31.
[17]P.Romano,M.L.Blazquez,F.J.Alquacil,et al.Comparative study on the selective chalcopyrite bioleaching of a molybdenite concentrate with mesophilic and thermophilic bacteria[J].FEMS Microbiology Letters,2001,196(1):71-75.
[18]J.L.Mier,A.Baliester,M.L.Blazquez,et al.Influence of metallic ions in the bioleaching of chalcopyrite by sulfolobus BC:Experimentals using pneumaticllly stirred reactors and massive samples[J].Minerals Engineering,1995,8(9):949-965.
[19]Debaraj Mishra,G.Roy Chaudhury,Dong J.Kim,et al.Recovery of metal values from spent petroleum catalyst using leaching-solvent extraction technique[J].Hydrometallurgy,2010,101(1-2):35-40.
[20]H.R.Watling,A.D.Elliot,M.Maley,W.van Bronswijk,C.Hunter.Leaching of a low-grade,coppernickel sulfide ore.1.Key parameters impacting on Cu recovery during column bioleaching[J].Hydrometallurgy,2009,97(3-4):204-212.
[21]Zhan-fang Cao,Hong Zhong,Guang-yi Liu,et al.Molybdenum extraction from molybdenite concentrate in NaCl electrolyte[J].Journal of the Taiwan Institute of Chemical Engineers,2010,41(3):338-343.
[22]Zhang Xu-Xiang,Jia Hai-Ying,Wu Bing,et al.Genetic analysis of protoplast fusant Xhhh constructed for pharmaceutical wastewater treatment[J].Bioresource Technology,2009,100(6):1910-1914.

