多西紫杉醇对乳腺癌干细胞的作用研究
钱钧强,张霄蓓,马 懿,郝晓甍,张 晟
实体肿瘤中存在一部分数量较少、成瘤能力特别强、分化程度极低的细胞,称为 “肿瘤启动细胞 (tumor initiating cells)”、“成瘤性癌细胞 (tumorigenic cells)”或 “癌干细胞(cancer stem cells)”。癌干细胞具有类似于成体干细胞的特性:自我更新能力,多项分化潜能以及强大的体内成瘤能力[1-2]。这些干细胞在肿瘤的发生、发展中发挥了至关重要的作用,同时也是肿瘤复发、转移的罪魁祸首,这使得针对癌干细胞的研究成为肿瘤研究的重中之重[3-4]。研究证明,乳腺癌同样存在着干细胞[5]。随着实验技术和条件的改善,特异性表型乳腺癌干细胞已可从癌细胞中分离,且其成瘤性已得到充分的证实,为乳腺癌干细胞的研究打下了坚实的基础[5-6]。
多西紫杉醇现广泛应用于各种恶性肿瘤的治疗中,已经成为乳腺癌患者的常规化学治疗药物之一。本实验将分选出来的三种乳腺癌干细胞及未分类细胞分别置于含有不同浓度多西紫杉醇的培养液中,检测多西紫杉醇对不同干细胞的生长抑制曲线,并利用流式细胞仪进行细胞周期及细胞凋亡的分析,从而明确该药物对乳腺癌干细胞的作用及其机制。
1 对象与方法
1.1 研究对象 人乳腺癌细胞系 MCF-7、MDA-MB-231细胞株为本实验室保存;在取得患者知情同意后,收集天津医科大学附属肿瘤医院乳腺癌标本 6例,经病理确诊均为浸润性导管癌。
1.2 试剂 RPMI-1640、胎牛血清 (FBS)、Hank′s液、胶原酶、四甲基偶氮唑盐 (MTT)、胰酶实验耗材等购自 Gibco公司;荧光标记抗体购自 SANTA CRUZ生物科技公司;Annexin V-FITC细胞凋亡检测试剂盒购自 KeyGEN公司;其他试剂均由天津市肿瘤医院中心实验室提供。
1.3 实验仪器 流式细胞仪、酶联免疫检测仪、超净台、温箱、离心机及其他实验仪器均由天津市肿瘤医院中心实验室提供。
1.4 乳腺癌干细胞的获得
1.4.1 原代乳腺癌干细胞的获得 将新鲜的乳腺癌组织 (>1 cm3)在无菌的条件下切碎至 1 mm3的组织块;用现配的浓度为 1 mg/Ml胶原酶 (过滤无菌)在 37℃温箱中消化 1~3 h,过滤后用 10%FBS-1640溶液重悬细胞,加入胶原涂抹的培养瓶中,置 37℃,5%CO2培养箱保存过夜,用于第 2天流式细胞仪分选。分选前将细胞标记 CD44-APC、CD24-PE、ESA-FITC抗体,使用流式细胞仪分选出 CD+44、CD-/low24、ESA+的细胞,分选至培养瓶或 96孔板。
1.4.2 MCF-7、MDA-MB-231细胞系干细胞获得 MCF-7、MDA-MB-231细胞系细胞均用 FBS-1640培养基、25 ml培养瓶培养,置于 37℃,5%CO2孵化箱中培养。每天换液,观察细胞状态;待细胞数达到 108个时,将细胞消化,充分吹打成单细胞悬液。分选前将细胞标记 CD44-APC、CD24-PE、ESA-FITC抗体,使用流式细胞仪分选出 CD+44、CD-/low24、ESA+的细胞,分选至培养瓶或 96孔板。
1.5 干细胞培养 采用无血清的干细胞培养液:含1∶50 B27、20 ng/ml表皮生长因子 (EGF)、0.4%牛血清清蛋白、4μg/Ml胰岛素的 DMEM∶F12(1∶1)培养液,防止乳腺癌干细胞的分化。
1.6 MTT试验 将流式细胞仪分选出的干细胞置于已加入含不同终浓度药物的干细胞培养液的 96孔板中,每一浓度设 5个复孔,于 37℃,5%CO2的培养箱中继续培养24 h;给予不同浓度的多西紫杉醇孵育 24 h后,每孔加入 MTT 20μl(以PBS配成 5 mg/Ml),37℃,5%CO2的饱和湿度继续培养 4 h后中止培养,吸弃上清,每孔加二甲亚砜 (DMSO)150μl,震荡 10min。在酶联免疫检测仪上测定各孔的光吸收值 (OD值),并绘制药物作用曲线。应用 SSPS 17.0的 probit软件计算出药物的半数抑制浓度 (IC50)。
1.7 流式细胞仪检测细胞凋亡的变化 将流式细胞仪分选出的 MDA-MB-231干细胞、原代乳腺癌干细胞置于盛有干细胞培养液的细胞培养瓶中,分 4组:(1)空白对照组 (Control组),(2)药物作用 24 h组,(3)药物作用 48 h组,(4)药物作用 72 h组。多西紫杉醇作用浓度为 10μmol/L,空白对照组加入含 0.5%DMSO的培养液。处理结束后于 37℃,5%CO2的培养箱中继续培养所需时间,然后收集细胞。分别 Annexin-FITC(FITC荧光标记的膜联蛋白)及 Propidium Iodide(PI,碘化丙啶),混匀;室温下、避光孵育 5~15 min,1 h内上机检测细胞凋亡率,了解多西紫杉醇对干细胞凋亡的影响。
1.8 流式细胞仪检测细胞周期 将流式细胞仪分选出的 MDA-MB-231干细胞、原代乳腺癌干细胞置于盛有干细胞培养液的细胞培养瓶中,分 4组:(1)空白对照组 (Control组),(2)药物作用24 h组,(3)药物作用48 h组,(4)药物作用72 h组。药物作用浓度为 10μmol/L,空白对照组加入含0.5%DMSO的培养液。处理结束后于 37℃,5%CO2的培养箱中继续培养所需检测时间,然后收集细胞。以冰乙醇固定24 h,测试前去除乙醇,加入含有 RNA酶的 PI 500μl(1 mg/Ml)及 1m l PBS,4℃避光染 30~60 min。样品上流式细胞仪,得到细胞各个时期的分布状态,计算出 G0/G1%、S%及G2/M%。了解细胞的周期分布及细胞的增殖活性。
2 结果
2.1 原代乳腺癌细胞、MCF-7、MDA-MB-231干细胞的比例 本研究利用近期医学界公认的乳腺癌干细胞表型:CD+44、CD-/low24、ESA+,分别对原代乳腺癌细胞、MCF-7、MDA-MB-231进行干细胞的分选。其中原代乳腺癌干细胞仅占原代乳腺癌细胞总数的 (0.50±0.26)%;MCF-7中干细胞占 (1.40±0.26)%;MDA-MB-231细胞系中干细胞占(1.63±0.32)%(见图 1)。
2.2 MTT试验结果 多西紫杉醇作用的浓度梯度为:10 nmol/L、100 nmol/L、1 μmol/L、 10μmol/L和 100 μmol/L。利用 SPSS 17.0软件计算多西紫杉醇对各未分类细胞和干细胞的 IC50。相对于乳腺癌未分类细胞,各系乳腺癌干细胞均对多西紫杉醇存在一定的耐药性:其中 MDA-MB-231未分类细胞 IC50为 34 nmol/L;而 MDA-MB-231干细胞 IC50为12.422μmol/L(P<0.01);MCF-7细胞对多西紫杉醇的IC50为 31 nmol/L,分选出的干细胞为 8.357μmol/L(P<0.01);对于原代干细胞而言,细胞系 IC50为 51 nmol/L,干细胞为 17.688μmol/L(P<0.01)。从不同浓度的细胞生长抑制率可以看出,不论是癌细胞还是癌干细胞,多西紫杉醇对MCF-7细胞较为有效,MDA-MB-231次之,原代乳腺癌的效果最差 (见图 2)。

图 1 原代乳腺癌细胞 MCF-7及 MDA-MB-231的干细胞比例Figure 1 The proportion of CSCs in primary breast cancer cells,MCF-7 and MDA-MB-231

图 2 不同浓度多西紫杉醇对乳腺癌干细胞生长抑制率的影响Figure 2 The inhibitory effectsof docetaxel in different concentrations on CSCs
2.3 多西紫杉醇对干细胞凋亡的影响 多西紫杉醇作用 24 h、48 h、72 h后,MDA-MB-231细胞总凋亡率分别为 (6.51±0.34)%、(7.61±0.33)%和 (8.01±0.08)%,均明显高于对照组的 (1.43±0.09)%,差异有统计学意义 (F=428.586,P<0.001),且干细胞早期凋亡率随药物作用时间的增加而升高,呈时间依赖性 (r=0.883,P=0.000)。然而,多西紫杉醇作用于乳腺癌原代干细胞时,相对于 0 h时(0.66±0.30)%的凋亡率,作用 24 h、48 h、72 h后可分别诱导 (1.05±0.14)%、 (2.18±0.11)%和 (2.46±0.35)%的干细胞出现早期凋亡,差异有统计学意义 (F=37.810,P<0.001,见图 3)。
2.4 多西紫杉醇对干细胞周期的影响 10μmol/L多西紫杉醇对 MDA-MB-231干细胞表现出一定的 G2/M期周期阻滞作用,24 h即达到,并且这种阻滞作用随着时间的增加而增强 (r=0.970,P=0.000),其在 0 h、24 h、48 h、 72 h分别可诱导 (8.51±0.71)%、 (15.21±1.13)%、 (20.00±0.77)%和 (22.30±0.60)%的干细胞滞留在 G2/M期。原代乳腺癌干细胞也表现出相似的与作用时间相关的 G2/M期阻滞,但是程度要低 (r=0.982,P=0.000,见图 4),其在 0 h、24 h、48 h、 72 h分别有 (8.47±0.46)%、 (11.77±0.68)%、(14.53±1.10)%和 (16.9±0.10)%的原代干细胞滞留在 G2/M期。
3 讨论
3.1 原代乳腺癌及细胞系干细胞的含量 2003年 Al-Hajj等[6]借助异种乳腺癌细胞移植动物模型,第一次在实体瘤中分离和鉴定了肿瘤干细胞,证实了乳腺癌干细胞的存在。他们将乳腺癌术后标本中的肿瘤组织制成单细胞悬液,经流式细胞仪筛选出具有特殊表面标志的细胞并注入免疫缺陷小鼠体内,结果发现所有接种 ESA+、CD+44、CD-/low24、Lin-细胞的小鼠在12周内均出现明显的肿瘤,而该表型的细胞只需接种 1×103即能保证 100%成瘤 (是未分类细胞致瘤性的 50倍)。本研究就选取了 CD44、CD24、ESA三种标记物[7]作为乳腺癌干细胞特异性表面标记物进行进一步的实验研究。本实验首先对原代乳腺癌细胞、MCF-7及 MDA-MB-231进行干细胞的分选。结果显示 MDA-MB-231中干细胞的比例最高,达 (1.63±0.32)%。这正与 Sheridan等[8]研究结果相符:表达 CD+44、CD-/low24的乳腺癌细胞的含量与乳腺癌的浸润和转移呈正相关,比例高的细胞系表达更高水平促侵袭相关基因,体外侵袭试验提示侵袭能力更强。MDA-MB-231是三阴性乳腺癌细胞系[9],其易发生远处转移及化疗耐药,这可能与其乳腺癌干细胞含有比例较高有关[9]。
3.2 乳腺癌干细胞的耐药性 肿瘤干细胞因其腺苷三磷酸结合盒转运体 G2(ABCG2)等三磷酸腺苷结合盒 (ATP binding cassette,ABC)转运体的高表达,能将化疗药泵出,而对化疗具有抵抗性[10]。化疗药杀死了占大多数的分化细胞,而留下了少数的肿瘤干细胞,成为日后复发的根源。Liu等[11]将ESA+、CD+44、CD-/low24、Lin-的乳腺癌干细胞与正常乳腺上皮细胞进行差异表达分析,发现 186个基因的表达有显著不同,将这些基因命名为 “侵袭性”基因信号 (IGS)。IGS的状态对于乳腺癌患者是否存在远处转移、无病生存期、总生存期都具有指导性意义;且人乳腺癌原代细胞中的乳腺癌干细胞有更高水平的多药耐药基因 1(MDR1)表达和化疗耐药性,提示乳腺癌干细胞可以通过高表达 MDR1而逃逸化疗。本实验通过研究多西紫杉醇对原代乳腺癌及细胞系的未分类细胞与干细胞的不同影响发现,不论是乳腺癌细胞系还是原代乳腺癌细胞,干细胞对多西紫杉醇均存在一定的耐药性,需要加大药物的作用浓度实现杀伤癌细胞的作用,从而进一步证实乳腺癌干细胞在乳腺癌化疗中占有重要地位,它不但比其他乳腺癌细胞更容易在化疗中发生治疗逃逸,并且能够通过变异获得耐药性,而化疗后乳腺癌干细胞的自我更新加速将促进乳腺癌的复发。
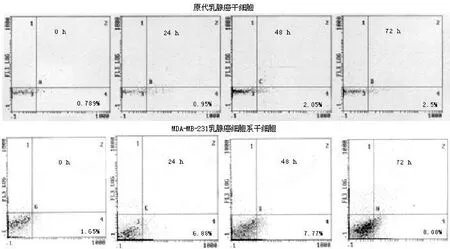
图 3 多西紫杉醇对乳腺癌干细胞凋亡的影响Figu re 3 Docetaxel enhances apoptosisof CSCs of primary breast cancer cells and MDA-MB-231

图 4 多西紫杉醇对乳腺癌干细胞 G2/M期的影响Figure 4 Docetaxel induces G2/Mcell cycle arrest in CSCsof primary breast cancer cells and MDA-MB-231
3.3 多西紫杉醇对乳腺癌干细胞系的作用机制 研究中虽然发现了乳腺癌干细胞对多西紫杉醇具有一定的耐药性,但是可以看出多西紫杉醇仍有抑制乳腺癌干细胞生长的作用。研究显示,多西紫杉醇对乳腺癌干细胞生长的抑制作用随药物浓度的增高而增强,抑制率与药物浓度成量效关系,其中多西紫杉醇对 ER+的乳腺癌细胞系 MCF-7干细胞最为有效 (IC50=8.357μmol/L)。多西紫杉醇主要作用在微管,微管是由微管蛋白聚合而成。微管蛋白则是由 α和 β两个多肽亚单位所组成的分子量为 10万 kDa的蛋白质[12]。在微管蛋白的聚合作用和微管的解聚作用之间存在动态平衡,多西紫杉醇能加快微管蛋白聚合成微管的速度并延缓微管的解聚作用,从而形成稳定的非功能性的微管束,使细胞被阻抑于细胞周期的 G2和 M时相,不能形成运动的纺锤体从而抑制有丝分裂和细胞增殖。多西紫杉醇的作用位点,主要作用于 β-微管蛋白的 N-末端 31位氨基酸和 217-231氨基酸残基上,使具有可逆变化的微管不能解聚,阻止有丝分裂,最后导致癌细胞死亡[13-14]。本研究结果表明多西紫杉醇对 MDA-MB-231癌干细胞和原代乳腺癌干细胞表现出一定的 G2/M期周期阻滞作用,且随着时间的延长,其对干细胞的 G2/M的阻滞率增加,故多西紫杉醇对乳腺癌干细胞周期的影响呈时间依赖性。细胞凋亡是由基因调控的主动死亡过程,是维持器官组织细胞数量稳定和内环境稳定的重要机制。细胞凋亡调控失调是肿瘤组织过度生长的重要原因,促进细胞凋亡则有助于彻底治愈肿瘤[15]。10μmol/L多西紫杉醇与乳腺癌干细胞共孵育 48~72 h,可见凋亡细胞的典型形态学特征:早期表现为胞质空泡化,继而体积缩小,核染色质固缩,核边聚,染色质断裂,出芽,凋亡小体形成等。同时流式细胞仪检测结果表明,随着多西紫杉醇作用时间的增加,其凋亡率逐渐增高,呈时间依赖性。上述研究结果提示,多西紫杉醇可能通过诱导细胞凋亡而抑制乳腺癌干细胞增殖。
综上所述,多西紫杉醇可在一定程度上抑制乳腺癌干细胞的生长,但同时存在一定的耐药性。其抑制乳腺癌干细胞生长的机制可能与其加快微管蛋白聚合成微管的速度并延缓微管的解聚作用,使细胞被阻抑于细胞周期的 G2和 M时相有关,使得干细胞有丝分裂和细胞增殖被抑制。此外,多西紫杉醇还可诱导乳腺癌干细胞早期凋亡,从而影响乳腺癌干细胞的增殖、黏附以及转移能力,但其具体抗肿瘤作用机制仍需要进一步的研究完善。
1 Fillmore CM,Gupta PB,Rudnick JA,et al.Estrogen expands breast cancer stem-like cells through paracrine FGF/Tbx3 signaling[J].Proc Natl Acad Sci USA,2010,107(50):21737-21742.
2 Hirose H,Yamamoto H,Miyoshi N,et al.Cancer stem cells in solid tumors[J].Gan To Kagaku Ryoho,2010,37(13):2809-2812.
3 Mueller MT,Hermann PC,Heeschen C.Cancer stem cells as new therapeutic target to prevent tumour progression and metastasis[J].Front Biosci,2010,2:602-613.
4 Theodoropoulos PA,Polioudaki H,Agelaki S,et al.Circulating tumor cells with a putative stem cell phenotype in peripheral blood of patients with breast cancer[J].Cancer Letters,2010,288(1):99-106.
5 Federici G,Espina V,Liotta L,et al.Breast cancer stem cells:a new target for therapy[J].Oncology,2011,25(1):25-28.
6 Al-Hajj M,Wicha MS,Benito-Hernandez A,et al.Prospective identification of tumorigenic breastcancer cells[J].Proc Natl Acad Sci USA,2003,100(7):3983-3988.
7 佟易凡,张瑾 .乳腺癌筛查的生物标记物 [J].中国全科医学,2008,11(5):831.
8 Sheridan C,Kishimoto H,Fuchs RK,etal./breastcancer cells exhibit enhanced invasive properties:an early step necessary for metastasis[J].Breast Cancer Research,2006,8(5):R 59.
9 Caldas-Lopes E,Cerchietti L,Ahn JH,et al.Hsp90 inhibitor PUH 71,amultimodal inhibitor ofmalignancy,induces complete responses in triple-negative breast cancer models[J].PNAS,2009,106(20):8368-8373.
10 Reya T,Morrison SJ,Clarke MF,et al.Stem cells,cancer,and cancer stem cells[J].Nature,2001,414(6859):105-111.
11 Liu R,Wang X,Chen GY,et al.Theprognostic role of a gene signacture from tumorigenic breast cancer cells[J].N Engl J Med,2007,356(3):217-226.
12 Bhalla KN.Microtubule-targeted anticancer agents and apoptosis[J].Oncogene,2003,22(56):9075-9086.
13 曹秀风.以多西紫杉醇为主方案治疗乳腺导管浸润癌 28例分析[J].中国误诊学杂志,2008,8(3):700.
14 Bear HD,Anderson S,Sm ith RE,et al.Sequential preoperative or postoperative docetaxel added to preoperative doxorubicin plus cyclophospham ide for operable breast cancer:National Surgical Adjuvant Breast and Bowel Project Protocol B-27[J].Journalof Clinical Oncology,2006,24(13):2019-2027.
15 Ahmad A,Sakr WA,Rahman KM.Anticancer properties of indole compounds:mechanism of apoptosis induction and role in chemotherapy[J].Current D rug Targets,2010,11(6):652-666.
