由一个演示实验引发的思考
丁 萍
(江苏省姜堰中学江苏姜堰225500)
由一个演示实验引发的思考
丁 萍
(江苏省姜堰中学江苏姜堰225500)
对高中化学教材中的一个演示实验提出质疑,通过设计对比试验,证明了KCl等固体对的影响,并通过理论依据对实验结果进行了解释。
氯化铁;硫氰化钾;化学平衡;离子活度
一、教材设计
人教版选修4《化学反应原理》中关于化学平衡的移动这一节的内容是这样设计的,通过实验改变反应物和生成物的浓度,看溶液颜色的变化,从而得出浓度对化学平衡的影响。
课本中以FeCl3+3KSCN⇌Fe(SCN)3+3KCl的可逆反应为研究对象,通过改变FeCl3或KSCN的浓度进行对照实验,比较溶液颜色的变化从而得出浓度对化学平衡的影响。
二、提出问题
如果向平衡体系中加入KCl等固体,使KCl的浓度改变了,对化学平衡会有影响吗?
通常我们是这样分析的:根据勒沙特列原理,改变平衡体系中物质的浓度能影响化学平衡,其前提条件是改变参与反应的物质的浓度。从表面上看,KCl虽然参与了该反应,但实际上,该反应的本质是Fe3++3SCN-⇌Fe(SCN)3。因此,加入KCl固体不能影响该化学平衡体系。
这样的答案是否正确呢?如果我们加入其他固体,情况又将怎样呢?我们还是通过实验进行验证。
三、实验探究
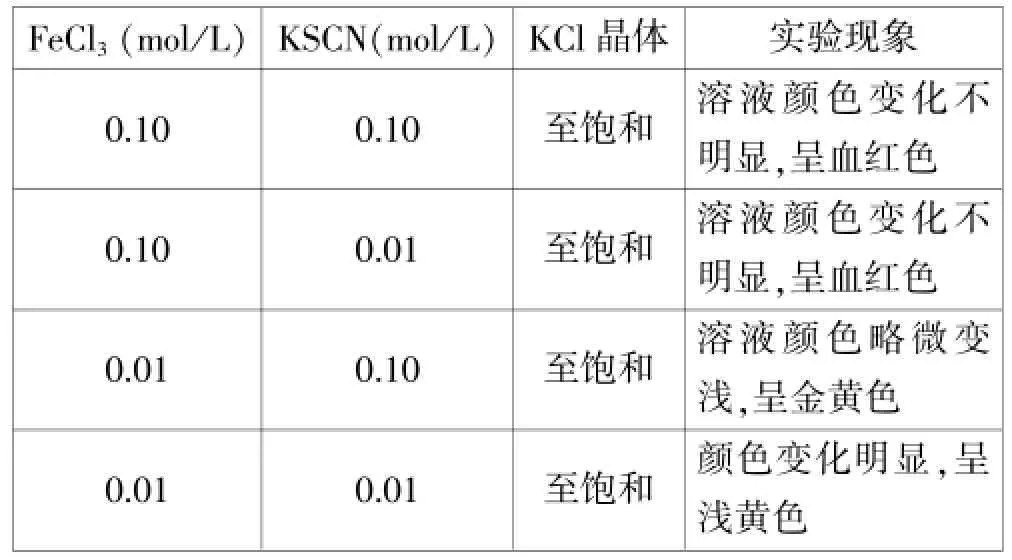
实验结论:当反应物浓度较大时,加入KCl固体对平衡几乎无影响;而在反应物浓度较稀时,加入KCl固体使KCl的浓度增大,化学平衡向逆反应方向移动。
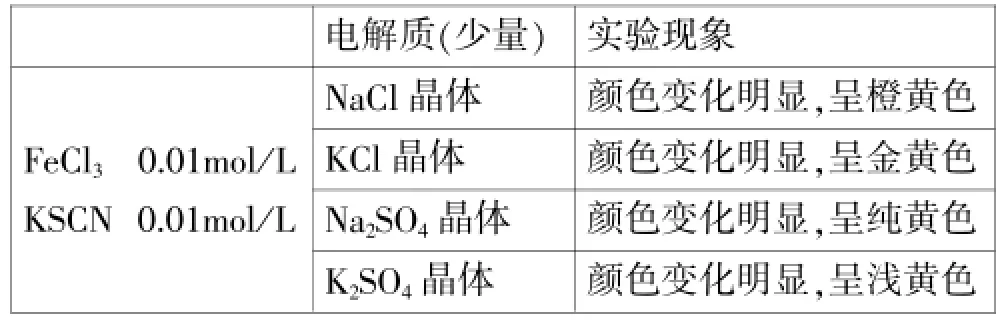
实验结论:当反应物浓度较稀时,加入少量电解质对化学平衡均有影响。当阴离子相同时,钾盐对该平衡的影响比钠盐大;当阳离子相同时,SO42-对该平衡的影响比Cl-大。
为什么实验结果与常规分析不相符呢?
四、理论解释
解释一:其他平衡体系的存在。当加入固体KCl时,该体系中还存在着络合平衡[1],随着Cl-浓度的增加,使上述化学平衡向正反应方向移动,从而导致Fe3+浓度变小,并最终影响Fe(SCN)3的平衡,血红色变浅。在反应物浓度较低时,这种连环变化比较明显,当反应物浓度较大时,这种变化以及由此造成的颜色变化程度不大,也有可能是因为浓度越高,血红色越深,肉眼难以识别颜色的变化。
解释二:另一重要的影响因素是离子活度。离子活度是指其在化学反应中表现出来的有效浓度。由于溶液中离子间存在静电作用(如加入氯化钾后,Fe3+周围形成Cl-氛,SCN-周围形成K+氛),它们的自由运动和反应活性受到影响,即使得Fe3+和SCN-彼此接触形成Fe(SCN)3的“机会”减少,这样它们在反应方程式中表现出的浓度与其真实浓度(有效浓度)存在着一定差异。溶液中离子的真实浓度(有效浓度)降低,根据勒沙特列原理,平衡应该向着增加溶液中离子浓度的方向移动,即加入KCl(强电解质),促使Fe(SCN)3解离,平衡逆向移动。
下面用具体的计算式来说明加入不同的强电解质对离子活度的影响。
离子活度ai=γi·ci(γi称为i离子的活度系数,ci表示第i种离子的平衡浓度),对于稀溶液(<0.1mol·L-1)中离子活度系数,可用德拜—休克尔(Debye-Hückel)公式来计算[2],

(其中B是常数,25℃时为0.00328;ao为离子体积参数,约等于水化离子的有效半径,以pm(10-12m)计;I为溶液的离子强度)。
加入强电解质后,溶液中离子数、离子浓度显著增加,使得溶液的离子强度增大。对于上述的德拜—休克尔(Debye-Hückel)公式可作如下的变换:

我们考虑的是加入的强电解质对Fe3+和SCN-活度的影响,所以对Fe3+或SCN-而言,式中的Bao为定值,即推得离子强度I与离子活度系数γi成反比、与离子活度ai成反比。
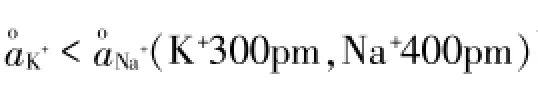
五、启示
化学是一门以实验为基础的科学,在实验过程中我们必须尊重事实,尊重科学。在倡导新课改的今天,我们可以将实验过程中出现的疑问提出来,师生共同研究,去查阅相关资料,进行探究性实验,以提升学生的科学素养,改变学习方式,培养创新能力,同时使得教师的教学观念更新和转变,专业知识得以巩固和发展。
[1]北京师范大学等无机化学教研室.无机化学(下册)[M].北京:高等教育出版社,2002:168
[2]武汉大学等.分析化学(上册)[M].北京:高等教育出版社,2006:110
1008-0546(2011)10-0082-02
G633.8
B
10.3969/j.issn.1008-0546.2011.10.041

