乙型肝炎外周血Th1/Th2及Tc1/Tc2细胞失衡的临床意义研究
赵楚生,陈瑞烈,林少锐,蔡绮纯,吴健慧,谢 婵
乙型肝炎是国人常见疾病,临床表现多样,可表现为急性、慢性迁延性、慢性活动性或暴发性等多种形式,其预后也不一样。造成临床表现多样性的具体机制还不清楚,但可以肯定与机体免疫反应有关。乙型肝炎病毒侵入机体后产生由T细胞毒反应所介导的免疫反应,T细胞可分为CD4+和两种亚群。细胞可进一步分为Th1、Th2和Th0亚型,Th0则是 Th1/Th2 的前体细胞[1]。细胞也可进一步分为Th1、Th2亚型,有学者将其分别命名为Tc1和Tc2[2]。Th1与细胞介导的免疫反应有关,Th2与体液免疫有关。Th1/Th2(Tc1/Tc2)细胞平衡是保持机体正常免疫机制所必需的,其失衡与乙型肝炎发展有明显相关性,但也有不同意见者[3-6]。
目前采用流式细胞术分析外周血不同T淋巴细胞亚群。辅助性T细胞 (Th细胞)的表面标志为CD3+CD4+,当实验用佛液脂 (PMA)刺激4 h,会发现CD4+细胞明显减少,甚至消失。所以用CD3和CD8反设CD4细胞,即CD3+CD8-细胞被认为是CD3+CD4+细胞,用于分析Th1/Th2比例。而细胞毒性T细胞 (Tc细胞)的表面标志为CD3+CD8+,用于检测Tc1/Tc2比例。目前,检测外周血Th1/Th2、Tc1/Tc2细胞的方法主要与细胞因子有关,因γ-干扰素 (IFN-γ)为Th1和Tc1最特异分泌的细胞因子,白介素4(IL-4)为Th2和Tc2最特异分泌的细胞因子。通过检测细胞因子IFN-γ和IL-4的表达来确定Th1和Th2、Tc1和Tc2细胞的百分率。即:CD3+CD8-IFN-γ+为Th1细胞,CD3+CD8-IL-4+为Th2细胞,CD3+CD8+IFN-γ+为Tc1细胞,CD3+CD8+IL-4+为Tc2细胞。
本研究采用流式细胞术分析各型乙型肝炎患者外周血不同T淋巴细胞亚群CD3+CD8-以及 CD3+CD8+中细胞因子IFN-γ、IL-4的表达,对外周血Th1/Th2、Tc1/Tc2细胞失衡与乙型肝炎慢性化以及进展的关系进行分析,探讨免疫平衡机制在乙型肝炎发生发展和转归中的作用。
1 资料与方法
1.1 一般资料 选择2006年7月—2008年12月在中山大学附属汕头医院、中山大学附属第三医院住院及门诊治疗的各型乙型肝炎患者81例,其中男61例,女20例。入选标准:(1)年龄18~65岁,性别不限。(2)诊断标准:符合2000年西安第十次全国病毒性肝炎和肝病学术会议修订标准。排除标准:(1)合并其他严重疾病,如心肾衰竭、糖尿病、肿瘤等。(2)甲状腺功能亢进症等自身免疫性疾病,服用抗排斥等免疫抑制剂。(3)甲、丙、丁、戊型肝炎病毒,TTV病毒,巨细胞病毒,疱疹病毒等重叠感染。
1.2 主要仪器及试剂 BD FACScalibur流式细胞仪 (美国BD公司)、CO2培养箱 (美国Forma Scientific公司)。
主要单抗:CD3-PE -Cy5、FITC、IL-4-PE-Cy7、IFN-γ-PE Texas Red和CD69-PE单抗均购自BD公司,鼠FITC-IgG1和PE-IgG1单抗为Pharmingen公司产品。
其他试剂:PMA、Ionomycin、BFA等试剂购自SIGMA公司,RPMI1640购自GIBCO公司,固定穿透试剂盒CytofixPCytopem kit购自Pharmingen公司。
1.3 实验方法
1.3.1 细胞培养 空腹抽取患者外周静脉血2~3 ml,肝素抗凝,按1∶1与无血清的RPMI-1640培养基混匀,加入刺激剂佛波酯 (PMA)和钙离子霉素 (Ionomycin),使其终浓度分别为25 ng/ml和1μg/ml,同时加入终浓度为10μg/ml的蛋白转运抑制剂 (BFA);未刺激对照则只加BFA,不加刺激剂,混匀后细胞在37℃、5%CO2培养箱中培养4 h。
1.3.2 细胞膜表面抗原和细胞内细胞因子染色 加入20μlPE-Cy5和FITC单抗于检测管中,再加100μl培养的全血,混匀,室温暗处孵育15 min,加入溶血素2 ml,放置5~10min,待红细胞裂解,1 000 r/min离心5min,弃上清液,将细胞用含0.5%小牛血清的PBS 2 ml洗涤1次,加入固定液CytofixPCytopem 0.5ml,固定20min,1 000 r/min离心5 min,弃上清液,再加2 ml 1×CytopermPWash穿透剂室温暗处穿透10 min,1 000 r/min离心5 min,然后加入20μl IL-4-PE-Cy7和IFN-γ-PE Texas Red单抗,混匀,室温暗处孵育30 min,2 ml1×CytopermPWash穿透剂洗1次,最后加入0.5 m l 1%PFA固定待测。
1.3.3 结果分析 用CD3和CD8设门,FL1和FL2荧光通道则以相应同种型的鼠IgG染色细胞作阴阳分界线,仔细设置各荧光通道之间的荧光补偿,然后进行IFN-γ和IL-4的检测,每管获取细胞数30 000个,用Cellquest软件进行数据分析。
1.4 统计学方法 采用SPSS15.0统计软件,计量资料以 (x-±s)表示,两组间比较用t检验,多个样本均数比较采用方差分析。以P<0.05为差异有统计学意义。
2 结果
2.1 外周血T淋巴细胞亚群中细胞因子IFN-γ、IL-4的表达率 急性肝炎 (acute hepatitis B,AHB)和慢性肝炎 (chronic hepatitis B,CHB)患者外周血T淋巴细胞亚群中细胞因子IFN-γ、IL-4的表达见图1。CHB组外周血 CD3+CD8
-、CD3
+CD8
+T细胞亚群IL-4表达率与AHB组比较,差异均有统计学意义 (P<0.05),即CHB Th2、Tc2细胞均高于AHB。而两组IFN-γ表达率比较,差异均无统计学意义 (P>0.05,见表1)。
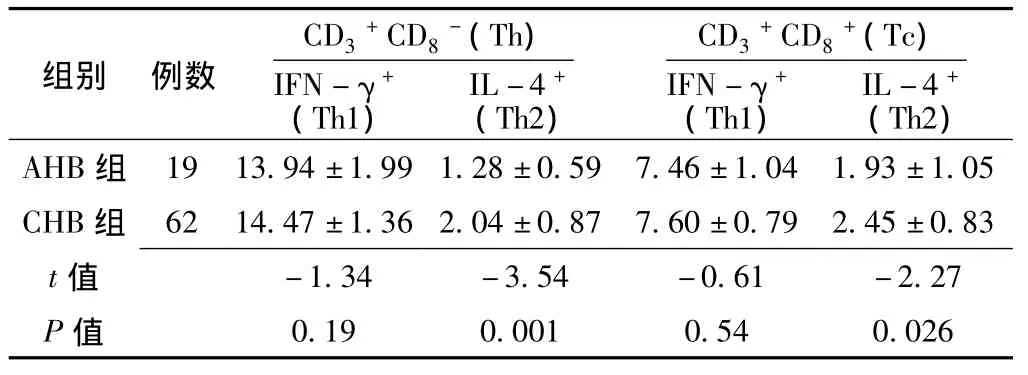
表1 急慢性乙型肝炎患者外周血T淋巴细胞亚群中细胞因子IFN-γ、IL -4的表达率 (x- ±s,%)Table 1 Comparison of the cytokine expression rate of T lymphocyte subsets between the patientswith AHB and CHB
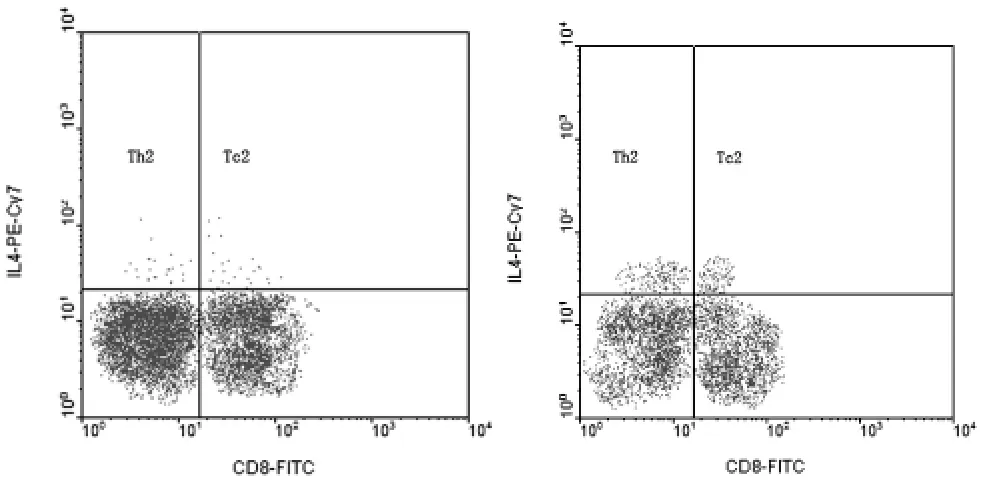
图1 急性 (A)与慢性 (B)肝炎患者外周血T淋巴细胞亚群流式细胞仪检测图Figure 1 T lymphocyte subsets of AHB and CHB assessed by flow cytometry
2.2 不同程度CHB患者外周血T淋巴细胞亚群中细胞因子IFN-γ、IL-4的表达率 CHB轻度、中度、重度患者外周血T淋巴细胞亚群中细胞因子IFN-γ、IL-4的表达率见图2。相对于轻度组,中度组和重度组CD3+CD8-、CD3+CD8+T细胞亚群IFN-γ表达均有增高 (P<0.01),即中度、重度组Th1、Tc1均高于轻度组。相对于中度组,重度组CD3+CD8-、CD3+CD8+T细胞亚群IFN-γ亦有增高 (P<0.05,见表2),即重度组Th1、Tc1均高于中度组。
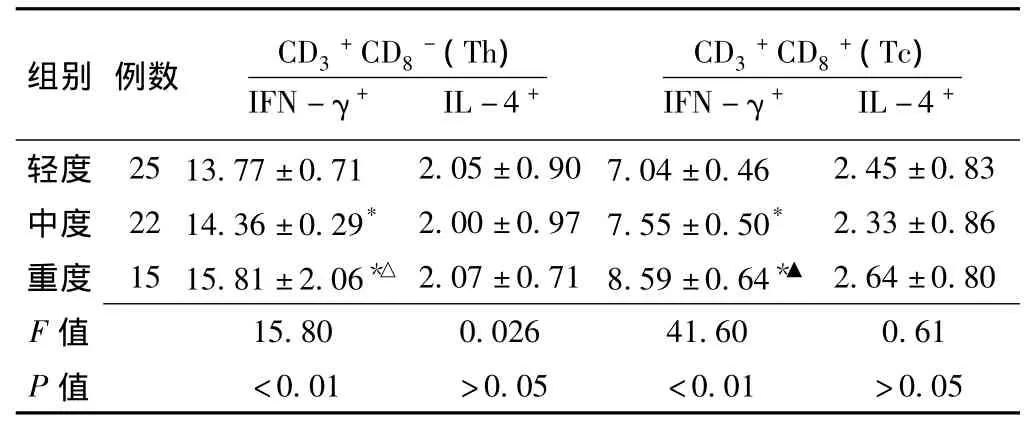
表2 不同程度CHB患者外周血T淋巴细胞亚群中细胞因子IFN-γ、IL-4的表达率 (x- ±s,%)Table 2 Comparison of the cytokine expression rate of T lymphocyte subsets between the patients with varying degrees of chronic hepatitis B

图2 慢性轻度 (A)、中度 (B)、重度 (C)乙型肝炎患者外周血T淋巴细胞亚群流式细胞仪检测图Figure 2 T lymphocyte subsets of slight,moderate,severe chronic hepatitis B assessed by flow cytometry
3 讨论
乙型肝炎病毒 (HBV)严重威胁人类健康。据世界卫生组织 (WHO)报道,全世界有约20亿人曾感染HBV,其中3.5亿人为慢性HBV感染,每年大约有100万人死于HBV感染引起的肝衰竭、肝硬化和原发性肝细胞癌[7]。我国属HBV感染地方性流行区。2006年我国流行病学调查结果显示,一般人群HBV表面抗原 (HBsAg)携带率为7.18%。据此推算,我国现有的慢性HBV感染者约9 300万人,其中,CHB患者约2 000 万例[8]。
目前,乙型肝炎的治疗仍是世界公认的难题。这主要是由于其发病机制尚未完全清楚,从而导致了治疗和对预后评估的困难。
在大多数病毒感染性疾病中,机体特异性细胞免疫对于清除病毒感染起重要作用;另一方面,在某些条件下,免疫效应细胞和某些细胞因子在清除病毒的过程中可引起组织细胞损伤,产生不同程度的病理变化。乙型肝炎的发病主要是机体清除HBV而引发的细胞免疫病理改变[9]。HBV感染肝脏后,机体通过NK细胞、巨噬细胞以及特异性的细胞毒性T细胞(CTL)等免疫细胞清除被病毒感染的肝细胞[10],若大量肝细胞被感染或机体免疫功能亢进,大量肝细胞受免疫细胞攻击而迅速坏死,则引起重症肝炎[11-12]。
Th1/Th2(Tc1/Tc2)免疫应答是近年来免疫学研究的热点之一,其在乙型肝炎发病机制中的作用日益受到重视。研究HBV感染时Th1/Th2(Tc1/Tc2)状态对认识乙型肝炎发生、发展、预后和观察治疗效果均有积极的意义[13]。本研究结果显示CHB患者外周血Th2、Tc2细胞高于AHB,而随着CHB活动程度的加剧Th1、Tc1细胞逐渐增多。本研究结果表明Th2、Tc2与乙型肝炎慢性化有关,各类CHB患者以Th2型反应为主,Th2型优势反应是HBV感染慢性化的主要原因之一。Th1/Th2调节机体细胞免疫和体液免疫的平衡,决定免疫应答的方向。Th1细胞分泌IL-2、IFN-γ、TNF等I型细胞因子,促进细胞免疫 (I型免疫反应)、细胞毒性T细胞的生长和活化、巨噬细胞的活化,介导迟发型变态反应。Th2细胞以分泌IL-4、IL-5为特征,通常还产生 IL-6、IL-9、IL-10和IL-13等Ⅱ型细胞因子,促进B细胞的生长、活化和分化,增进以IgE和IgG1类抗体为主的体液免疫 (Ⅱ型免疫反应)[14]。现有资料表明:各类 CHB患者以Th2型反应为主,在此基础上,肝脏的炎症活动随着Th1型免疫反应的波动而波动,Th1型免疫反应与肝脏炎症的活动密切相关[15-17]。其机制可能为:Th1型细胞活化后,分泌IL-2,IFN-γ等Th1型细胞因子增多,它们能增强NK细胞、巨噬细胞以及特异性的CTL等免疫细胞的活性,使免疫攻击加强;增加肝细胞表面的HLA-I类分子表达,提高肝细胞对免疫细胞的细胞毒作用的敏感性;另外,还能够加强趋化活性,吸引炎性细胞聚集,加重炎症反应。这样,Th1型反应在促进细胞免疫反应,清除病毒的同时,还会加剧肝细胞的炎症损伤,致使病情发展加重。这也能解释本研究中随着CHB活动程度的加剧Th1、Tc1细胞逐渐增多。
本研究通过流式细胞术对外周血Th1/Th2、Tc1/Tc2细胞失衡与乙型肝炎病情转归的关系进行分析,探讨免疫平衡机制在乙型肝炎发生、发展、转归和预后中的作用。由于流式细胞技术日益成熟,外周血Th1/Th2、Tc1/Tc2有望成为判断乙型肝炎病情、预后及治疗疗效的重要指标,具有广泛的临床应用前景。由于免疫失衡有着复杂的机制,其进一步的分子生物学机制尚待阐明。
1 Mosmann TR,Cherwinski H,Bond MW,et al.Two types of murine helper T cells clone.I.Definition according to profiles of lymphokine activities and secreted proteins[J].J Immunol,1986,136:2348 -2357.
2 Mosmann TR,Sad S.The expanding universe of T-cell subsets.Th1,Th2 and more[J].Immunol Today,1996,17(3):138-146.
3 Bertoletti A,D'Elios MM,Boni C,et al.Different cytokine profiles of intraphepatic T cells in chronic hepatitis B and hepatitis C virus infec-tions[J].Gastroenterology,1997,112:193-199.
4 王娟华,谢志萍,裴浩,等.HBV慢性感染患者外周血Th1/Th2(Tc1/Tc2)细胞IFN-γ和IL-4的表达及其临床意义 [J].第三军医大学学报,2004,26(18):1646-1649.
5 Jung MC,Hartmann B,Gerlach JT,et al.Virus-specific lymphokine production differs quantitatively butnotqualitatively in acute and chronic hepatitis B infection[J].Virology,1999,261(2):165-172.
6 詹爱琴,刘佩芝,左维泽.慢性乙型肝炎患者外周血CD+4CD+25调节性T细胞与转化生长因子β1水平变化及其意义[J].中国全科医学,2010,13(12):4066.
7 Ganem D,Prince AM.Hepatitis B virus infection natural history and clinical consequrnces[J].N Engl JMed,2004,350(3):1118 -1129.
8 Lu FM,zhuang H.Managementof hepatitis B in China[J].Chin Med J,2009,122(1):1-2.
9 Chisari FV,FerrariC.Hepatitis B virus immunopathogenesis[J].Annu Rev Immunol,1995,13:29 -60.
10 Tsai SL,Sheen IS,Chien RN,et al.Activation of Th1 immunity is a common immunemechanism for the successful treatment of hepatitis B and C:tetramer assay and therapeutic implications[J].J Biomed Sci,2003,10(1):120 -135.
11 Ando K,Moriyama T,Guidotti LG,et al.Mechanisms of class I restricted immunopathology.A transgenic mousemodel of fulminant hepatitis[J].JExp Med,1993,178(5):1541-1554.
12 Kimura K,Ando K,Tomita E,et al.Elevated intracellular IFN -gamma levels in circulating CD8+lymphocytes in patients with fulminant hepatitis[J].JHepatol,1999,31(4):579-583.
13 王滨,修岩.T细胞亚群、白细胞介素、TNF-α在乙肝后肝硬化中的临床意义[J].中国误诊学杂志,2009,9(16):3856.
14 赵武述.免疫平衡研究及其临床意义[M].北京:科学出版社,2005:90-106.
15 姜荣龙,卢桥生,侯金林,等.辅助性T细胞极化群体在慢性乙型肝炎病毒感染中的作用[J].中华医学杂志,2000,80(10):741.
16 Livingston BD,Alexander J,CrimiC,etal.Altered helper T lymphocyte function associated with chronic hepatitis B virus infection and its role in response to therapeutic vaccination in humans [J].JImmunol,1999,162(5):3088-3095.
17 任桂芳,李兵顺,王慰,等.乙型肝炎病毒携带者T细胞亚群检测及其与肝组织病变程度的关系[J].疑难病杂志,2009,8(7):403.

