蛛网膜下腔出血后血管痉挛与S100b基因表达的相关性
谷志龙,杨福义,杨卫东,张 瑶
(佳木斯大学附属第一医院神经外科,黑龙江佳木斯 154003)
血管痉挛是蛛网膜下腔出血的严重并发症之一,能造成血脑屏障的变化,导致神经细胞的水肿、变性坏死等病理变化[1],严重影响患者的预后,乃至死亡。S100b含量与血管痉挛的发生密切相关。但以往的研究仅停留在检测血浆及脑脊液中S100b浓度的水平,本实验采用RT-PCR法对S100b基因进行检测,并利用Western-blot技术对大鼠基底动脉组织中的S100b蛋白进行检测,进一步的探讨S100b基因表达水平和血管痉挛的相关性。
1 材料与方法
1.1 主要试剂及仪器
4%多聚甲醛、10%水合三氯乙醛、RT-PCR试剂盒、DEPC 、Trizol液、引物(大连宝生物)和DNA marker。兔抗大鼠S100b抗体(SANTA CRUZ),辣根酶标记羊抗兔二抗(中杉金桥),内参β-actin,蛋白质marker,PVDF膜(碧云天)。大鼠S100b基因片段扩增的引物序列,上游5'-GCCCTCATTGATGTCTTCC-3';下游 3'-TCCTTTAGT TTCTCGTCCTTC-5',扩增引物长度为 130bp;βactin基因片段扩增的引物序列,上游 5'-TGTCACCAACTGGGACGATA-3';下游 3'-GCAACTGTAGGCATTTCTGG-5',扩增引物长度为 652bp。电泳仪、PCR仪、DU-800蛋白核酸分析仪、PAGE凝胶电泳仪、凝胶成像系统、转膜仪、联科发光试剂盒等。
1.2 方法
①将Wistar大鼠腹腔麻醉,备皮消毒。断尾取血 0.3mL,经环枕膜垂直进针2.5mm后缓慢注入枕大池,注血速度控制在0.lmL/min以内,缝合切口,消毒。假手术组,用等量的生理盐水做相同处理。术后大鼠尽量保持头低俯卧位为0.lmL/min,缝合切口,消毒。
②3d后断髓处死大鼠,通过后颈部取出含有脑干的基底动脉,一部分放置在液氮中保存,用于基因和蛋白的检测,另一部分放置在多聚甲醛中固定1d。经过固定、浸润、脱水、透明后包埋,每组各标本均切4张,厚度为 7μ m,进行 HE染色。
③基底动脉组织一部分用于组织匀浆的制备;一部分立即放入液氮速冻后,在-80℃保存备用。取基底动脉组织100mg于无菌匀浆器中,加冰生理盐水1mL,置于冰上匀浆。离心后,取上清液制成1%的组织匀浆。S100b基因的表达:RT-PCR法。大鼠基底动脉组织RNA,测280nm/260nm OD值后即进行逆转录合成cDNA。扩增产物用2.0%琼脂糖凝胶电泳分离,TB染色,凝胶成像仪成像后用Tannon Gis软件分析。基底动脉组织中 S100b蛋白的表达:Western Blot法检测检。提取大鼠基底动脉组织总蛋白,检测蛋白含量:采用BCA法,通过PAGE凝胶电泳分离蛋白,各孔上样体积20μ L,电泳约1.5h后取胶,根据M arker,切取10KD大小蛋白位置的胶,半干法在转膜仪上转膜,100mA流,60min。转膜后将膜置于5%脱脂奶粉中封闭1.5h,经过一抗孵育,4℃冰箱过夜,取出后用TBST洗涤3次,各 10min,二抗室温孵育1.5h后,TBST洗涤3次,各10min,ECL发光液显色,曝光,通过Tannon Gis软件分析,测光密度值。
1.3 统计学分析
2 结果
2.1 常规HE染色镜下观察
大鼠基底动脉经HE染色后发现:正常对照组,生理盐水组可见动脉内膜完整,内皮细胞排列紧密;手术组出现内皮细胞褶皱、变性,平滑肌细胞肥大,可见炎性细胞浸润,且管腔直径明显小于正常对照组和生理盐水组,见图1。
2.2 各组大鼠基底动脉中S100B基因及蛋白表达情况
S100b mRNA及蛋白在对照组和假手术组中均有微量表达,且差异不显著(P>0.05);与假手术组相比,手术组表达明显(P<0.01)。
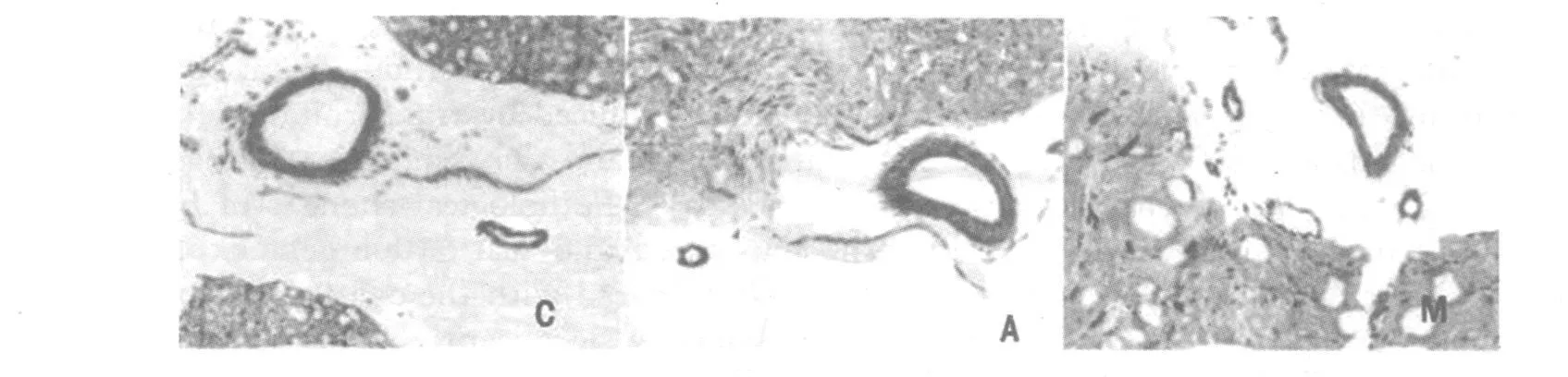
图1 Wistar大鼠基底动脉观察(HE×200)
表1 S100b基因及蛋白在基底动脉中的表达分析结果(± s)

表1 S100b基因及蛋白在基底动脉中的表达分析结果(± s)
注※与对照组比较,P>0.05;# 与假手术组比较,P<0.01。
_组别 n S100b/β-actin(mRNA) S100b/β-actin(Protein)对照组 10 0.037±0.043 0.2092±0.0626 0.0243±0.0530 0.1792±0.0734假手术组 10 0.051±0.0471※ 0.3602±0.0822 0.0683±0.06811# 0.2461±0.0836_手术组 8 0.303±0.0812※ 0.8709±0.0751_________________0.5291±0.094_______________________________62#_0.8479±0.0829

图2 S100b mRNA RT-PCR后电泳图
3 讨论
S100b蛋白是Moore等[2]人在1965年首先在牛的脑组织发现的,此种蛋白能完全溶解在中性饱和硫酸铵中而因此得名。高浓度的S100b具有神经毒性,浓度大小与脑血管疾病,颅脑外伤及其他神经系统疾病密切相关。我们的实验发现S100b基因表达与蛛网膜下腔出血后的脑血管痉挛密切相关。
目前蛛网膜下腔出血动物模型的制备主要有:穿刺法[3]是阻断颈总动脉后通过颈总动脉进入颈内动脉并刺破分叉处制作而成,手术成熟,简单,无需开颅,但手术过程中易造成短暂性脑缺血,诱发脑梗塞,术后动物死亡率高;血管撕裂法,穿刺法以及注血法。血管撕裂法主要是撕裂大脑中主要大动脉来模拟蛛网膜下腔出血,该方法的出血时间,出血速度,出血量不易被控制,且模型制备过程中破损了蛛网膜的完整性,导致硬膜下血肿;而注血法[4]无需破坏动脉壁,通过脑池如枕大池,视交叉池,将血液直接注入蛛网膜下腔,该方法具有操作简单、直接、重复性高,出血量可控制的优点。因此本实验利用枕大池注血法建立蛛网膜下腔出血模型,通过术后3d对大鼠基底动脉进行HE染色,镜下发现血管管腔狭窄、内皮细胞变性、平滑肌细胞肥大,同时伴有外膜炎性细胞浸润的病理变化。S100b是一种酸性钙结合蛋白,广泛存在于哺乳动物的中枢神经系统内的星型角质细胞中,正常体内含微量S100b蛋白,通过和钙离子结合,激活脑果糖1,6-2磷酸醛缩酶和葡萄糖磷酸变位酶,进而调节神经细胞的能量代谢,对神经的生长和修复起到促进作用[5];高浓度的S100b在中枢神经系统内具有神经毒性,通过激活神经胶质细胞内的一氧化氮介导的死亡途径引起神经元的死亡。S100b通过促进细胞内PI(磷脂酰肌醇)水解,其分解产物IP3(三磷酸肌醇)作用于肌浆网和滑面内质网上的钙通道,使钙通道开放,释放Ca2+。Ca2+一方面和S100b结合引起其构象改变进而和细胞膜结合,使平滑肌纤维染色增强;另一方面和钙调蛋白(CaM)结合,通过磷酸化肌球蛋白轻链激酶(M LCK)使其失去对肌动蛋白ATP酶的抑制,促使αaction肌丝滑行,引起脑血管平滑肌收缩,痉挛[6]。综上所述,蛛网膜下腔出血后S100b的表达上调,高浓度的S100b蛋白通过激活神经胶质细胞内的一氧化氮介导的死亡途径引起神经元的死亡,脑血管平滑肌痉挛。但是有关于蛛网膜下腔出血后通过何种机制引起脑血管痉挛还有待于进一步的研究。
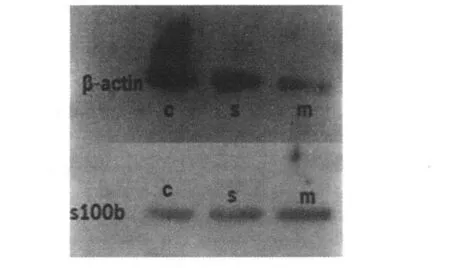
图3 S100b蛋白印迹图
[1]D ietrich H H,Dacey R C Jr.Molecu lar keys to the problems of cerebral vasospasm[J].Neurosurgery,2000,46(3):517-530
[2]M oore BM.A solube protein characteristic of the nervous system[J].Biochem Biophy s Res Commun,1965,19(6):739-744
[3]Weir B.VasosPasm in response to repeated subarachnoid hemorrhage in the monkey[J].J NeurosUrg,1970,33:395
[4]Piepgras A.Characterization of an anterior circulation rat subaraehnoid hemorrhage model[J].Stroke,1995,26:395
[5]Donato R.Intracellular and extracellular roles of S100 protein[J].Microsc Res Tech,2003,60(6):540-551
[6]Lefranc F,Golzarian J,Chevalie C,et al.Expression of members of the calcium-binding S-100 protein family in a rat model of cerebral basilar artery vasospasm[J].J Neurosurg,2002,97(2):408-415

