添加稻草和选择性抑制剂的红壤旱地和稻田可培养微生物的变化
张洪霞 ,肖和艾 ,谭周进 ,杨喜爱 ,盛 荣 ,葛体达 ,黄道友
(1.湖南农业大学生物安全科技学院,湖南长沙410128;2.中国科学院亚热带农业生态研究所亚热带农业生态过程重点实验室,湖南长沙410125;3.湖南中医药大学,湖南 长沙410208;4.中国农业科学院麻类研究所,湖南长沙410205)
红壤是我国南方主要类型耕作土壤,占全国总耕地面积的28%[1]。红壤发育完全,淋溶强烈,养分淋失严重,土壤有机质和养分含量低,特别是红壤对磷素具有强烈的固定作用,施用磷肥的作物利用率很低[2,3],因此提高红壤土壤有机质含量和养分有效性对于该区域农业可持续发展具有重要意义。土壤微生物对土壤有机质与养分循环和转化起着重要作用[4]。已有研究表明施用稻草可显著提高红壤耕地土壤有机质含量以及微生物生物量碳和生物量磷[5],促进微生物对土壤固定态无机磷的转化作用,提高土壤磷素的作物有效性[3]。Rottmanna等[6]研究表明施入玉米秸秆可使旱地土壤麦角固醇(真菌指示物)含量提高5~7倍,麦角固醇含量占微生物量碳的比例提高3~4倍,说明施入玉米秸秆可提高土壤真菌的比例。Bossuyt等[7]进行的旱地土壤培养试验结果表明,添加小麦秸秆的C/N比较高时土壤真菌生物量增加幅度大于细菌生物量,而添加小麦秸秆的C/N比较低时土壤细菌生物量增加幅度大于真菌生物量。Doran[8]田间试验结果表明施用玉米秸秆可使旱地土壤细菌、放线菌和真菌数量增加2~6倍,硝化细菌和反硝化细菌数量分别增加2~20倍和3~43倍,真菌对施入玉米秸秆的响应受到细菌和放线菌的竞争影响,田间条件下土壤微生物群落对施入秸秆的响应与土壤水分含量有关。许仁良等[9]研究表明施用麦秸后水稻成熟期稻田土壤细菌和真菌数量明显提高,真菌数量的增加幅度较细菌更大。盛荣等[10]田间试验结果表明,施NPK+稻草覆盖可提高红壤旱地土壤真菌数量,而对土壤细菌数量影响较小,而稻田土壤中施NPK与稻草和绿肥后,土壤细菌数量的增加幅度远大于真菌。但也有研究表明施用稻草后在早稻收获期和晚稻齐穗期时稻田土壤真菌数量略有下降[11]。然而,施用稻草对红壤旱地和稻田土壤微生物群落的影响以及土壤中稻草分解和转化主要功能微生物群落仍需深入研究。
本研究选择典型的红壤旱地和稻田土壤,添加稻草及细菌和真菌抑制剂进行室内模拟培养,以探讨添加稻草对红壤旱地和淹水稻田土壤微生物群落的影响及其机理。旨在为深入研究红壤旱地和稻田土壤有机质与磷素循环和转化的功能微生物奠定初步基础。
1 材料与方法
1.1 供试材料
选择位于湖南桃源盘塘典型第四纪红土母质发育的旱地和稻田土壤,旱地土取自始于2000年的田间定位试验地的不施肥处理,作物为甘薯-油菜,稻田土一直维持双季稻耕作管理。取0cm~20cm表层土壤,除去其中可见动植物残体,过筛(孔径<2mm),混匀,用去离子水调节土壤含水量至饱和持水量(WHC)的40%,置密封的塑料桶内,在25℃黑暗条件下预培养7 d~10 d,桶内放适量水以保持相对湿度为100%,并在桶内放1小杯1mol/LNaOH溶液以吸收土壤呼吸产生的CO2,经预培养后的新鲜土壤用于培养试验。另取部分土样风干,分别过20目和100目筛,用于测定土壤基本特性。供试土壤基本特性见表1。

表1 供试土壤来源和基本特性
收获晒干的稻草置45℃下烘干,粉碎后过60目筛,密封保存备用。试验用稻草碳氮磷含量分别为426.5 g/kg、17.43 g/kg和 1.57 g/kg。
真菌抑制剂放线菌酮(Actidione,纯度 >94%),Sigma公司产,细菌抑制剂四环素(Tetracycline,干基效力>900 mg/mg)和链霉素(Streptomycin sulphate,干基效力 650~850 U/mg),均购自 Amresco公司。
1.2 试验设置
旱地土和稻田土均设4个处理:①对照(CK;不添加稻草和抑制剂)、②添加稻草(Str)、③添加稻草+放线菌酮(Str+Ac)、④添加稻草 +四环素与链霉素(Str+Sm+Tc),每个处理4次重复。取经预培养的相当于500 g烘干土重的新鲜土样16份,稻草添加量按5000mg C/kg,直接与土样彻底混匀;选择性抑制剂加入量为放线菌酮200mg/kg、链霉素200 mg/kg、四环素10mg/kg,分别配成溶液加入土样中[12,13]。各处理用1%硫酸铵溶液补充至N 50mg/kg,用蒸馏水调节旱地土壤含水量至45%WHC、稻田土壤含水量至105%WHC,分别装入1 L塑料杯中置于50 L塑料桶(底部加少量水以保持100%湿度、并放置1小杯1mol/LNaOH溶液吸收CO2),密封后置于25±1℃、黑暗条件下培养45 d,每3 d通风换气1次以保证微生物生长所需充足的氧气。分别于培养的第0 d、6d、12d、18d、24d、30 d和 45d 将各重复的土壤混合均匀后,取相当于烘干土重10g的土壤样品,测定土壤可培养细菌和真菌数量。
1.3 测定方法
1.3.1土壤细菌和真菌 旱地和淹水稻田土壤细菌和真菌测定采用改进的稀释平板计数培养法[4],细菌和真菌培养分别采用牛肉膏蛋白胨培养基和马丁-孟加拉红培养基。为提高测定结果的准确度和精确度,制备土壤10-1悬浮液时取相当于烘干重10g的新鲜土壤,加入的无菌水与土壤中水之和为90ml;采用BIOHITeLINE移液器进行土壤悬浮液稀释和接种。培养基灭菌后,细菌培养基加入放线菌酮(200mg/L),真菌培养基加入链霉素200mg/L和四环素10mg/L,以避免计数时细菌和真菌菌落的相互干扰。细菌于30℃黑暗条件下倒置培养,真菌于28℃黑暗倒置培养。细菌和真菌分别在培养的1 d~2 d和5 d计数。每个稀释度3次重复。
1.3.2土壤性质 土壤pH采用去离子水(土水比1:2.5,W/V)浸提15min,用Mettler toledo320 pH计测定。土壤有机碳测定采用重铬酸钾氧化法,土壤全氮和稻草碳、氮含量采用碳氮分析仪(Vario-MAX C/N)测定,土壤和稻草全磷含量分别采用NaOH融熔法和H2O2-H2SO4消化,操作方法按南京土壤研究所编[14]《土壤理化分析》。
1.4 数据处理
数据均为4次重复的平均值,以烘干土壤重量(105℃,24 h)计。采用Excel2003和SPSS 16.0进行数据处理与各处理间土壤细菌和真菌数量差异显著性分析。
2 结果分析与讨论
2.1 旱地和淹水稻田土壤可培养细菌和真菌数量的变化
2.1.1旱地土壤细菌 培养开始时(第0 d),旱地土壤可培养细菌数量为1.83×106cfu/g,整个培养期间(0 d~45 d)对照(CK)处理土壤可培养细菌数量测定的结果很接近(1.79×106cfu/g~1.87×106cfu/g)(图1a)。这说明当不添加外源有机底物时培养过程中土壤细菌数量保持不变。在培养第6 d时,添加稻草的各处理土壤可培养细菌数量与CK处理比较迅速增加,添加稻草(Str)处理在培养第18 d时土壤细菌数量达到最大值11.2×106cfu/g,此后呈下降趋势。添加稻草和放线菌酮(Str+Ac)处理在培养第12 d时土壤细菌数量就达到最大值16.4×106cfu/g,此后保持稳定,培养第18 d后呈下降趋势。添加稻草与链霉素和四环素(Str+Sm+Tc)处理在培养第6 d时土壤细菌数量达到9.6×106cfu/g,此后呈缓慢上升趋势,但增幅较小。
在培养的6 d~45 d期间,Str处理土壤可培养细菌数比CK处理增加271.4%~518.8%,差异均达极显著水平(p<0.01),这说明添加有机底物(稻草)后,红壤旱地土壤可培养细菌数量明显增加;Str+Ac处理土壤可培养细菌数量在培养的6 d~45 d期间比Str处理增加34.1%~81.4%,差异均达极显著水平(p<0.01),表明在添加稻草土壤中抑制真菌生长繁殖可使土壤细菌数量明显提高;添加稻草与链霉素和四环素(Str+Sm+Tc)处理土壤可培养细菌数量在培养6 d~45 d期间比Str处理下降14.3%~43.5%,差异均达显著水平(p<0.05),而比CK处理增加193.0%~273.8%,差异达极显著水平(p<0.01),这表明细菌抑制剂(链霉素和四环素)不能完全抑制添加稻草土壤中细菌生长和繁殖,与Colinas等[15]的研究结果相似。林启美[16]发现放线菌酮和链霉素分别对添加葡萄糖土壤中真菌和细菌的抑制率约为50%,本研究中链霉素和四环素对添加稻草土壤中可培养细菌的抑制率(14.3%~43.5%)低于该值。
2.1.2旱地土壤真菌 培养开始时(第0 d)土壤可培养真菌数量为0.11×105cfu/g,在0 d~45 d培养期间内,CK处理土壤可培养真菌数量处于基本稳定状态(0.11×105cfu/g~0.12×105cfu/g)(图1b)。这说明培养条件下不添加外源有机底物土壤真菌数量保持不变。Str处理在培养第6 d时土壤可培养真菌数增加到3.72×105cfu/g,此后基本趋于稳定,第45 d时略有下降,为3.14×105cfu/g。Str+Sm+Tc处理土壤可培养真菌在培养第6 d时达到4.65×105cfu/g,第18 d达最大值5.38×105cfu/g,此后呈下降趋势。Str+Ac处理土壤可培养真菌在培养第6 d时仅为0.47×105cfu/g,此后迅速上升,至第18 d达到3.56×105cfu/g,然后基本保持稳定。这说明旱地土壤中添加稻草时放线菌酮仅在培养前期(0 d~12 d)对真菌具有较强的抑制作用,第6 d和第12 d时其抑制率分别为87.2%和59.2%,而第18 d以后其抑制作用较小,抑制率小于9.0%。
在培养的6 d~45 d期间,Str处理土壤可培养真菌数量比CK处理增加2900%~3608%,差异均达极显著水平(p<0.01),说明添加稻草能使旱地真菌数量大幅度增加。与上述添加稻草(Str)处理的旱地土壤细菌数量比CK处理的增加比例(271.4%~518.8%)对比,添加稻草后旱地土壤真菌数量的增加幅度远大于细菌数量。这说明添加稻草后旱地土壤中真菌对稻草的转化作用可能大于细菌。许仁良等[9]田间试验结果表明施用麦秸处理在水稻成熟期土壤(非根际)细菌和真菌数量均显著高于不施麦秸的对照处理,且真菌数量的增加幅度大于细菌。这与本试验的结果是一致的。He等[17]研究表明添加有机肥料对旱地土壤可培养真菌数量的增加效应大于细菌,土壤真菌比细菌对土壤肥力更敏感。培养6 d~45 d期间,Str+Sm+Tc处理土壤可培养真菌数量比Str处理增加17.1%~37.6%,差异均达极显著水平(p<0.01)。说明旱地土壤添加稻草时抑制细菌的生长繁殖可使土壤真菌数量明显增加。
2.1.3淹水稻田土壤细菌 稻田土壤在淹水培养试验开始时(第0 d),土壤可培养细菌数量为2.36×106cfu/g,培养第6d时CK处理土壤可培养细菌数量下降到1.52×106cfu/g(图1c)。这可能与土壤水分状况由饱和持水量(WHC)的45%改变为淹水状态(105%)有关,淹水条件下抑制了土壤好氧性细菌的生长繁殖。培养6 d~45 d期间CK处理土壤细菌数量基本保持稳定(1.52×106cfu/g~1.76×106cfu/g),差异不显著。此外,对照(CK)处理的淹水稻田与旱地土壤的细菌数量基本相同。Str处理在培养第6 d迅速增加,至培养第18 d达到最大值为7.21×106cfu/g,此后呈下降趋势,至培养第45 d时下降到3.79×106cfu/g。Str+Ac处理除培养第6 d时比Str处理低34.8%外,培养12 d~45 d土壤细菌数量的变化与Str处理基本相同。Str+Sm+Tc处理土壤可培养细菌数量在培养第6d时为1.06×106cfu/g,略低于CK处理,培养至第12 d时高于CK处理为2.3×106cfu/g,此后呈缓慢上升趋势,与上述旱地土壤中Str+Sm+Tc处理的细菌变化基本相同。
培养第6 d~45 d期间,Str和Str+Ac处理土壤可培养细菌数量比CK处理分别增加115.3%~362.2%和90.8%~326.3%,差异均达极显著水平(p<0.01)。说明添加稻草可使淹水稻田土壤细菌数量大幅度增加。本研究淹水条件稻田土壤添加稻草比对照处理细菌数量的增加比例,远大于许仁良等[9]田间条件下稻田施麦秸引起的土壤细菌数量增加的比例(约为20%),这可能与后者是在水稻处于晒田落干状态的成熟期测定土壤细菌数量有关。Str+Sm+Tc处理土壤可培养细菌数量比Str处理下降39.0%~76.2%,差异达极显著水平(p<0.01)。说明细菌抑制剂(四环素和链霉素)对淹水稻田土壤细菌的抑制作用大于旱地土壤(14.3%~43.5%)。
2.1.4淹水稻田土壤真菌 稻田土壤淹水培养开始时(第0 d),土壤可培养真菌数量为1.25×104cfu0/g,培养第6 d土壤可培养真菌数略有下降为1.02×104cfu/g,此后基本趋于稳定(图1 d)。说明试验采用的稻田土壤和上述旱地土壤真菌数量基本相同。培养6 d~45 d期间,Str处理土壤可培养真菌数量在比CK处理下降5.78%~27.8%,差异达显著水平(p<0.05)。Str+Ac处理土壤可培养真菌数量与Str处理基本相同。这说明添加稻草使淹水稻田土壤可培养真菌数量降低。可能是稻田土壤淹水条件下,添加稻草时细菌的大量生长繁殖从而抑制了真菌的生长。Str+Sm+Tc处理在培养的6d~24 d土壤可培养真菌数量比Str处理增加10.3%~30.2%,差异达显著水平(p<0.05),培养30 d~45 d土壤真菌数量略高于Str处理,差异不显著。这进一步说明了添加稻草淹水稻田土壤抑制细菌生长后,可减少土壤真菌数量下降,随着细菌抑制剂作用的减弱,细菌数量增加时,真菌数量又进一步降低。阐明淹水稻田土壤细菌数量增加在一定程度上抑制真菌的生长繁殖。
由此可见,淹水稻田土壤中稻草分解和转化的主要微生物为细菌,淹水条件下土壤细菌的生长和繁殖能够抑制真菌。由于土壤真菌通常为好气性菌[11],可能由于稻田淹水状态低氧化还原电位条件下不利于真菌的生长繁殖,使淹水稻田土壤真菌对稻草的分解作用差,而土壤细菌则有一些种类在氧分压较低的环境中仍能正常生长[18],所以可能细菌更适合在淹水条件生长繁殖。刘岳艳等[19]也发现淹水稻田土壤的真菌特征脂肪酸(18:2w6,9c)所占比例小于土壤含水量为饱和持水量(WHC)60%的土壤和淹水晾干的土壤,而淹水稻田土壤细菌与真菌特征脂肪酸比率增大,土壤水分变化对土壤微生物群落及其功能有较大影响。
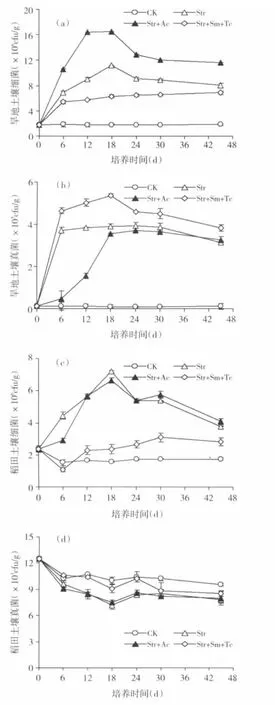
图1 添加稻草和选择性抑制剂的旱地土壤可培养细菌(a)、真菌(b)和淹水稻田土壤可培养细菌(c)、真菌(d)数量变化
2.2 旱地和淹水稻田土壤可培养细菌与真菌(B/F)比率的变化
通常土壤细菌和真菌的比率可作为土壤微生物群落变化的指标[20,21]。在旱地土壤中,培养第0d基础土壤B/F比率为163:1,添加稻草的3个处理B/F比率为158:1(表2)。培养期内(6 d~45 d)CK的B/F比率保持相对稳定(149:1~171:1);而Str和Str+Sm+Tc处理的B/F比率迅速下降,分别为18:1~29:1和11:1~18:1,说明添加稻草的旱地土壤真菌数量相对于细菌有大幅度的增加,添加细菌抑制剂使真菌数量增加的幅度更大,旱地土壤真菌比细菌更能有效利用有机底物(稻草)而快速生长繁殖,酸性红壤中真菌的生长繁殖对稻草分解作用的响应较细菌更强,更容易形成优势菌群。Str+Ac处理的B/F比率在培养第6 d高于CK处理,此后逐渐降低并远低于CK处理,培养24 d后B/F比率趋于稳定(33:1~35:1)。说明真菌受抑制能大量增加细菌数量,但放线菌酮对旱地土壤真菌的抑制作用期较短,在培养第18 d后对真菌的抑制作用较小。
在淹水稻田土壤中,培养第0 d时稻田基础土壤B/F比率为189:1,添加稻草的3个处理B/F比率为183:1。培养6 d~45 d期间,CK处理土壤B/F比率保持相对稳定(149:1~184:1);Str和Str+Ac处理的B/F比率在培养的6 d~45 d分别增加到463:1~999:1和319:1~888:1。说明添加稻草后,由于淹水稻田土壤细菌数量的大量增加而使B/F比率增大,细菌较适宜在淹水稻田土壤分解稻草而生长繁殖,形成优势菌群。Str+Sm+Tc处理的B/F比率在培养第6 d后明显高于CK处理,而大幅度低于Str处理B/F比率。这说明细菌抑制剂能有效降低施稻草淹水稻田土壤细菌与真菌数量的比率。此外,本试验中不添加稻草和抑制剂的淹水稻田土壤和旱地土壤B/F比率很接近。
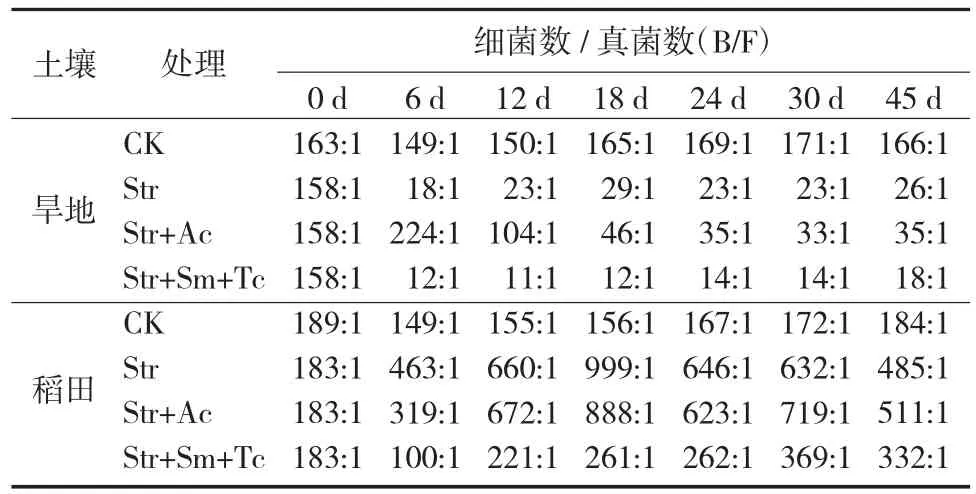
表2 培养45 d期间各处理旱地和淹水稻田土壤可培养细菌与真菌数量(B/F)比率变化
3 结论
施入稻草可促进红壤旱地土壤可培养细菌和真菌数量显著增加,且真菌数量增加的比例远大于细菌,阐明细菌和真菌均参与旱地土壤中稻草的分解和转化,但真菌占主要作用。淹水红壤稻田土壤中施入稻草时,土壤可培养细菌数量显著增加,而土壤可培养真菌数量略有下降,可以推断淹水稻田中稻草分解和转化的主要微生物为细菌。添加稻草使旱地和稻田土壤微生物群落发生较大变化,旱地土壤中细菌和真菌比率大幅度降低,而淹水稻田土壤中细菌和真菌比率明显升高。四环素和链霉素对添加有机底物土壤中细菌生长繁殖仅有部分抑制作用,对添加有机底物的淹水稻田土壤细菌抑制作用大于旱地土壤;放线菌酮对添加有机底物的旱地土壤中真菌生长繁殖仅在前几天具有显著抑制作用。
[1] 王伯仁,李冬初,黄晶.红壤长期肥料定位试验中土壤磷素肥力的演变[J].水土保持学报,2008,22(5):96-101.
[2]Wu J,HuangM,XiaoHA,etal.Dynamicsinmicrobial immobilization and transformations of phosphorus in highly weathered subtropical soil following organic amendments[J].Plant and Soil,2007,290:333-342.
[3] 丁龙君,肖和艾,吴金水,等.选择性抑菌剂对添加稻草红壤旱土团聚体磷素微生物转化的影响[J].应用生态学报,2010,21(7):1759-1765.
[4] 吴金水,林启美,黄巧云,等.土壤微生物生物量测定方法及其应用[M].气象出版社,2006.
[5]Zhu HH,Wu J,Huang DY,etal.Improving fertility and productivity ofahighly-weatheredupland soilinsubtropicalChinabyincorporating rice straw[J].Plantand Soil,2010(331):427-437.
[6]Rottmanna N,Dyckmans J,Joergensen RG.Microbial use and decomposition ofmaize leaf straw incubated in packed soil columns at different depths[J].European Journal of Soil Biology,2010(46):27-33.
[7] Bossuyt H,Denef K,Six J,et al.Influence ofmicrobial populations and residue quality on aggregate stability[J].Applied Soil Ecology,2001(16):195-208.
[8] Doran JW.Microbial changes associated with reduced management with reduced tillage[J].Soil Science Society of America Journal,1980(44):518-524.
[9] 许仁良,王建峰,张国良,等.秸秆、有机肥及氮肥配合使用对水稻土微生物和有机质含量的影响[J].生态学报,2010,30(13):3584-3590.
[10] 盛荣,肖和艾,丁龙君,等.施肥对红壤旱地和稻田土壤可培养微生物和微生物生物量磷的影响[J].农业现代化研究,2010,31(5):626-629.
[11] 谭周进,李倩,陈冬林,等.稻草还田对晚稻土微生物及酶活性的影响[J].生态学报,2006,26(10):3385-3392.
[12]McLaughlin MJ,Alston AM,Martin JK.Measurementofphosphorus in the soilmicrobialbiomass:amodified procedure for field soils[J].SoilBiologyand Biochemistry,1986,18(4):437-443.
[13]Wu J,He ZL,WeiWX.Quantifyingmicrobial biomass phosphorus in acid soils[J].Biologyand FertilityofSoils,2000(32):500-507.
[14] 中国科学院南京土壤研究所编,土壤理化分析[M].上海:科学技术出版社,1978.
[15] Colinas C,Ingham E,Molina R.Population responses of target and non-target forest soil organisms to selected biocides[J].Soil Biology and Biochemistry,1994,26(1):41-47.
[16]林启美.选择性呼吸抑制技术在土壤细菌和真菌生物量测定中的应用[J].生态学报,1999,19(6):921-926.
[17] He JZ,Zheng Y,Chen RC,etal.Microbialcomposition and diversity of an upland red soil under long-term fertilization treatments as revealedbyculture-dependentandculture-independentapproaches[J].JSoils Sediments,2008(8):349-358.
[18] 王英.淹水和旱作稻田土壤中微生物群落多样性的研究[D].南京:南京农业大学,2006.
[19] 刘岳燕,姚槐应,黄昌勇.水分条件对水稻土微生物群落多样性及活性的影响[J].土壤学报,2006,43(5):828-834.
[20] 裴雪霞,周卫,梁国庆,等.长期施肥对黄棕壤性水稻土生物学特性的影响[J].中国农业科学,2010,43(20):4198-4206.
[21] de Vries FT,Hoffland E,van Eekeren N,etal.Fungal/bacterial ratios in grasslandswith contrasting nitrogenmanagement[J].Soil Biology and Biochemistry,2006,38(8):2092-2103.

