黄芪皂苷Ⅳ对大鼠脑缺血/再灌注损伤海马神经元凋亡及相关基因表达的影响
王莹,李文媛,郑海星,佟晓杰
(1.牡丹江医学院解剖教研室,牡丹江157011;2.中国医科大学解剖教研室)
脑缺血后恢复脑血流是治疗脑缺血最关键的方法,但再灌注后可加重缺血脑组织的损伤,这种损伤以凋亡为主,因此减少缺血/再灌注后神经元凋亡为重要的脑保护机制。细胞凋亡是由特定的基因调控的,Bcl-2家族在细胞凋亡过程中发挥重要作用,其包括促凋亡基因Bax和抑凋亡基因Bcl-2,这两种基因相互协调,共同对缺血神经元的凋亡进行调控[1]。黄芪是一种被广泛应用于治疗缺血性脑血管病的传统中药,具有补气升阳、利水退肿的功效[2-3]。黄芪皂苷Ⅳ是一种纯化小分子皂苷(分子量784),是黄芪的主要活性成分,有研究显示黄芪皂苷Ⅳ具有降压[4]调节机体免疫功能[5]、抗炎症[6]、镇静镇痛[7]、神经保护[2]、降低病毒活性[8]等多种药理作用。尽管黄芪皂苷Ⅳ在病理条件下能够发挥多种作用,但其在脑缺血再灌注后对细胞凋亡的影响仍不明确。本研究通过观察黄芪皂苷Ⅳ对CIR后大鼠海马神经元细胞凋亡及凋亡相关基因Bcl-2和Bax蛋白表达的影响,探讨黄芪皂苷Ⅳ对脑缺血再灌注损伤大鼠的神经保护作用。
1 材料与方法
1.1 动物 雄性 SD大鼠42只,清洁级,体质量280~320 g,购于中国医科大学实验动物中心(许可证号:SYXK[辽]2003-0013)。
1.2 试剂和药物 黄芪皂苷Ⅳ(西安赛邦医药),纯度98%。用时以0.9%氯化钠注射溶液配成质量浓度为1.0 g/L。尼莫地平注射液(河北医科大学制药厂),规格20 mg/100 ml,用时以0.9%氯化钠注射溶液配成质量浓度为0.1 g/L。Bcl-2、Bax多克隆抗体、免疫组织化学SP试剂盒、TUNEL试剂盒购于北京中山生物试剂公司。
1.3 动物模型制备与分组 大鼠按体质量分层,随机分为4组:假手术组(n=6)、模型组(n=12)、尼莫地平对照组(n=12)、黄芪皂苷Ⅳ组(n=12)。参照Longa等[10]的线栓改良法复制大鼠左侧大脑MCAO局灶性脑缺血模型。各组于缺血前5 min第1次给药,腹腔注射,缺血后12 h给药1次,共给药2次。黄芪皂苷Ⅳ给药剂量为20 mg/kg,尼莫地平注射液给药剂量为1 mg/kg,均为临床等效剂量。假手术组和模型组给予等体积0.9%氯化钠注射溶液。术后当日给大鼠饮水,次日开始自由饮食。
1.4 免疫组织化学检测 取材行冰冻切片,在视交叉后1~4 mm处冠状切面切开,在海马齿状平面连续冠状切片,片厚 4μm。0.5%过氧化氢孵育10 min;PBS漂洗3次,正常山羊血清37℃孵育15 min后,滴加稀释后的一抗 Bcl-2(1∶80)、Bax(1∶80),4 ℃ 过夜。滴加生物素标记体,30 min,37℃。滴加过氧化物-链霉素卵白素37℃,30 min。DAB显色液显色,苏木精复染。以PBS代替一抗作阴性对照。镜下观察并摄片。阳性率的定量分析:每个标本取4张切片,400倍光镜下每张切片在海马随机选5个阳性视野,目镜测微网400倍放大下为面积单位,计数网格中阳性细胞数,重复3次,取其平均值。
1.5 凋亡神经元的检测 采用原位末端TUNEL标记法检测。将甲醛固定大鼠海马组织标本常规脱水,石蜡包埋,连续切片,厚4μm,脱蜡后按照In situApoptosis Detection Kit说明书操作;阴性对照采用 pH 7.2 ~7.6,0.01 mol/L PBS 代替 TUNEL 反应液。阳性率的定量分析:每个标本取4张切片,每张切片在海马随机选5个视野,400倍光镜下应用目镜阳性细胞所占的百分比。细胞凋亡指数(AI)=凋亡阳性细胞总数/细胞总数。
1.6 统计学处理 所得数据以采用SPSS 13.0软件进行统计学分析,数据以均值±标准差(±s)表示,进行方差分析和t检验。
2 结果
2.1 免疫组织化学染色 Bcl-2、Bax阳性表达主要位于核膜,其次在内质网和线粒体外膜也有分布,因此阳性细胞胞质可见细小的棕黄色颗粒。假手术组大鼠脑组织中未见Bcl-2、Bax阳性表达。模型组Bcl-2、Bax阳性细胞表达较假手术组差异显著(P<0.01)。尼莫地平对照组Bcl-2、Bax蛋白表达与模型组无差异(P>0.05)。与模型组和尼莫地平对照组比较,黄芪皂苷Ⅳ组Bax蛋白表达明显下降(P<0.05),Bcl-2 蛋白表达(P <0.05)和 Bcl-2/Bax比值显著升高,见表1。
2.2 TUNEL检测结果 假手术组脑组织未见细胞凋亡。模型组、尼莫地平对照组、黄芪皂苷Ⅳ组均可见到海马CA1区细胞凋亡,凋亡细胞胞质呈棕褐色和棕黄色着色,胞核固缩颗粒深染,呈圆形、椭圆形及不规则形。模型组凋亡细胞指数较假手术组显著增加(P<0.01),黄芪皂苷Ⅳ组凋亡细胞指数明显少于模型组和尼莫地平对照组,差异有统计学意义(P <0.05),见表1。
表1 海马神经元细胞凋亡指数、Bcl-2、Bax阳性细胞表达情况(±s)
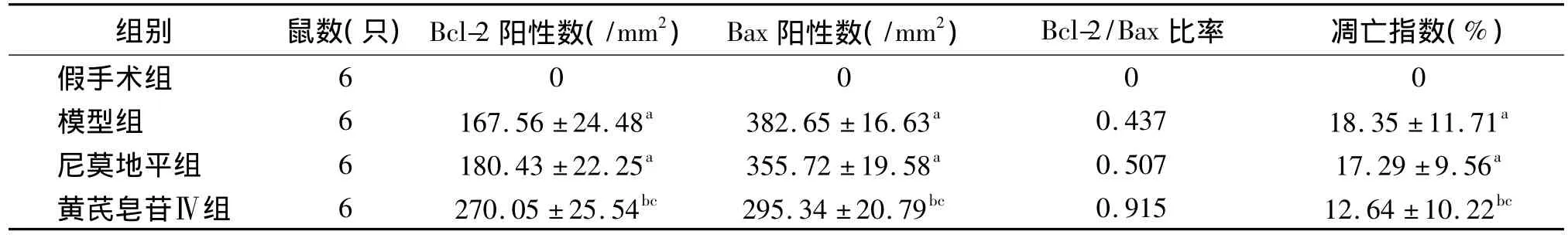
表1 海马神经元细胞凋亡指数、Bcl-2、Bax阳性细胞表达情况(±s)
注:与假手术组比较,a P<0.01;与模型组比较,b P<0.05;与尼莫地平组比较,c P<0.05
组别 鼠数(只)Bcl-2阳性数(/mm2) Bax阳性数(/mm2) Bcl-2/Bax比率 凋亡指数(%)假手术组60000模型组 6 167.56 ±24.48a 382.65 ±16.63a 0.437 18.35 ±11.71a尼莫地平组 6 180.43 ±22.25a 355.72 ±19.58a 0.507 17.29 ±9.56a黄芪皂苷Ⅳ组 6 270.05 ±25.54bc 295.34 ±20.79bc 0.915 12.64 ±10.22bc
3 讨论
脑缺血性损伤的机制和防治一直是该领域研究的热点,海马神经元对缺血具有选择性敏感,短暂性脑缺血即可导致该区神经元的迟发性死亡(DND),随着研究的深入,人们发现短暂脑缺血后海马出现DND与细胞凋亡密切相关。
作为细胞凋亡过程中最主要的调控基因之一,Bc1-2基因过度表达可特异性抑制细胞凋亡,在轴突的生长和再生中起关键作用[9],已有实验显示Bcl-2可作为脑损伤后的基因治疗[10],并与脑缺血损伤预后正相关[7]。而Bax基因的过度表达则可对抗Bc1-2对细胞凋亡的抑制作用,其高表达可能是脑损伤后细胞凋亡增加的主要原因,能够促进缺血区神经元死亡[9]。严重脑损伤大鼠脑组织 Bax表达明显增加,Bcl-2/Bax 比值下降[11]。Hara 等[12]认为Bc1-2/Bax比率决定细胞受到凋亡刺激信号后是生存还是凋亡。本研究表明,模型组可见到海马神经元Bcl-2和Bax表达较假手术组显著表达(P<0.01),且与凋亡分布一致,这与以往研究结果基本一致[13],提示两者与脑缺血损伤诱导的细胞凋亡密切相关。进一步观察发现,与尼莫地平对照组和模型组相比,黄芪皂苷Ⅳ能明显上调Bc1-2蛋白表达,下调Bax蛋白表达,升高Bc1-2/Bax比值,降低神经元细胞凋亡指数。
综上所述,黄芪皂苷Ⅳ能够抑制脑缺血再灌注损伤海马神经元细胞凋亡,其机制可能与上调Bcl-2表达,下调Bax表达,升高Bc1-2/Bax比值有关。对黄芪皂苷Ⅳ抗神经细胞凋亡机制详细分子机制可能有多种,本实验仅探索到其中的一小部分,如进行深入研究,可能会发现更多的途径及机制,为黄芪皂苷Ⅳ临床应用提供新的理论依据。
[1] 曲鹏,乔春萍,方秀斌.凋亡相关基因与脑缺血再灌注损伤[J].解剖科学进展,2006,12(1):52-56.
[2] Luo Y,Qin Z,Hong Z,et al.Astragaloside IV protects against ischemic brain injury in amurinemodelof transient focal ischemia[J].Neurosci Lett,2004,363(3):218-223.
[3] Cai YH,Qin Z,Yao QL.A prospective,pilot study of astragalusmembranaceus in the treatment of acute cerebral infarction[J].Clin Neurol,1994,7(6):216-218.
[4] ZhangWD,Zhang C,Liu RH,et al.Preclinical pharmacokinetics and tissue distribution of a natural cardioprotective agent astragaloside IV in rats and dogs[J].Life Sci,2006,79(8):808-815.
[5] Li Z,Cao Q.Effects of astragaloside IV onmyocardial calcium transport and cardiac function in ischemic rats[J].Acta Pharmacol,2002,23(10):898-904.
[6] Zhang W,Binder B.Anti-inflammatory activity of astragaloside IV ismediated by inhibition of NF-kappa B activation and adhesion molecule expression[J].Thromb Haemost,2003,90(5):904-914.
[7] Yang Q,Lu JT,Zhou AW,et al.Antinociceptive effect of astragalosides and itsmechanism of action[J].Acta Pharmacol,2001,22(9):809-812.
[8] Lu S,Zhang J,Yang D.Effects of astragaloside IV in treatingmyocardial injury and myocardial sarco/endoplasmic Ca2+ATPase of viralmyocarditismice[J].Chin J Integr Med,1999,19(11):672-674.
[9] Xing B,Chen H,Zhang M.Ischemic postconditioning inhibits apoptosis after focal cerebral ischemia/reperfusion injury in the rat[J].Stroke,2008,39(8):2362-2369.
[10] Bu Y,Zhang PY,Geng DQ,et al.Effects of electroacupuncture plus oxygenmedicine on the expression of Bcl-2 and Bax proteins in the hippocampal CA 1 area in rats with global cerebral ischemia/reperfusion injury[J],Zhen Ci Yan Jiu,2010,35(3):208-212.
[11] 谭永星,王迪芬,李雪梅,等.神经生长因子预处理对沙土鼠全脑缺血/再灌注损伤脑神经细胞凋亡及Bcl-2及Bax蛋白表达的影响[J].中国危重病急救医学,2007,19(6):358-360.
[12] Hara A,Iwai T,Ni Wa M,et al.Immunohistochemical detection of Bax and Bc1-2 Proteins in gerbil hippocampus following transient forebrain ischemia[J] .Brain Res,1996,711(1/2):249-253.
[13] Strosznajder R,Gajkowska B.Effect of 3-aminobenzamide on Bcl-2,Bax and AIF localization in hippocampus neurons altered by ischemia-reperfusion injury[J].Acta Neurobiol,2006,66(1):15-22.

