固相萃取-气相色谱法同时检测茶叶中多种农药和多氯联苯残留
吴 林,吴晓波,张承聪,马莉莉,林诗云,鲁广秋,唐 娜
(1.云南省农药检定所,云南 昆明 650034;2.云南大学化学科学与工程学院,云南 昆明 650091)
固相萃取-气相色谱法同时检测茶叶中多种农药和多氯联苯残留
吴 林1,2,吴晓波1,张承聪2,马莉莉1,林诗云1,鲁广秋1,唐 娜1,2
(1.云南省农药检定所,云南 昆明 650034;2.云南大学化学科学与工程学院,云南 昆明 650091)
建立茶叶中21种有机氯、拟除虫菊酯类农药和多氯联苯(polychlorinated biphenyls,PCBs)残留固相萃取(solid-phase extraction,SPE)-气相色谱分析方法。用正己烷-丙酮(1∶1,V/V)提取,经Envi-Carb/NH2复合固相萃取柱净化,采用RTX-5毛细管柱分离,气相色谱-电子捕获检测器(gas chromatography-electron caputure detector,GC-ECD)检测。在0.02、0.05、0.3mg/kg三个添加水平,平均回收率为68.64%~125.62%,相对标准偏差(relative standard deviation,RSD)为1.05%~12.78%,该方法的检测限(detection of limit,LOD)在0.0022~0.0129mg/kg之间,适用于茶叶试样中痕量残留的分析。
茶叶;农药;多氯联苯;固相萃取;气相色谱-电子捕获检测器
茶叶是我国主要出口农产品和出口创汇的主导产业。茶叶中有机污染物残留关系到食品安全问题,是发达国家实施贸易保护的技术措施。建立高效、灵敏和可靠的有机污染物分析技术是控制有机污染物污染、保障食品安全质量和打破国际贸易技术壁垒的基础。
多氯联苯属于典型的持久性有机污染物,具有致畸、致癌、致突变作用[1],而且可能导致内分泌紊乱[2]、生殖系统及免疫系统伤害[3]。现今大气、水体、土壤、水生生物、野生动植物以及人乳和脂肪中都发现有多氯联苯的污染[4],同时植物油[5]、禽蛋[6]等食品中也检测出多氯联苯,但现有的多氯联苯测定方法主要针对工业产品、水体、土壤等。虽有机氯、拟除虫菊酯类农药对病虫害具有良好防治效果,但茶叶中时常出现这两类农药超标现象,严重阻碍我国茶叶出口贸易的发展。目前文献报道较多的是有机氯类农药[7],或是拟除虫菊酯类农药[8],或是有机氯和拟除虫菊酯类农药残留分析方法[9-10],而茶叶中有机氯、拟除虫菊酯类农药和多氯联苯残留分析方法少有报道。因此,有必要建立有机氯、拟除虫菊酯类农药和多氯联苯的常规检测方法。
由于液液萃取法、索氏提取法、振荡提取法等传统的前处理方法工作强度大、处理时间长、溶剂消耗量大,已被固相萃取法、凝胶渗透色谱法、加速溶剂萃取法等代替。本实验文参考欧盟、日本农药残留的检测方法[11-12],并结合国内的标准[13],采用固相萃取法和超声提取结合的前处理方法,系统考察了不同种类固相萃取的净化效果和不同洗脱液的洗脱效果,开展同时测定茶叶21种有机氯、拟除虫菊酯类农药和多氯联苯残留的分析方法研究。
1 材料与方法
1.1 材料、试剂与仪器
茶叶样品:云南临沧普洱茶、红茶、绿茶。
α-六六六、β-六六六、γ-六六六、δ-六六六、三氯杀螨醇、硫丹、p,p'-滴滴伊、p,p'-滴滴滴、o,p'-滴滴涕、p,p'-滴滴涕 中国农业部环境保护监测所;2,4,4'-三氯联苯、2,2',5,5'-四氯联苯、2,2',4,5, 5'-五氯联苯、2,2',3,4,4',5-六氯联苯、2,2',3,4,4',5,5'-七氯联苯 美国ACCU Standard. Inc公司;联苯菊酯、甲氰菊酯、高效氯氟氰菊酯、高效氯氰菊酯、氰戊菊酯、溴氰菊酯 德国Dr Ehrenstorfer GmbH公司;无水硫酸钠;所用试剂均为分析纯。
Accu BOND II Florisil Cartridges、Accu BOND C18固相萃取柱 美国安捷伦公司;Envi-Carb/NH2固相萃取柱 美国瓦里安公司。
GC-2010气相色谱(配有63Ni-ECD检测器、AOC-20i+S自动进样器和WBI-2010进样口) 日本岛津公司;MTN-2800W氮吹浓缩装置、AS3120型超声波清洗器天津奥特赛恩斯仪器有限公司;GL-88B旋涡混合器 江苏海门麒麟医用仪器厂;高速万能粉碎机 天津泰斯特仪器有限公司。
1.2 标准溶液的配制
分别准确称取各标准品,用正己烷配制成100μg/mL的标准储备液,再根据各组分在仪器上的响应情况,用正己烷稀释成标准工作液。
1.3 方法
1.3.1 样品提取与净化
准确称取经磨碎的茶叶样品0.50g于具塞三角锥形瓶中,加入1.0g无水硫酸钠,用20mL正己烷-丙酮混合提取溶剂(1∶1,V/V)平分两次超声提取,每次超声提取10min,提取液于离心管中,以4000r/min离心5min,在40℃水浴下氮吹至约1mL。依次用5mL正己烷-乙酸乙酯、5mL正己烷预淋洗Envi-Carb/NH2复合固相萃取柱,将浓缩后的提取液转移至柱内,用20mL正己烷-乙酸乙酯(9∶1,V/V)洗脱剂加压洗脱,洗脱液在40℃水浴下氮吹至近干,用正己烷定容至1mL,进GC-ECD分析。
1.3.2 色谱条件
RTX-5毛细管柱(30m×0.25mm,0.25μm);程序升温:由200℃以2.5℃/min升至230℃,再以14℃/min升至260℃,最后以40℃/min升至320℃;进样口温度:200℃;检测器温度330℃;进样量:1μL;载气:N2(99.999%);流速:0.8mL/min;进样方式:不分流进样。
2 结果与分析
2.1 色谱条件的优化
改变色谱柱、程序升温条件及载气流速,考察21种有机农药色谱分离情况。色谱柱、程序升温和载气流速不同,有机农药和多氯联苯分离情况不同,根据在最短时间获得最佳分离效果的原则,最终选用1.3.2节色谱条件。21种待测组分标准色谱图见图1。
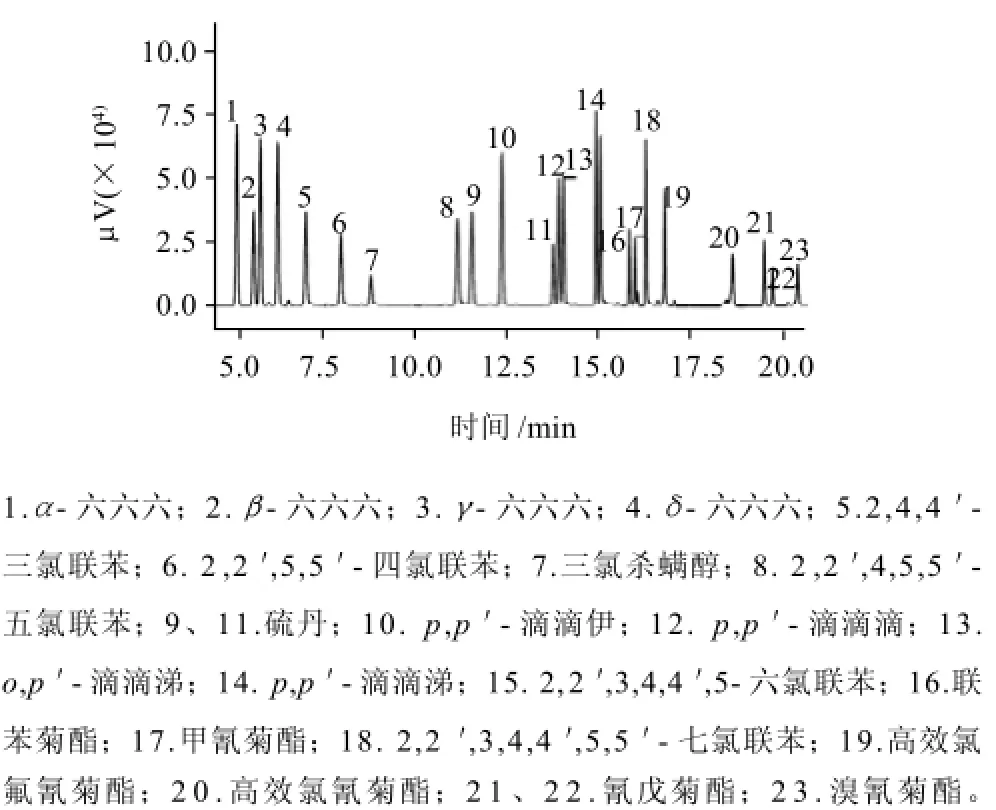
图1 21种有机氯、拟除虫菊酯类农药和多氯联苯标准色谱图Fig.1 Chromatogram of 21 organochlorines, pyrethroids and polychlorinated biphenyls standards
2.2 样品前处理
2.2.1 提取溶剂的选择
分别采用丙酮、乙腈、乙腈-乙酸乙酯(1∶1,V/V)、正己烷-乙酸乙酯(1∶1,V/V)、石油醚-丙酮(1∶1,V/V)和正己烷-丙酮(1∶1,V/V)作为提取溶剂,丙酮回收率为53.39%~339.24%,乙腈回收率为61.84%~119.71%,乙腈-乙酸乙酯回收率为63.37%~121.52%,正己烷-乙酸乙酯回收率为60.23%~134.39%,石油醚-丙酮回收率为65.43%~119.94%,正己烷-丙酮回收率为70.30%~118.42%,实验结果表明,混合提取溶剂的提取效率高于单提取溶剂,混合提取溶剂中正己烷-丙酮(1∶1,V/V)提取效果较好。
2.2.2 提取溶剂体积的选择
实验比较5、10、15、20mL正己烷-丙酮(1∶1,V/V)的提取效率,研究发现,随着提取溶剂体积的增大,待测组分回收率也随之增大。图2为部分具代表性待测组分实验结果,提取溶剂体积从15mL加大至20mL,部分待测组分的回收率仍有增加。为了尽可能提取样品中待测组分,最终选择提取溶剂体积为20mL。

图2 提取溶剂体积的选择Fig.2 Effect of extract solvent type and amount on recoveries of pesticides and polychlorinated biphenyls
2.2.3 固相萃取柱的选择
在分析植物样品中有机氯和拟除虫菊酯类农药的前处理净化方法中,常用到活性炭、中性氧化铝、石墨化碳、弗罗里硅土、硅胶等吸附剂。本实验对比Florisil固相萃取柱、C18固相萃取柱和Envi-Carb/NH2复合固相萃取柱净化效果,Florisil固相萃取柱回收率为68.75%~119.60%,相对标准偏差为1.40%~12.80%,C18固相萃取柱回收率为57.94%~103.48%,相对标准偏差为2.32%~12.67%,Envi-Carb/NH2复合固相萃取柱回收率为78.13%~118.16%,相对标准偏差为1.66%~11.97%。与单一填料的Florisil固相萃取柱、C18固相萃取柱相比,Envi-Carb/NH2复合固相萃取柱回收率和重现性较好,去除色素等杂质能力强,净化效果理想。
2.2.4 洗脱液及其体积的选择
洗脱剂及其体积的选择直接关系到回收率的高低。采用正己烷、不同比例(8∶1、9∶1、10∶1,V/V)的正己烷-乙酸乙酯作为洗脱液,结果发现正己烷-乙酸乙酯(9∶1,V/V)洗脱效果较理想。在选定洗脱液的基础上,进一步优化洗脱液体积,洗脱体积为20mL时能获到更满意的回收率。
2.3 标准曲线、线性范围及检测限
将混合标准储备液配制成0.005、0.01、0.02、0.05、0.1、0.2、0.5μg/mL一系列标准工作液,按1.3.2节色谱条件进行测定。以峰面积(Y)对质量浓度(X,μg/mL)作线性回归分析,得到21种待测组分的线性方程及相关系数,结果见表1。实验表明,在0.005~0.5μg/mL内呈良好的线性关系,检测限(LOD)在0.0022~0.0129mg/kg之间。
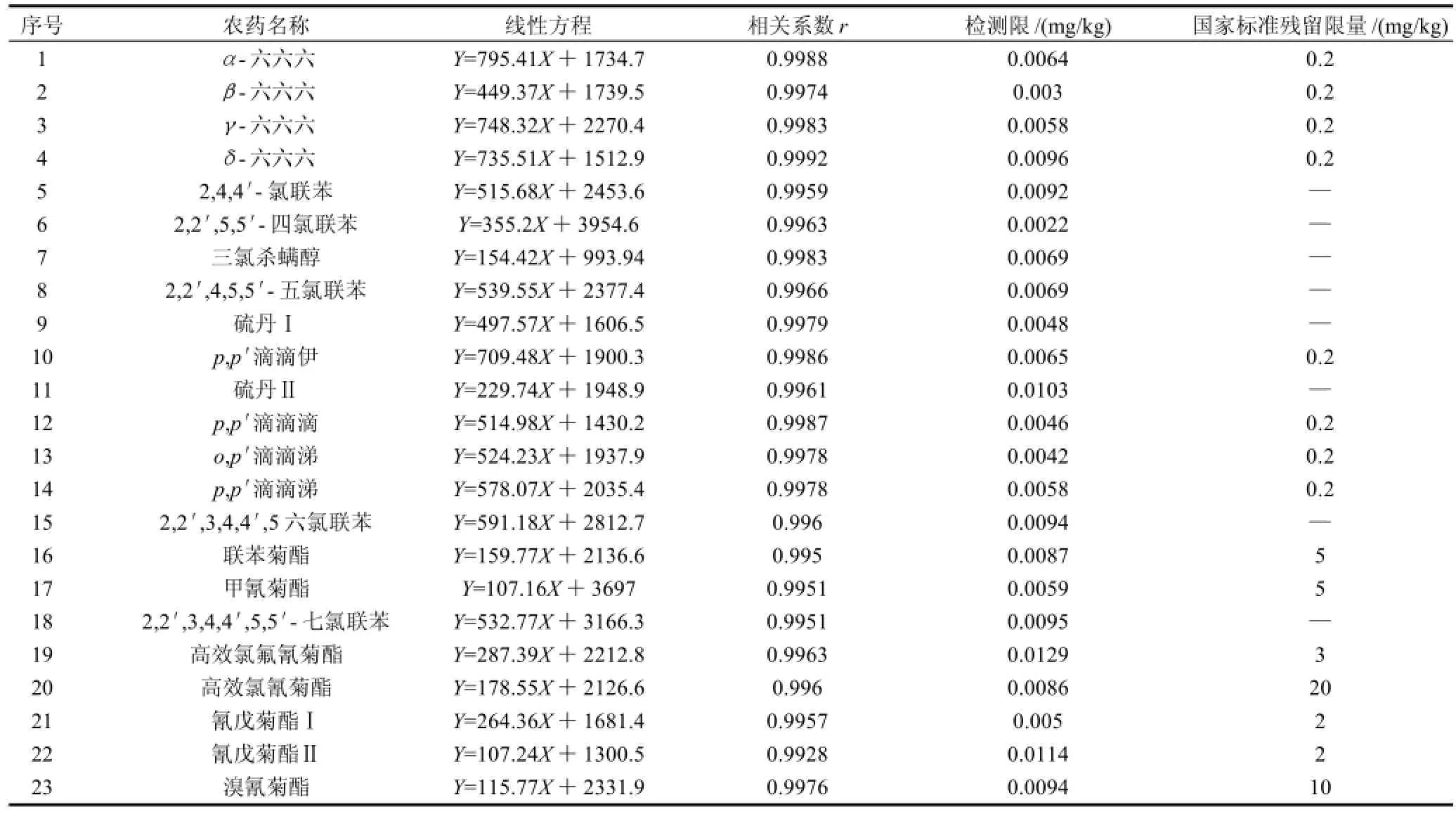
表1 线性方程、相关系数及检测限Table 1 Linear equations, correlation coefficients and limits of detection
2.4 回收率和精密度
在茶叶样品中分别添加0.3、0.05、0.02mg/kg三个浓度水平的混合标准溶液,按照选定的方法提取、净化和检测,每个平重复测定6次,计算各待测组分的回收率及相对标准偏差,结果列于表2。从表2可知,在0.3、0.05、0.02mg/kg的添加水平,21种待测组分的平均回收率为68.64%~125.62%,相对标准偏差为1.05%~12.78%,准确度和精密度均达到茶叶中有机污染物残留分析的要求。
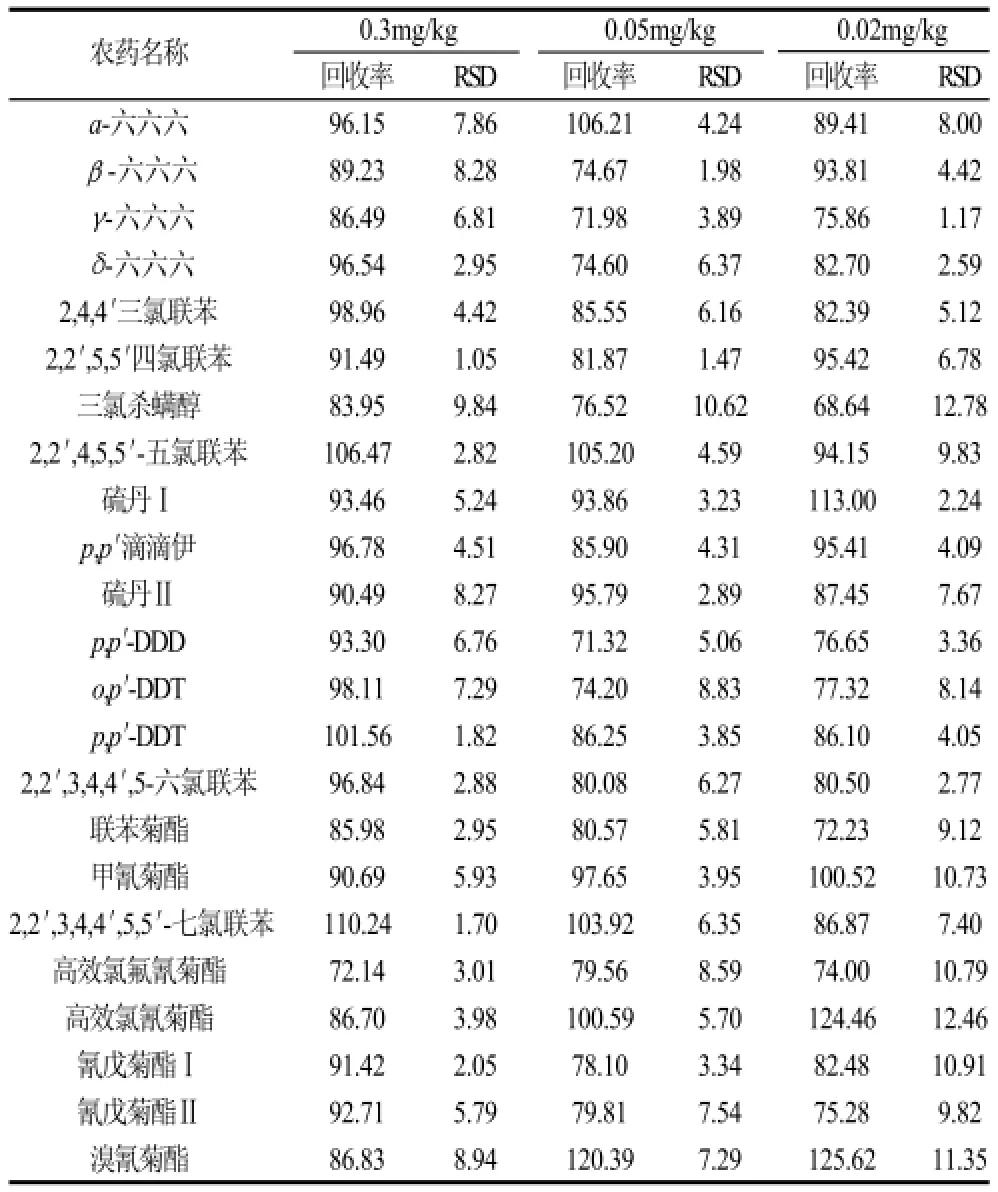
表2 加标回收率和精密度Table 2 Recoveries and precision RSDs of 21 organochlorines, pyrethroids and polychlorinated biphenyls
2.5 样品分析
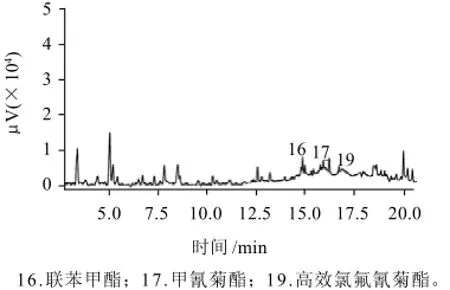
图3 绿茶样品色谱图Fig.3 Chromatogram of green tea sample
应用所建立的分析方法对云南茗优普洱茶、红茶、绿茶样品进行测定。在被分析的茶叶中,红茶检出联苯菊酯,普洱茶检出联苯菊酯和甲氰菊酯,绿茶检出联苯菊酯、甲氰菊酯和高效氯氟氰菊酯,但含量均未超过欧盟和日本MRL标准。云南绿茶样品色谱图见图3,可看出,本实验建立的样品前处理方法可除去茶叶样品中的大部分干扰杂质,能达到实际样品分析的要求。
3 结 论
本实验建立的茶叶中有机氯、拟除虫菊酯类农药和多氯联苯残留同时检测的气相色谱法,前处理步骤简单,回收率、准确度和精密度较好,检测限较低,且各项指标均优于目前我国MRL要求。与同类文献[14-15]比较,本方法能同时测定有机氯、拟除虫菊酯、多氯联苯三大类有机污染物。
[1]何遂源. 环境毒物[M]. 北京∶ 化学工业出版社, 2002∶ 92.
[2]刘兆荣, 陈忠明, 赵广英, 等. 环境化学教程[M]. 北京∶ 化学工业出版社, 2003∶ 15.
[3]苏丽敏, 袁星. 持久性有机污染物(POPs) 及其生态毒性的研究现状与展望[J]. 重庆环境科学, 2003, 25(9)∶ 62-64.
[4]孟紫强. 环境毒理学[M]. 北京∶ 中国环境科学出版社, 2003∶ 253.
[5]黄冬梅, 史永富, 钱蓓蕾, 等. 植物油中7种指示性多氯联苯的GCMS检测方法探讨[J]. 分析测试学报, 2008, 27(增刊1)∶ 183-186.
[6]安琼, 董元华, 倪俊, 等. 气相色谱法测定禽蛋中微量有机氯农药及多氯联苯的残留[J]. 色谱, 2002, 20(2)∶ 167-171.
[7]JOHNSTONE J J, PETTY E E, VOLZ S A. Solid phase extraction GC /ECD method for the analysis of organochlorine pesticides in wildlife plasma[J]. Journal of High Resolution Chromatography, 2005, 20(8)∶405-409.
[8]张莹, 黄志强, 李拥军, 等. 气相色谱法测定茶叶中多种拟除虫菊酯类农药残留量[J]. 分析化学, 2002, 30(3)∶ 337.
[9]林竹光, 金珍, 刘勇, 等. GC-NCI-MS分析茶叶中17种有机氯和拟除虫菊酯农药残留[J]. 高等学校化学学报2005, 26(12)∶ 2218-2222.
[10]卢剑, 武中平, 高巍, 等. 气相色谱双柱法测定茶叶中多种有机氯和拟除虫菊酯类农药残留量[J]. 食品科学, 2009, 30(24)∶ 401-404.
[11]The European Commission. Commission Decision of 12 August 2002 implementing Council Directive 96/23/EC concerning the performance of analytical methods and the interpretation of results[J]. Official Journal of the European Communities, 2002, L221∶ 8-36.
[12]PARK E K, KIM J H, BRUCE D. HAMMOCK, et al. Determination of pyrethroid residues in agricultural products by an enzyme-linked immunosorbent assay[J]. J Agric Food Chem, 2004, 52(18)∶ 5572-5576.
[13]蒋俊树, 赵成仕, 舒勇, 等. GB/T 23376-2009 茶叶中多农药残留测定∶ 气相色谱/质谱法[S]. 北京∶ 中国标准出版社, 2009.
[14]JI Jie, DENG Chunhui, ZHANG Huiqin. Microwave-assisted steam distillation for the determination of organochlorine pesticides and pyrethroids in Chinese teas[J]. Talanta, 2007, 71(3)∶ 1068-1074.
[15]ZAWIYAH S, YAAKOB B C M, NAZIMAH S A H, et al. Determination of organochlorine and pyrethroid pesticides in fruit and vegetables using solid phase extraction clean-up cartridges[J]. Journal of Chromatogr A, 2006, 112(1/2)∶ 254-261.
Multiresidue Determination of Pesticides and Polychlorinated Biphenyls in Tea by Solid-phase Extraction and Gas Chromatography
WU Lin1,2,WU Xiao-bo1,ZHANG Cheng-cong2,MA Li-li1,LIN Shi-yun1,LU Guang-qiu1,TANG Na1,2
(1. Agrichemical Examination Section of Yunnan, Kunming 650034, China;2. College of Chemical science and Engineering, Yunnan University, Kunming 650091, China)
A solid-phase extraction and gas chromatographic method was established to simultaneously determine 21 organochlorines, pyrethroids and polychlorinated biphenyls (PCBs) in tea. Tea samples were extracted with hexane-acetone (1∶1, V/V) in an ultrasonic bath and cleaned up on an Envi-Carb/NH2SPE column. The analytes were separated on a RTX-5 capillary column and detected in63Ni-ECD (electron capture detector). The recoveries for the analytes were from 68.64% to 125.62% with a relative standard deviation (RSD) from 1.05% to 12.78% at the spike levels of 0.02, 0.05 mg/kg and 0.3 mg/kg. The limits of detection (LOD) of the method ranged from 0.0022 to 0.0129 mg/kg. In conclusion, this method can be suitable for the determination of organic contaminants in tea samples.
tea;pesticides;polychlorinated biphenyls (PCBs);solid-phase extraction (SPE);gas chromatographyelectron caputure detector (GC-ECD)
TS207.3;R155
A
1002-6630(2011)14-0223-04
2010-09-21
云南省农药检定所农药分析研究项目
吴林(1983—),男,硕士,主要从事食品药品质量检验研究。E-mail:wulinwulin@126.com
*通信作者:张承聪(1952—),男,副教授,本科,主要从事仪器分析研究。E-mail:zcc1952168@yahoo.com.cn

