芦根多糖的超声辅助提取及其抗菌活性
姚以才,耿中华,王乃馨,郑 义,李 超
(徐州工程学院食品工程学院,江苏 徐州 221000)
芦根多糖的超声辅助提取及其抗菌活性
姚以才,耿中华,王乃馨,郑 义,李 超*
(徐州工程学院食品工程学院,江苏 徐州 221000)
在单因素试验的基础上,采用Box-Behnken试验优化超声辅助提取芦根多糖的最佳工艺条件,然后研究芦根多糖抗菌活性。结果表明,超声辅助提取芦根多糖的最佳工艺条件为液料比9.9∶1(mL/g)、超声温度60℃、超声时间52min,此时芦根多糖得率9.06%;超声辅助提取获得的芦根多糖对酵母菌属于极敏感,对金黄色葡萄球菌属于高敏感,对枯草芽孢杆菌和黑曲霉属于中敏感。
芦根;多糖;超声辅助提取;抗菌活性
芦根(Rhizoma phragmitis)为禾本科多年生草本植物芦苇的新鲜或干燥根茎,性寒、味甘,归肺、胃经,具有清热、生津、除烦、止呕、利尿之功效[1]。临床主要用于发烧、尿路感染、肺脓疡、支气管炎等病的治疗[2]。近来报道,多糖为其主要活性成分,其具有免疫促进作用,促进淋巴细胞转化,抗氧化以及护肝等生理活性[3-5]。目前,芦根多糖在医药品、保健用品、保健食品领域中的应用越来越广泛,但对芦根多糖的超声辅助提取尚未见报道。超声提取作为一种优良的提取方法,具有操作简便快捷、提取时间短、提取率高等特点,目前己广泛应用于生物活性物质提取[6-11]。本实验对芦根多糖的超声提取及抗菌活性进行研究,旨在为芦根多糖的进一步研究与开发应用提供一定参考。
1 材料与方法
1.1 材料与试剂
芦根 安徽亳州药材市场;葡萄糖、乙醇、苯酚、浓硫酸等均为分析纯;枯草芽孢杆菌(Bacillus subtilis)、黑曲霉(Aspergillumniger)、酵母菌(Saccharmoyces cerevisiae) 本实验室分离;金黄色葡萄球菌(Staphy lococcus aureus) 广州市微生物研究所。
1.2 仪器与设备
FA2004型电子分析天平 上海越平科学仪器有限公司;KBS-250型数控超声波细胞粉碎机 昆山市超声仪器有限公司;SENCO R201L型旋转蒸发器 上海申生科技有限公司;SHZ-D(Ⅲ)型循环水式真空泵 巩义市英峪予华仪器厂;HH-4型电热恒温水浴锅 上海梅向医疗器械厂;7230G型可见分光光度计 上海精密科学仪器有限公司。
1.3 方法
1.3.1 超声辅助提取
芦根粉碎后过40目筛,精确称取约3g,置于烧杯中,加入一定体积一定体积分数乙醇溶液后,按照试验设计设置好超声功率、超声温度和超声时间(占空比固定为5s/5s)后开动超声制样,然后将提取液过滤,定容至100mL,测定。
1.3.2 标准曲线的建立[12]
按文献[12]方法稍加修改:精密称取葡萄糖125mg,定容至50mL,分别精密量取0.0、1.0、2.0、4.0、6.0、8.0、10.0mL至25mL容量瓶中,加水至刻度,摇匀,取此系列溶液各2mL至10mL具塞试管中,分别向上述试管中精密加入1mL 5%苯酚乙醇溶液、5mL浓硫酸,摇匀,置100℃水浴中反应15min,反应完毕后取出,放置至室温,于紫外490nm处测定吸光度。以葡萄糖溶液质量浓度为横坐标、其相应的吸光度为纵坐标,绘制葡萄糖标准曲线:标准曲线为A=17.949C-0.017(R2= 0.9977),其在0~0.25mg/mL之间线性良好。
1.3.3 工艺优化设计
1.3.3.1 单因素试验
考察乙醇体积分数、液料比、超声功率、超声温度和超声时间对芦根多糖得率(extraction yield,EY)的影响。
1.3.3.2 Box-Behnken试验
根据Box-Behnken试验设计原理,在单因素试验的基础上,选取液料比、超声温度和超声时间3个影响因素,采用3因素3水平的响应曲面分析方法,试验因素与水平设计见表1。共15个试验点,其中12个为析因点,3个为中心点。
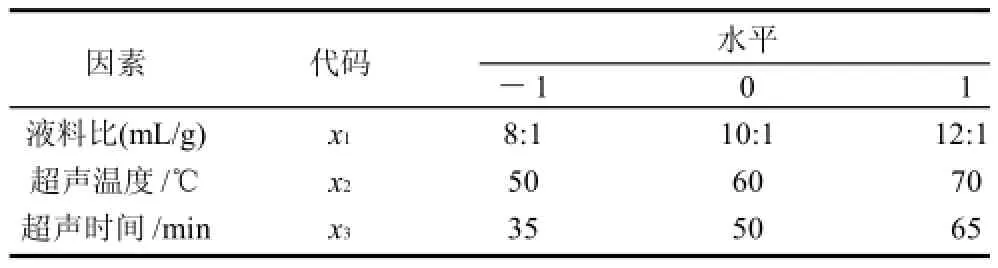
表1 Box-Behnken试验因素水平表Table 1 Factors and levels in Box-Behnken experimental design
设该模型通过最小二乘法拟合的二次多项方程为:
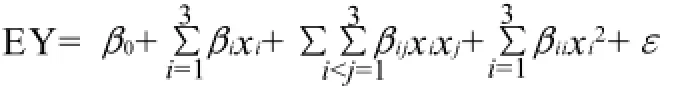
式中:EY为预测响应值;χi和χj为自变量代码值;β0为常数项;β为线性系数;βij为交互项系数;βii为二次项系数;ε为随机误差。按照Box-Behnken试验设计的统计学要求,对上述方程的各项回归系数进行回归拟合。
1.3.4 芦根多糖得率的计算

1.3.5 抑菌试验
1.3.5.1 培养基制备
枯草芽孢杆菌和金黄色葡萄球菌使用LB培养基,黑曲霉使用马铃薯葡萄糖琼脂培养基,酵母菌使用YPD培养基[13]。
1.3.5.2 菌悬液制备
枯草芽孢杆菌、金黄色葡萄球菌和酵母菌菌悬液的制备:将各菌种在固体培养基中活化,用接种环挑取2~3环培养18h左右的菌种,接入液体培养基中,在恒温摇床中培养18h得到菌悬液,把菌悬液浓度调为106~107个/mL,备用。
黑曲霉菌悬液的制备:用灭菌的蒸馏水倒入培养72h左右的斜面接种试管中振荡,再把液体倒入三角瓶中作为孢子悬液,把菌悬液浓度调为106~107个/mL,备用。
1.3.5.3 抑菌活性的测定
以超声辅助提取的芦根多糖为抗菌液(多糖质量浓度15mg/mL),待培养皿中的含菌培养基凝固后,用无菌镊子在每个培养基的表面均匀垂直地放上牛津杯,然后在其中加入等量抗菌液。细菌在37℃培养24h,真菌在28℃培养48h,霉菌在28℃培养5d,测定抑菌圈直径。
2 结果与分析
2.1 单因素试验
2.1.1 乙醇体积分数的影响

图1 乙醇体积分数对芦根多糖得率的影响Fig.1 Effect of ethanol concentration on extraction rate of polysaccharides from Rhizoma phragmitis
由图1可知,随着乙醇体积分数的增加,芦根多糖得率一直降低,使用水作为溶剂时,芦根多糖得率达到了最大值。这是因为多糖为极性较大的化合物,根据相似相溶原理,水作为提取剂的极性与此多糖的极性更加接近,从而使芦根多糖得率最大。因此选择提取剂为水。
2.1.2 液料比的影响
由图2可知,随着液料比的增加,芦根多糖得率先增加后降低,在液料比10∶1时芦根多糖得率达到最大值。这是因为前期溶剂量越大,有效成分浸出越完全,芦根多糖得率也越大;但当溶剂过大时,探头式超声能量对沉滞低层的芦根颗粒的空化效应和机械效应等效应的强度减弱,影响了超声辅助提取的效果,同时会造成溶剂和能源的浪费,并给后序的浓缩工作带来困难。因此选择液料比10∶1。

图2 液料比对芦根多糖得率的影响Fig.2 Effect of material/liquid ratio on extraction rate of polysaccharides from Rhizoma phragmitis
2.1.3 超声功率的影响
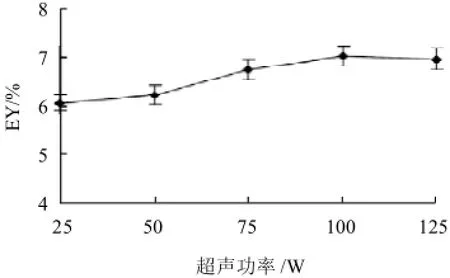
图3 超声功率对芦根多糖得率的影响Fig.3 Effect of ultrasonic power on extraction rate of polysaccharides from Rhizoma phragmitis
由图3可知,随着超声功率的增加,芦根多糖得率先增加后降低,在超声功率为100W时,芦根多糖得率达到最大值。这是因为前期超声功率增加,提取的推动力增加,但当超声功率达到100W以上时,可能由于超声功率过大,多糖受到破坏,导致芦根多糖得率下降。同时考虑到KBS-250型数控超声波细胞粉碎机设备的特点,固定超声功率100W。
2.1.4 超声温度的影响
由图4可知,随着超声温度的增加,芦根多糖得率先增加后降低,在超声温度60℃时,芦根多糖得率达到最大值。这是因为前期温度增加增加了传质速度;但超过60℃之后,多糖受到破坏,同时造成溶剂挥发损失。因此选择超声温度60℃。
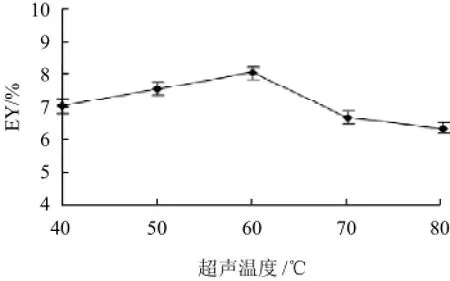
图4 超声温度对芦根多糖得率的影响Fig.4 Effect of temperature on extraction rate of polysaccharides from Rhizoma phragmitis
2.1.5 超声时间的影响
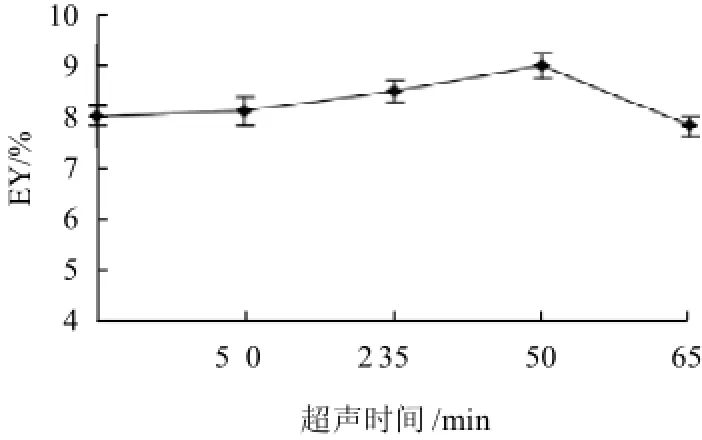
图5 超声时间对芦根多糖得率的影响Fig.5 Effect of ultrasonic treatment time on extraction rate of polysaccharides from Rhizoma phragmitis
由图5可知,随着超声时间增加,芦根多糖得率也随之增大;但当超声时间达到50min以后,可能由于超声时间过长,多糖受到了破坏,导致芦根多糖得率下降,因此选择超声时间50min。
2.2 Box-Behnken试验
2.2.1 模型的建立及其显著性检验

表2 Box-Behnken试验设计及结果Table 2 Box-Behnken experimental design and corresponding results
利用Design expert V7.0.0统计软件通过逐步回归对表2试验数据进行回归拟合,得到芦根多糖得率对以上3个因素的二次多项回归模型为:


表3 响应曲面二次回归方程模型方差分析结果Table 3 Variance analysis for the developed quadratic regression model
由该模型方差分析(表3)可见:模型具有极显著性(P<0.01),失拟项(P>0.05)不显著以及R2Adj=0.9740和RSN=21.882,可知回归方程拟合度和可信度均很高,实验误差较小,故可用此模型对超声辅助提取芦根多糖的工艺结果进行分析和预测。
2.2.2 响应曲面分析与优化
根据回归方程,作响应曲面图,考察所拟合的响应曲面的形状,分析液料比、超声温度和超声时间对芦根多糖得率的影响。其响应曲面及其等高线如图6所示,3组图直观地反映了各因素对响应值的影响。
比较3组图并结合表3中P值可知:模型的一次项χ1(P<0.05)极显著,χ3(P<0.05)显著,χ2(P>0.05)不显著;交互项都不显著;二次项χ12(P<0.01)、x22(P<0.01)和χ32(P<0.01)都极显著,表明各影响因素对芦根多糖得率的影响不是简单的线性关系。为进一步确定最佳提取工艺条件,对所得方程进行逐步回归,删除不显著项,然后求一阶偏导,并令其为0,可得最佳工艺条件为液料比9.86mL/g、提取温度60.1℃和提取时间51.78min,此时芦根多糖的最佳得率为9.01%。
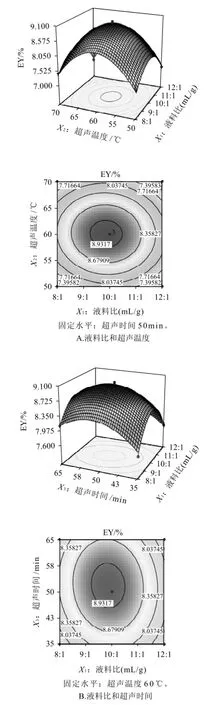
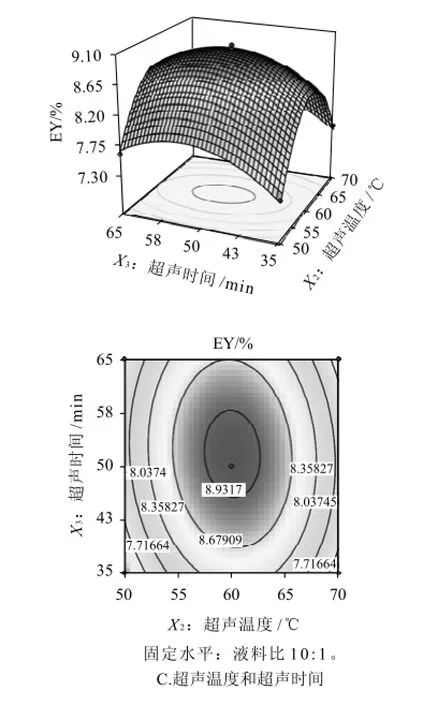
图6 各两因素交互作用对芦根多糖得率影响的响应面和等高线图Fig.6 Response surface and contour plots for the pairwise effect of three process conditions on extraction rate of polysaccharides from Rhizoma phragmitis
为检验Box-Behnken试验结果的可靠性,采用上述最优提取条件进行芦根多糖提取验证实验,考虑到实际操作的便利,将最佳工艺条件修正为液料比9.9∶1、提取温度60℃、提取时间52min,在此条件下进行3次平行实验,实际测得的平均芦根多糖得率9.06%,与预测值基本相符。因此,基于Box-Behnken试验设计所得的最佳工艺条件准确可靠,具有实用价值。
2.3 抗菌活性
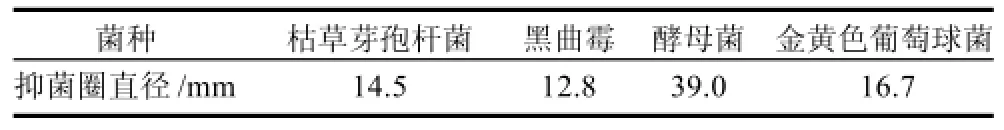
表4 芦根多糖的抗菌活性Table 4 Antibacterial activity of polysaccharides from Rhizoma phragmitis
抑菌圈试验判定标准:抑菌圈直径大于20mm,极敏感;15~20mm,高敏感;10~15mm,中敏感;7~9mm,低敏感;小于7mm,不敏感[14]。由表4可知:超声辅助提取的芦根多糖对4种供试菌均有抑制作用,其中对酵母菌属于极敏感,对金黄色葡萄球菌属于高敏感,对枯草芽孢杆菌和黑曲霉属于中敏感。
3 结 论
3.1 由单因素和Box-Behnken试验设计及其分析结果获得超声辅助提取芦根多糖的最佳工艺条件为液料比9.9∶1、提取温度60℃、提取时间52min,此时芦根多糖得率9.06%。
3.2 超声辅助提取获得的芦根多糖(多糖质量浓度15 mg/mL)对酵母菌属于极敏感,对金黄色葡萄球菌属于高敏感,对枯草芽孢杆菌和黑曲霉属于中敏感。
[1]国家药典委员会. 中华人民共和国药典∶ 一部[M]. 北京∶ 化学工业出版社, 2010∶ 152.
[2]耿志华. 芦根多糖的提取[J]. 基层中药杂志, 1999, 13(4)∶ 40.
[3]沈蔚, 任晓婷, 张建, 等. 芦根多糖的提取及其抗氧化活性的研究[J].时珍国医国药, 2010, 21(5)∶ 1078-1080.
[4]江苏新医学院. 中药大辞典∶ 上册[M]. 上海∶ 上海科学技术出版社, 2006∶ 1500-1501.
[5]李粉玲, 蔡汉权, 严赞开, 等. 酶法提取芦根多糖的研究[J]. 食品工业科技, 2009, 30(4)∶ 156-159.
[6]刘宁, 李健, 金龙哲. 超声波法提取豆角总皂苷的工艺研究[J]. 食品科学, 2008, 29(10)∶ 327-329.
[7]王晶, 任发政. 桑树皮黄酮的超声波提取及体外抗氧化作用研究[J].食品科学, 2008, 29(4)∶ 206-209.
[8]田甲春, 韩玲, 杨晓丽. 超声波辅助法提取硫酸软骨素的工艺研究[J]. 食品科学, 2010, 31(2)∶ 79-81.
[9]CHUA S C, TAN C P, MIRHOSSEINI H, et al. Optimization of ultrasound extraction condition of phospholipids from palm-pressed fiber [J]. Journal of Food Engineering, 2009, 92(4)∶ 403-409.
[10]JALBANI N, KAZI T G, ARAIN B M, et al. Application of factorial design in optimization of ultrasonic-assisted extraction of aluminum in juices and soft drinks[J]. Talanta, 2006, 70(2)∶ 307-314.
[11]CHEMAT S, LAGHA A, AITAMAR H, et al. Comparison of conventional and ultrasound-assisted extraction of carvone and limonene from caraway seeds[J]. Flavour and Fragrance Journal, 2004, 19(3)∶ 188-195.
[12]康波, 班金, 刘志雄. 麦麸多糖的提取工艺研究[J]. 粮食加工, 2009, 34(3)∶ 58-60; 62.
[13]王乃馨, 李超. 杜衡挥发油的水酶法提取及其抗菌活性研究[J]. 粮油加工, 2010(11)∶ 13-15.
[14]蔡一鸣, 任荣清, 文正常. 中药方剂的抗菌试验[J]. 贵州畜牧兽医, 1995, 19(4)∶ 4-5.
Ultrasound-assisted Extraction and Antibacterial Activity of Polysaccharides from Rhizoma phragmitis
YAO Yi-cai,GENG Zhong-hua,WANG Nai-xin,ZHENG Yi,LI Chao*
(College of Food Engineering, Xuzhou Institute of Technology, Xuzhou 221000, China)
On the basis of single factor experiments, the ultrasound-assisted extraction of polysaccharides from Rhizoma phragmitis was optimized by response surface methodology. The optimal conditions for polysaccharide extraction were liquid/ material ratio of 9.9∶1 (mL/g), temperature of 60 ℃ and ultrasonic treatment time of 52 min. Under the optimal extraction conditions, the extraction rate of polysaccharides from Rhizoma phragmitis was 9.06%. The extracted polysaccharide sample was extremely sensitive to Saccharmoyces cerevisiae, highly sensitive to Staphy lococcus aureus, and moderately sensitive to Aspergillumniger and Bacillus subtilis. Therefore, polysaccharides from Rhizoma phragmitis can be developed into a novel antibacterial product.
Rhizoma phragmitis;polysaccharides;ultrasound-assisted extraction;antibacterial activity
O623.54
A
1002-6630(2011)14-0147-05
2010-10-08
徐州工程学院青年项目(XKY2010210);徐州工程学院大学生实践创新训练计划项目
姚以才(1988—),男,本科生,研究方向为功能性食品。E-mail:243525390@qq.com
*通信作者:李超(1978—),男,讲师,博士,研究方向为天然产物化学及食品加工。E-mail:chaoge002@163.com

