双激活剂牛胰酶壳聚糖絮凝法制备工艺优化
李君兰,余群力,张 丽,刘亮亮,郭兆斌
(1.河西学院绿洲农业研究所,甘肃 张掖 734000;2.甘肃农业大学食品科学与工程学院,甘肃 兰州 730070)
双激活剂牛胰酶壳聚糖絮凝法制备工艺优化
李君兰1,2,余群力2,*,张 丽2,刘亮亮2,郭兆斌2
(1.河西学院绿洲农业研究所,甘肃 张掖 734000;2.甘肃农业大学食品科学与工程学院,甘肃 兰州 730070)
采用Plackett-Burman设计对影响胰酶活力和提取率的13个因素进行筛选,有效筛选出主效因素(P<0.05):壳聚糖、CaCl2、胰腺与十二指肠配比和激活pH值。在此基础上,再运用均匀设计对以上4个显著因素的最佳水平范围进行研究,通过偏最小二乘法建立回归方程求解得到胰酶制备最适条件为壳聚糖用量0.17%、CaCl2用量0.06%、胰腺与十二指肠配比8.26∶1、激活pH5.37。此条件下验证实测值胰蛋白酶、胰脂肪酶、胰淀粉酶活力和胰酶提取率分别为3408.71U/g、33.11kU/g、23.93kU/g和13.22%,与理论预测值的相对误差分别为7.15%、8.56%、10.63%、1.93%。Plackett-Burman设计和均匀设计相结合的方法在双激活剂胰酶壳聚糖絮凝法制备工艺中具有可行性。
Plackett-Burman设计;均匀设计;偏最小二乘法;牛胰酶;壳聚糖;优化
中国是畜牧业生产大国,2006年肉类总产量达到8.051×107t[1],屠宰过程产生不可食用的动物胰脏废弃物约有2.236×105t,其中牛胰腺占20%~30%,对环境造成极大的污染。胰脏是生化药品制备的重要资源,它含有多种酶,尤以各种酶蛋白、酶抑制剂及激素物质含量很丰富[2-3],胰蛋白酶、淀粉酶、脂肪酶为胰酶的三大主要消化酶,它们在科学研究、医药、皮革加工、食品工业及化工等领域都有广泛的用途[4-5]。我国胰酶的年产量已逾1000t,且一半出口到日、欧、美等国[6],市场需求量大。据文献报道,胰酶制备工艺主要采用醇酮法[3,7-9],即采用低浓度有机溶剂提取高浓度有机溶剂沉淀,其缺陷在于有机溶剂消耗量大,容易造成环境污染,生产过程易燃、易爆,产品酶活波动较大,且存在一定剂量的有机溶剂残留;超滤法[10]对超滤膜及操作条件要求苛刻;壳聚糖絮凝法[11]的酶活较低。但壳聚糖做胰酶絮凝沉淀剂,不仅沉降效率高、成本低,而且具有抗菌作用[12],它的用量在0.005%以上时就能抑制金黄色葡萄球菌的生长[13]。
Plackett-Burman[14]设计法可以通过较少的实验次数从众多的影响因素中筛选出主要的影响因素,目前已广泛应用于生物工艺优化研究。而均匀设计它适用于多因素、多水平的实验设计,具有“均匀分散、试验次数少”等优点[15],对筛选出的主要影响因素进行更进一步的优化,推测出实验所覆盖区域内的最优操作条件。偏最小二乘法回归分析(partial least-squares regression,PLS)是一种由数据样本进行建模的新型统计回归方法,集多元线性回归、主成分分析和典型相关分析的基本功能为一体,可以较好地解决自变量之间多重相关性、样本点容量不宜太少以及多个因变量对多个自变量同时回归分析等一般回归分析方法无法解决的问题[16]。本实验用牛胰脏为原料,Ca2+和十二指肠共同做为胰酶制备激活剂入手,以胰蛋白酶、胰脂肪酶、胰淀粉酶活力和胰酶提取率为响应值,采用Plackett-Burman设计和均匀设计相结合的方法研究胰酶制备工艺。运用偏最小二乘回归分析法对双激活剂牛胰酶壳聚糖絮凝法制备工艺进行考察和评价,并对其主要因素进行优化,以期获得高活力、低有机溶剂残留的胰酶制品,为家畜哺乳性动物胰脏的开发利用提供理论科学依据。
1 材料与方法
1.1 材料与试剂
新鲜牛胰脏、胆囊、十二指肠由甘肃临夏清河源清真食品有限公司提供,样品从腹腔剥离后立即送入-20℃的冰箱冷冻保存,使用时剔除胰脏周围的脂肪和结蹄组织。
CaCl2、CH3COCH3、H3BO3、Na2B4O7、TCA(三氯乙酸)、Na2S2O3等均为AR级;酪氨酸、马铃薯淀粉、橄榄油、胆盐、壳聚糖(脱乙酰度>92%)、酪蛋白均为生化试剂。
1.2 仪器与设备
D-37520高速冷冻离心机 美国Sigma公司;UV-2550型紫外分光光度计 日本岛津公司;pHS-酸度计上海精密科学仪器有限公司;真空冷冻干燥箱 韩国Briton公司。
1.3 方法
1.3.1 胰酶提取工艺流程
胰浆(胰脏与十二指肠混合搅碎)→激活→提取(原料∶乙醇=1∶2)→过滤→胰乳滤液→壳聚糖絮凝→离心(4000r/min,15min,4℃)→脱脂(冷丙酮洗涤)→真空干燥(25℃,真空度600mm Hg)→胰酶粉
1.3.2 胰浆激活方法的比较
胰酶在胰腺中以无活性的酶原形式存在,提取前须激活。胰蛋白酶是一个触发酶,能激活胰液中许多其它酶原,且是消化中起关键作用的酶,故以胰蛋白酶活力为响应值,通过胰浆中加入CaCl2来探讨胰酶被激活的试验。设置试验方案有:不添加CaCl2直接加乙醇提取胰酶(处理1);先添加CaCl2胰浆激活后再加乙醇提取(处理2)和先加乙醇提取胰浆后再加CaCl2激活(处理3),比较3种方法胰浆被激活的效果。激活条件:CaCl2用量0.1%,pH5.5,时间6h,温度5℃。
1.3.3 激活剂的筛选
选用CaCl2、胆囊、十二指肠做单一激活剂;CaCl2分别与胆囊、十二指肠等量组合构成复合激活剂,以胰蛋白酶活力为响应值,观察单一激活剂与复合激活剂对胰浆的激活效果。
1.3.4 影响胰酶提取的关键因素筛选
采用Plackett-Burman设计分别对影响胰酶提取工艺的13个因素进行筛选,其中X1~X6为胰酶激活条件、X7~X10为胰酶提取条件、X11~X13为壳聚糖絮凝条件,响应值为胰蛋白酶活力和提取率,每个因素的水平范围取值见表1。实验设计和数据分析皆采用JMP软件(Version 7.0.1,SAS Institute Inc.),每组试验重复3次,结果取平均值。
1.3.5 提取工艺优化设计
根据Plackett-Burman试验结果,对筛选出的4个关键因素:壳聚糖用量(X1,15水平)、CaCl2用量(X2,15水平)、胰腺与十二指肠比例(X3,5水平)、激活pH值(X4,5水平)采用混合均匀试验设计表U15(152×52),分析它们对胰蛋白酶、脂肪酶、淀粉酶活力和提取率的影响。每个因素的取值范围及水平分别为0.06%≤X1≤0.2%、0.06%≤X2≤0.2%、8∶1≤X3≤12∶1和5≤X4≤6.2。试验结果为3次重复的平均值,数据分析及偏最小二乘法回归方程的建立采用DPS(Version 6.55)数据处理系统[16-17]。
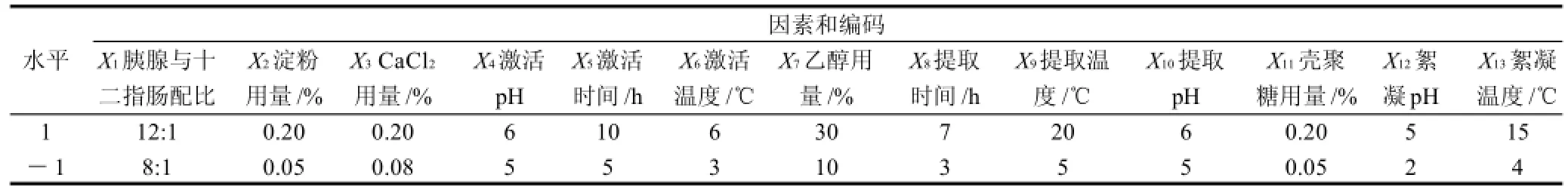
表1 Plackett-Burman设计因素水平表Table 1 Factors and levels in the Plackett-Burman design
1.4.1 胰蛋白酶活力

式中:w1为每1mL酪氨酸对照品溶液中含酪氨酸的量/μg;w为取样量/g;n为供试品的稀释倍数;As为在275nm波长处酪氨酸对照品溶液的吸光度;A为供试品溶液与酪蛋白反应后产物在275nm波长的吸光度;A0为空白液在275nm波长处的吸光度。
1.4.2 胰脂肪酶活力
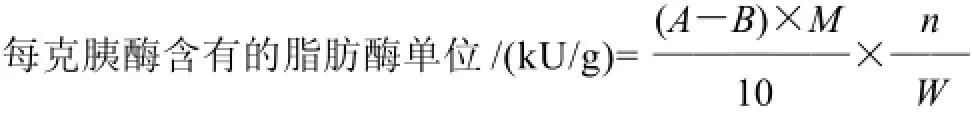
式中:A为样品消耗NaOH的容积/mL;B为空白消耗NaOH的容积/mL;M为滴定NaOH的浓度/(mol/L);W、n同上。
1.4.3 胰淀粉酶活力
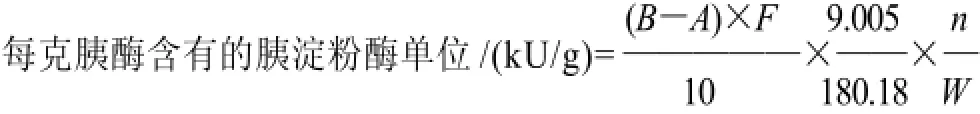
式中:A为供试品消耗Na2S2O3的容量/mL;B为空白消耗Na2S2O3的容量/mL;F为Na2S2O3滴定液的浓度/(mol/L)的换算值;W、n同上。
1.5 提取率计算

2 结果与分析
2.1 胰浆激活方法的比较
Development and prospects of fabricated passive house
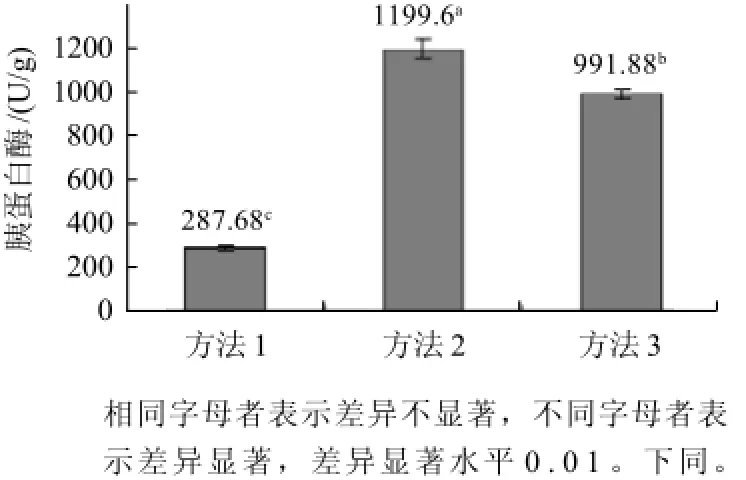
图1 激活方法对胰蛋白酶活力的影响Fig.1 Effect of activation methods on trypsin activity
从图1可看出,3种不同激活方法在0.01水平下对胰蛋白酶活力影响差异显著,而方法2对胰蛋白酶活力影响最高,与处理1和处理3相比胰蛋白酶活力分别提高了76.02%、 17.32%。所以胰酶激活方式选择方法2,即先激活后用乙醇提取。
2.2 激活剂筛选与试验效果比较
3种单一激活剂和组合激活剂试验效果如表2所示,3种单一激活剂中CaCl2对胰蛋白酶原的激活效果明显高于胆囊和十二指肠;而CaCl2-十二指肠组合后对胰浆的激活效果高于CaCl2-苦胆、CaCl2,且在0.01水平下差异都显著。故选择CaCl2-十二指肠作为复合激活剂的优化组合。
2.3 影响胰酶提取的关键因素

表2 单一激活剂与复合激活剂激活胰蛋白酶效果比较Table 2 Comparison of effectiveness of single activators and their combinations in activating trypsin
用JMP软件对Plackett-Burman设计的试验结果(表3)进行方差分析,得到影响胰蛋白酶活力和胰酶提取率的各因素效应评价结果见表4。对胰蛋白酶活力和胰酶提取率两个响应指标同时有显著影响的因素有4个(P<0.05),胰腺与十二指肠配比X1、激活剂CaCl2用量(X3)、激活pH值(X4)、壳聚糖絮凝剂质量分数(X11),因此确定上述4因素为影响胰酶壳聚糖絮凝法制备工艺的关键因素。
2.4 提取工艺的优化
2.4.1 均匀设计与回归方程的建立
均匀设计试验方案及其响应值见表5。利用DPS数据处理软件,对本实验4因素4个响应值同时进行PLS二次多项式回归分析,并建立数学模型,得到以下4个回归方程及回归结果见表6、7。
使用二次多项式模型为:
式中:β0、βi、βii、βij为回归系数,ε为随机误差。
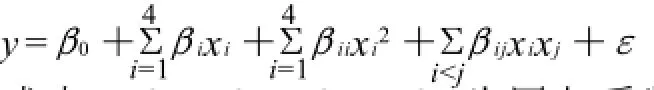
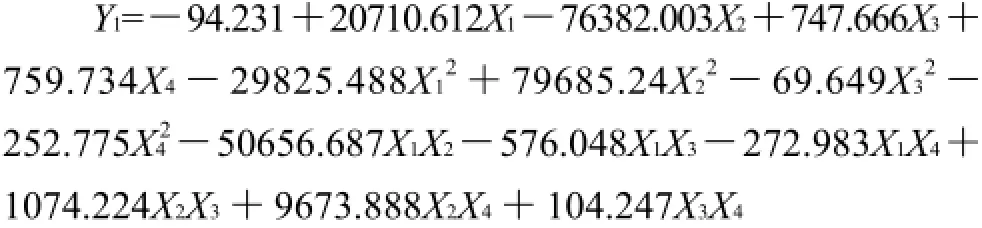

表3 Plackett-Burman试验设计表及响应值Table 3 Plackett-Burman design and corresponding results

表4 各因素的效应评价Table 4 Effect evaluation of 13 factors on trypsin activity and extraction rate

表5 均匀设计U15(152×52)水平编码及其响应值Table 5 Uniform design U15(152× 52) and corresponding experimental results

表6 影响因素对牛胰酶4个响应值作用的标准回归系数Table 6 Standard regression coefficients of the respective regression equations of trypsin, lipase and amylopsin activities and extraction rate of trypsin
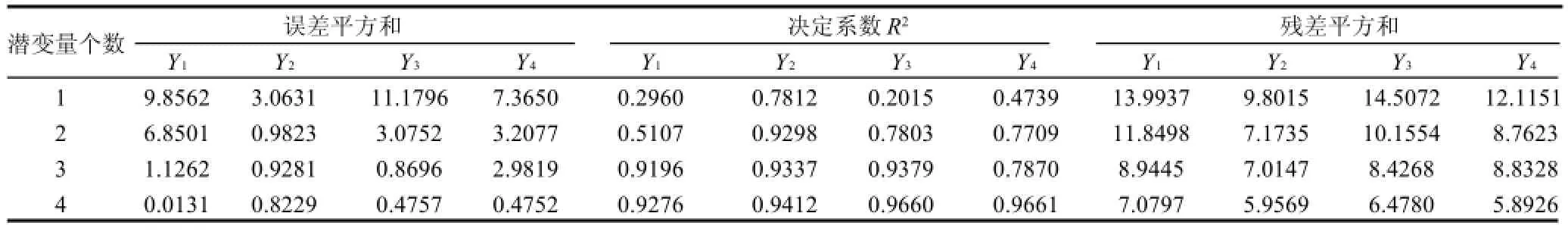
表7 数据标准化后模型方程的误差平方和、决定系数R2及Press统计量Table 7 Error sum of squares, determination coefficient R2and predicted residual sum of squares of the respective regression equations of trypsin, lipase and amylopsin activities and extraction rate of trypsin after data normalization

从表6的回归系数可以看出,4个影响因素对胰酶活力和提取率主效应值的影响。CaCl2与十二指肠对胰蛋白酶、胰淀粉酶主效应的影响呈正效应,说明两种激活剂是提高胰蛋白酶、胰淀粉酶活力的主要添加成分,CaCl2对胰蛋白酶活力的影响大于十二指肠,是胰蛋白酶原有效的激活剂,文献[8]和[19]中也有证明,同时CaCl2对胰淀粉酶也有激活作用,文献[20]中已有证明,本实验也证明了以上两点。CaCl2对胰脂肪酶的活力和胰酶提取率的影响呈负效应;胰腺与十二指肠配比对三酶活力的影响均呈正效应,说明十二指肠有增加胰酶活力的作用,特别是对胰淀粉酶活力的影响最大;因为十二指肠黏膜和肠液中含有肠激酶(enterokinase),天然肠激酶由1条结构亚基(重链)和1条催化弧基(轻链)构成,两者通过1个分子间二硫键结合,结构亚基负责将催化亚基固定在小肠刷状缘膜上并引导它向肠腔移动,催化亚基可以特异性识别Asp-Asp-Asp-Asp-Lys序列并沿序列的羧基端切下,将胰蛋白酶原活化为胰蛋白酶,从而启动各种酶原活化的级联[21]。所以它对胰蛋白酶、胰脂肪酶、胰淀粉酶活力都有提高的作用。但对胰酶提取率呈负效应;壳聚糖对胰蛋白酶、胰脂肪酶、胰淀粉酶的影响呈负效应;对胰酶提取率指标呈正效应;即壳聚糖用量越小,越有利于胰酶活力的提高。其原因为壳聚糖絮凝沉降胰酶时,可能通过交联作用与酶蛋白结合,它的用量越大,这种交联作用就越强,与壳聚糖交联的酶蛋白也就越多,由于这种交联作用,酶蛋白被束缚在壳聚糖周围,形成了一定的空间位阻,使酶反应受扩散限制的影响,酶分子与底物更难以结合,同时壳聚糖与酶蛋白结合也会造成酶分子空间结构和活性中心空间构想的改变,从而导致比酶活的下降。激活pH值对胰蛋白酶、胰脂肪酶、胰淀粉酶的指标影响呈正效应,对胰酶提取率影响呈负效应。
另外,交互项回归系数可以反映因素间交互作用对胰酶活力的影响。例如,X3X4的交互对3种酶活力的影响呈正效应,同时它对胰脂肪酶、胰蛋白酶影响也较大;X2X4、X1X4的交互项回归系数分别对胰蛋白酶、胰酶提取率的影响最大。说明因素间的交互作用利于提高胰酶活力和提取率。
从表7可看出,4个方程的误差平方和、决定系数R2、预测参差平方3个统计量的变化,当潜变量个数为4时,每个回归方程的误差平方和、预测参差平方逐渐减小,而决定系数R2逐渐增大,分别为Y1=0.9276、Y2= 0.9412、Y3=0.9660、Y4=0.9661,说明4个二次多项式回归方程模型的拟合结果良好,具有统计学意义。因而,可以选取方程Y1、Y2、Y3、Y4分别为胰蛋白酶、胰脂肪酶、胰淀粉酶活力和胰酶提取率优化所用方程。
2.4.2 胰酶提取最优工艺条件确定
利用上述建立的回归方程,通过DPS软件处理得出最优制备工艺参数为壳聚糖用量0.17%、CaCl2用量0.06%、胰腺与十二指肠配比8.26∶1、激活pH5.37。各响应指标的理论预测值分别为胰蛋白酶活力3181.35U/g、胰脂肪酶活力30.50kU/g、胰淀粉酶活力21.63kU/g、胰酶提取率12.97%。其他各因素取值不变进行实验验证,其结果见表8,验证实测值与理论预测值的相对误差胰蛋白酶、胰脂肪酶、胰淀粉酶的活力和胰酶提取率分别是为7.15%、8.56%、10.63%、1.93%。进一步验证了数学二次多项式回归模型的适合性,PLS优化结果的合理性。
文献[18]规定胰酶活力用胰蛋白酶、胰脂肪酶、胰淀粉酶的比活力做为评价指标(3种酶的最低酶限量指标为蛋白酶600U/g、脂肪酶4000U/g、淀粉酶7000U/g)。经实验验证胰蛋白酶、胰脂肪酶、胰淀粉酶三酶活力比国家药典规定的活力分别提高了5.68、8.28、3.42倍。牛胰酶粉的感官性状为淡黄色粉末,具有特殊的肉臭味和吸湿性,符合药典规定。

表8 验证实验结果Table 8 Results of validation experiments under optimal preparation conditions
3 结 论
通过plackett-Burman对影响胰酶制备的13个因素进行筛选实验设计和数据方差分析,得到对胰蛋白酶活力和胰酶提取率共同有显著影响(P<0.05)的4个因素,再经过4因素的混合均匀试验,结合PLS回归原理统计分析,获得牛胰酶制备最适条件为壳聚糖用量0.17%、CaCl2用量0.06%、胰腺与十二指肠配比为8.26∶1、激活pH5.37。此条件下验证实测值胰蛋白酶、胰脂肪酶、胰淀粉酶的活力分别为3408.71U/g、33.11kU/g、23.93kU/g,胰酶提取率达到了13.22%,与理论预测值的相对误差分别为7.15%、8.56%、10.63%、1.93%。产品感官指标、理化指标符合国家药典规定。
[1]杨华, 刘玉花, 马俪珍, 等. 羊骨蛋白酶解物免疫活性及酶解条件的研究[J]. 中国农业科学, 2008, 41(10)∶ 3214-3221.
[2]BERDUTINA A V, NEKLYUDOV A D, IVANKIN A I, et al. Comparison of proteolytic activities of the enzyme complex from mammalian pancreas and pancreatin[J]. Applied Biochemistry and Microbiology, 2000, 36(4)∶ 363-367.
[3]SCHULTZE Hans, Isolation of pancreatin∶ US, 4623624[P]. 1986-11-18.
[4]KLOMKLAO S, BENJAKUL S, VISESSANGUAN W. Comparative studies on proteolytic activity of spleen extract from three tuna species commonly used in Thailand[J]. Journal of Food Biochemistry, 2004, 28 (5)∶ 355-372.
[5]KLOMKLAO S, BENJAKUL S, VISESSANGUAN W, et al. Partitioning and recovery of proteinase from tuna spleen by aqueous twophase systems[J]. Process. Biochemistry, 2005, 40(9)∶ 3061-3067.
[6]钟晓勤, 赫毅, 何泽超. 胰酶中镉的去除研究[J]. 天然产物研究与开发, 2008, 20(1)∶ 117-120.
[7]范秀娟, 张达磊, 李桂生. 温度及不同浓度乙醇对胰酶活力的影响[J]. 中国生化药物杂志, 2001, 22(2)∶ 95-96.
[8]吴晓英, 张聚宝, 林影, 等. 胰酶制备新工艺研究[J]. 广东药学院学报, 2005, 21(1)∶ 64-67.
[9]赵小兰. 胰酶制备工艺研究[J]. 青海医药杂志, 2000, 30(4)∶ 56-57.
[10]ABBOUDI E I, BEAULIEU M, BELLAVANCE F. Method for producing pancreatin which contains low amounts of residual organic solvent and product thereof∶ US, 5861291[P]. 1999-02-24.
[11]唐爱星, 何泽超, 郭丽. 絮凝法生产胰酶[J]. 中国生化药物杂志, 2005, 26(3)∶ 166-168.
[12]KNORR D. Nutritioal quality. Food processing and biotechnology aspect of chitin and chitosan[J]. Process Biochemistry, 1986, 21(3)∶ 90-92.
[13]DARMADJI P, IZUMIMOTO M. Effect of chitosan in meat preservation [J]. Meat Science, 1994, 38(2)∶ 243-254.
[14]PLACKETT R L, BURMAN J P. The design of optimum multifactorial experiments[J]. Biometrika, 1946, 33(4)∶ 305-325.
[15]方开泰. 均匀设计与均匀设计表[M]. 北京∶ 科学出版社, 1994∶ 14.
[16]唐启义, 唐洁. 偏最小二乘回归分析在均匀设计试验建模分析中的应用[J]. 数理统计与管理, 2005, 25(5)∶ 45-51.
[17]唐启义, 冯明光. 实用统计分析及其DPS数据处理系统[M]. 北京∶科学出版社, 2002∶ 597-602.
[18]国家药典委员会. 中华人民共和国药典∶ 二部[M]. 北京∶ 化学工业出版社, 2005∶ 631-633.
[19]KLOMKLAO S, BENJAKUL S, VISESSANGUAN W, et al. 29kDa Trypsin from the pyloric ceca of Atlantic Bonito (Sarda sarda)∶ recovery and characterization[J]. J Agric Food Chem, 2007, 55(11)∶ 4548-4553.
[20]毕金峰. 两种淀粉酶的酶学性质及应用研究[J]. 农业工程学报, 2005, 21(增刊2)∶ 238-241.
[21]张向辉, 谭树华, 李泰民. 肠激酶特点及其基因工程的研究进展[J].药物生物技术, 2005, 12(5)∶ 347-350.
Process Optimization for Preparation of Bovine Trypsin by Dual-factor Activation and Subsequent Chitosan Flocculation
LI Jun-lan1,2,YU Qun-li2,*,ZHANG Li2,LIU Liang-liang2,GUO Zhao-bin2
(1. Oasis Agricultural Research Institute, Hexi University, Zhangye 734000, China;2. College of Food Science and Engineering, Gansu Agricultural University, Lanzhou 730070, China)
With the aim of developing a method to prepare bovine trypsin by dual-factor activation and subsequent chitosan flocculation, Plackett-Burman design was used to evaluate the effects of 13 process conditions on the activity and extraction rate of trypsin to screen out 4 most significant ones (P<0.05) including chtosan amount, ratio of bovine pancreas to duodenum and activation pH. Their optimal levels were optimized by the combined use of uniform design and partial least squares regression as follows∶ chtosan amount of 0.17%, CaCl2 amount of 0.06%, pancreas-duodenum ratio of 8.26∶1, and activation pH 5.37, respectively. Under the optimized conditions, the activities of trypsin, lipase and amylopsin and the extraction rate of trypsin were observed to be 3408.71 U/g, 33.11 kU/g, 23.93 kU/g and 13.22%, respectively, which exhibited a relative error of 7.15%, 8.56%, 10.63% and 1.93% when compared with their predicted counterparts. Therefore, the combined use of Plackett-Burman design and uniform design is feasible to optimize the preparation of trypsin by dual-factor activation and subsequent chitosan flocculation.
Plackett-Burman design;uniform design;partial least squares regression;bovine pancreatin;chitosan;optimization
Q814.4
A
1002-6630(2011)14-0090-06
2010-08-26
甘肃省农业生物技术研究开发项目(GNSW-2007-06)
李君兰(1966—),女,副教授,博士研究生,研究方向为动物食品营养与工程。E-mail:qwzhaohui@126.com
*通信作者:余群力(1961—),男,教授,博士,研究方向为动物食品营养与工程。E-mail:yuqunli@gsau.edu.cn

