稻草与多水平苜蓿混合瘤胃体外发酵组合效应的整体研究
张吉鹍 邹庆华 王金芬 熊立根
稻草与多水平苜蓿混合瘤胃体外发酵组合效应的整体研究
张吉鹍 邹庆华 王金芬 熊立根
就稻草(RS)与苜蓿(MSL)混合瘤胃体外发酵组合效应进行整体评定。采用单因子试验设计,体外批次培养48 h,应用经改进的组合效应多项指标综合指数(IMFAEI)对RS分别添补0、20%、40%、60%、80%与 100%MSL(MSL0、MSL20、MSL40、MSL60、MSL80与 MSL100)在 12、24与48 h研究瘤胃体外发酵的组合效应。各组各时间点的 pH 值 6.75~6.88,NH3-N 3.11~28.74mg/100ml,微生物氮 2.91~14.57mg/ml,48 h各组累计产气量与总挥发性脂肪酸分别为120.1~162.4 ml/g OM与41.51~55.45 mmol/l。各组的IMFAEI自高到低的排序为:MSL60(1.2711)、MSL40(1.2603)、MSL20(0.8265)与 MSL80(0.6333)。本研究RS与MSL适宜添补量为40%~60%。
稻草;苜蓿;体外发酵;组合效应;整体
稻草(RS)是我国南方的主要农作物秸秆,由于其自身营养素的缺乏及硅、木质素等抗营养因子含量较高,不仅使得饲喂单一RS的反刍动物过瘤胃蛋白与生葡萄糖物质水平低,而且使得RS在瘤胃内不能很好地被微生物发酵而导致消化率降低,从而不能有效地利用日粮的能量[1]。提供纤维分解菌的生长所需的氮源,优化秸秆在瘤胃的发酵,是提高反刍动物生长的重要措施。可是,常规蛋白资源如饼粕类短缺价高,限制了其在像我国这样的发展中国家的普及使用。此外,现流行的日补喂两次精料,对于饲喂低质秸秆基础日粮的反刍动物,只能短暂升高瘤胃的氨、硫化物等营养素的浓度,也就是说全天仅有部分时间能氮较平衡,有利于瘤胃微生物特别是纤维分解菌的生长进而促进纤维的消化[2]。因此,很有必要探讨其它氮源补充料,来改善我国反刍动物的营养状况。Dixon[3]报道,豆科牧草在瘤胃降解缓慢释放出氮、硫及其它营养物质,可为瘤胃微生物提供能被纤维分解菌同步利用的可降解氮与可发酵能。对低质秸秆基础日粮补饲豆科牧草必能促进纤维分解菌的生长,从而提高秸秆的消化率[4]。苜蓿(Medicago sativa L.,MSL)不仅是反刍动物的蛋白质补充饲料,而且还是反刍动物的主要能量饲料[2]。因此,选择MSL进行补饲,已引起越来越多学者的关注[5-6]。利用饲料间的组合效应来改善进入反刍动物体内的营养平衡,促进瘤胃发酵,是提高稻草等秸秆饲料利用率的重要举措[7-8]。然而迄今,体外法研究反刍动物秸秆基础饲料补饲苜蓿多见于体外发酵特征的影响[9-10]或几个发酵参数组合效应的综合评定[11-12],而将体外发酵特征与发酵参数组合效应综合评定结合起来进行整体研究的报道鲜见。故本研究拟通过体外批次培养,探讨RS添补不同水平MSL的瘤胃体外发酵特征,并应用经改进的组合效应多项指标综合指数(MFAEI)对体外发酵参数组合效应进行综合评定以探讨出RS的MSL适宜添补量。
1 材料与方法
1.1 试验材料
RS为收获稻谷后的晚稻草,MSL为整株植株。粉碎过40目筛,备作常规化学成分分析与体外产气试验。
1.2 化学成分分析
试验所用 RS、MSL中干物质(DM)、粗蛋白(CP)、粗脂肪(EE)与粗灰分(Ash)的测定依据 AOAC[13]的方法进行,而中性洗涤纤维(NDF)、酸性洗涤纤维(ADF)与酸性洗涤木质素(ADL)则采用Van Soest等[14]的方法进行测定。体外发酵所用RS与MSL的常规营养成分见表1。MSL的粗蛋白含量高,纤维含量低,是较为理想的稻草补充饲料。
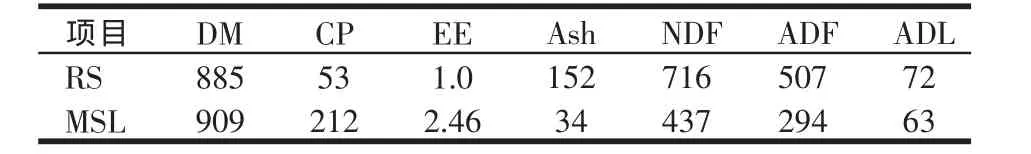
表1 试验用粗饲料的常规营养成分(g/kg DM)
1.3 试验设计
本试验采用单因子6处理重复试验设计,RS与 MSL 分别以 100: 0(MSL0)、80: 20(MSL20)、60: 40(MSL40)、40: 60(MSL60)、20: 80(MSL80) 与 0: 100(MSL100)的比例组成6个组合进行体外发酵,共进行2个批次。在进行批次发酵时,每个样品设3个重复,同时设1个空白对照组与1个标准干草组,用于校正各时间点因取样、培养瓶的体积差异、大气压变化以及瘤胃液菌源变异所引起的产气量变化。
1.4 瘤胃液供体动物
选 3只体况良好、体重相近(33±1)kg、安装有永久性瘤胃瘘管的山羊供采集瘤胃液用。日粮的精粗比为3:7,以混合粗饲料(RS与MSL各半)700 g/d为基础饲料,另按干物质计日补充300 g精料。日喂两次(08:00 和 18:00)、自由饮水、常规光照。
1.5 体外培养装置及发酵液的配制
采用由Theodorou等[15]建立并经Mauricio等[16]改进的压力传感器体外产气技术进行体外批次培养,压力传感技术主体装置由若干产气瓶、产气瓶支架、压力传感器、带特定软件的计算机及恒温培养箱等组成。每批可同时培养60个样品。本试验所用发酵液的配制按照Mauricio等[16]介绍的配制。
1.6 体外批次培养液的取样与有关指标分析
本试验所测定的反映体外批次培养发酵性能的指标为体外批次培养液中的pH值、氨氮(NH3-N)浓度、产气量(GP)、挥发性脂肪酸(VFAs)与微生物氮(MN)。在12、24和48 h记录产气量时迅速取样测定有关指标。
1.6.1 pH值
用SartoriusPB-20型pH值计直接测定。
1.6.2 NH3-N浓度
参照冯宗慈等[17]的比色方法进行测定。
1.6.3 GP
每个批次培养48 h,分别记录在培养后的12、24与48 h的压力,每次读数后即将瓶内的气体放掉。
1.6.4 VFAs
用岛津GC-2010型气相色谱仪测定。
1.6.5 MN

其中,RNA含氮量为17.83%,细菌氮中RNA含氮量为10%。
1.6.6 稻草添补苜蓿单个时间点特定指标组合效应的计算
单个时间点特定指标(如产气量)的组合效应计算公式[20]如下:
式中,实测值为实际测定的样品特定指标值[如产气量(m l)],加权估算值=苜蓿的实测值×苜蓿配比(%)+秸秆基础料的实测值×秸秆基础料的配比(%)。
2 结果与讨论
2.1 pH值(见表2)
瘤胃液pH值是衡量瘤胃发酵状况的敏感指标,瘤胃pH值影响微生物合成效率。Henning等[21]研究表明,体外培养一般在6 h后开始出现累积现象,pH值下降。培养液pH值高低能反映底物被发酵利用的程度,pH值越低,说明发酵产酸累积越多,而发酵终产物累积会影响细菌的生长[22]。由表2可见,所测定时间点的培养液pH值为6.75~6.88。RS与不同比例MSL组合体外发酵的pH值,除MSL60的pH值较高外,其次为MSL40,而以MSL80最低,且各组pH值均随培养时间的延长而降低。但是,所测定的pH值均在瘤胃微生物特别是纤维分解菌生长所需的pH值范围(6.2~7.0)内[23]。瘤胃发酵加强时,VFAs等(如乳酸等其它有机酸)增加引起pH值下降,同时由于饲料蛋白质分解加速使得氨的浓度增加,导致pH值上升。瘤胃的最终pH值是饲料中碳水化合物与含氮物质在瘤胃发酵产物综合作用的结果。体外批次发酵的pH值还与所用缓冲液的缓冲能力有关,发酵基质中添补的豆科牧草(如本研究中所用的苜蓿)中所含的丰富矿物质会加强这种缓冲能力。本研究表明RPT体外培养体系所采用的缓冲液缓冲能力较强,足以维持培养液的pH值在正常范围之内,段智勇[24]在用此系统研究稻草NDF添加不同水平的玉米淀粉组合效应时,测得的稻草NDF和玉米淀粉混合物培养液24 h pH值在6.68~6.84范围,并没有随玉米淀粉含量的增加与培养时间的延长而显著降低。Sommart等[25]在用瓶子产气系统研究稻草或5%尿素处理稻草添补不同水平的木薯对体外微生物发酵特性与微生物蛋白合成的影响时,发现尽管pH值受到木薯的添加水平及粗饲料的影响,且随培养时间的延长而显著降低,但pH值在6.70~6.88范围。本研究的pH值与这些研究结果相似。
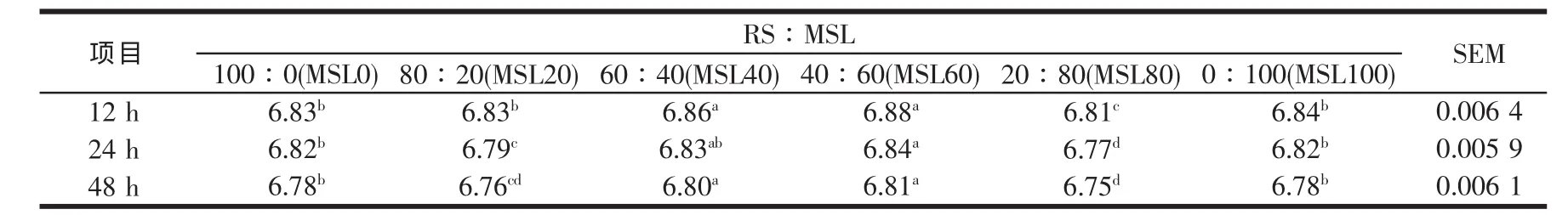
表2 稻草与不同比例苜蓿组合体外培养48 h pH值的变化
2.2 NH3-N浓度(见表3)
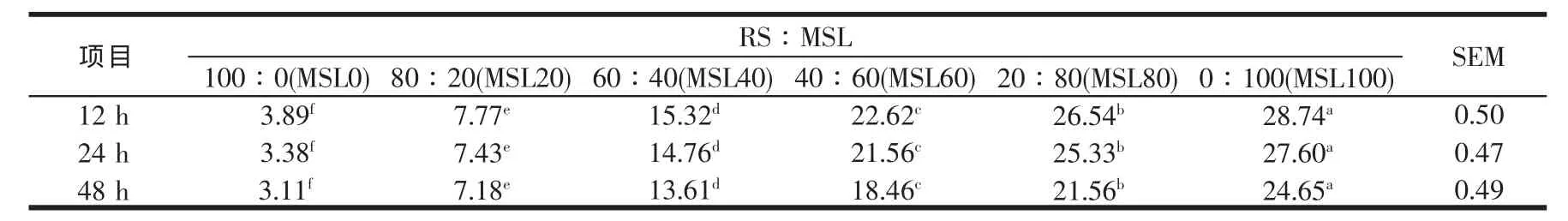
表3 稻草与不同比例苜蓿组合体外培养12~48 h NH3-N的变化(mg/100ml)
瘤胃内NH3-N既是瘤胃氮代谢过程中外源(饲料)蛋白质、内源含氮物质降解的重要产物,同时也是在有能量和碳链的情况下,瘤胃微生物合成菌体蛋白的原料。Clark等[26]通过体外批次发酵研究证明,在瘤胃微生物区系中,约80%的瘤胃细菌以NH3作为生长的唯一氮源,约50%的细菌既可以NH3-N,也可以氨基酸作为生长的氮源,另26%的细菌其生长离不开NH3-N。因此,瘤胃内NH3-N浓度是瘤胃内环境参数的重要指标,是瘤胃内饲料蛋白降解及微生物对NH3-N利用的综合反映。体外批次发酵体系中的NH3-N浓度,主要取决于:首先,发酵基质中的蛋白质含量及其降解率与理化特性;其次,含氮物质与能量载体物质的比例,能氮释放是否同步;再次为微生物蛋白的合成效率与微生物自溶。这三个因素关系紧密、相互影响,存在着一个动态平衡关系。NH3-N浓度过低会影响微生物蛋白产量,过高表明氨释放速度高于其利用与吸收速度,造成氨的损失。Owens等[27]指出,瘤胃内微生物蛋白合成所需的NH3-N浓度为0.35~29mg/100ml。本研究的NH3-N浓度位于3.11~28.74mg/100ml。NH3-N浓度随MSL比例的提高而增加(P<0.05),随发酵时间的增加而降低,所测定的时间点均以MSL的比例达100%时的NH3-N浓度最高,这与苜蓿蛋白的降解率较高有关[28],但所测定值均在有关文献报道的范围之内。一些学者就适于微生物生长的最佳NH3-N浓度作了较为深入的探讨,Schaefer等[29]报道,体外培养液中满足微生物生长需要的理想NH3-N浓度为 2~5mg/100ml。Petersen[30]报道,放牧反刍动物瘤胃液中NH3-N浓度在1~2mg/100ml时,就可满足细菌对纤维降解的需要。Hoover[31]则认为,瘤胃微生物生长适宜氨氮浓度为3.3~8.0 mg/100ml,由于日粮蛋白质及碳水化合物(CHO)发酵的差异,实际上瘤胃液中氨氮的变化幅度多在1~76 mg/100ml,从而影响瘤胃微生物活性。Clark等[26]证实奶牛瘤胃液中的NH3-N浓度在2 mg/100ml时,就能满足瘤胃微生物合成蛋白的需要。可见瘤胃微生物以氨作氮源合成瘤胃微生物氮的效率相当高,即使瘤胃液中的NH3-N浓度很低,亦能为微生物利用[29]。因此,可以认为本研究中的NH3-N浓度足以满足瘤胃微生物生长的需要,有效能成为合成微生物蛋白的主要制约因素。而通过添补MSL来提高瘤胃微生物消化RS中难以消化的纤维的能力是组合效应发生的基础。
2.3 产气量及其组合效应
2.3.1 产气量
RS与不同比例MSL混合培养在所选定时间点的累计产气量见表4。各组的产气量均随MSL在混合物中比例的增加而增加,与其他学者报道的相似[32,33],组间差异随培养时间的延长降低,到24 h时MSL60、MSL80与MSL100的产气量差异不显著(P>0.05),并保持至48 h。此外,在48 h MSL20与MSL40的差异亦不显著(P>0.05)。产气量随MSL在混合发酵基质中比例的增加而非线性地增加,说明在产气量上存在着组合效应。
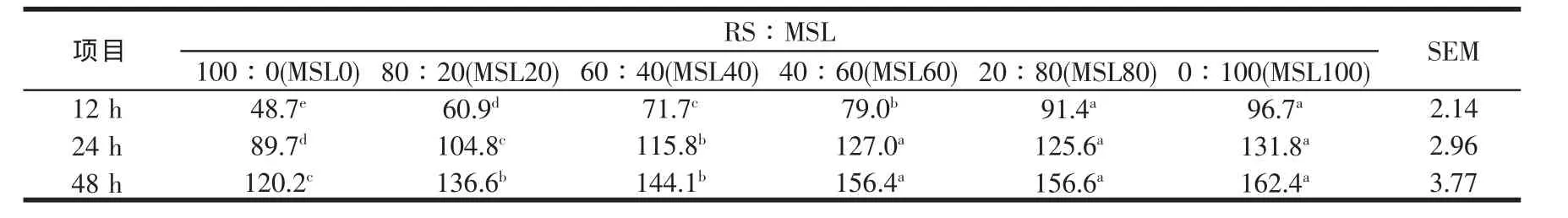
表4 稻草与不同比例苜蓿混合培养在所选定时间点的累计产气量(ml/1 gOM)
2.3.2 产气量的组合效应(见表5)
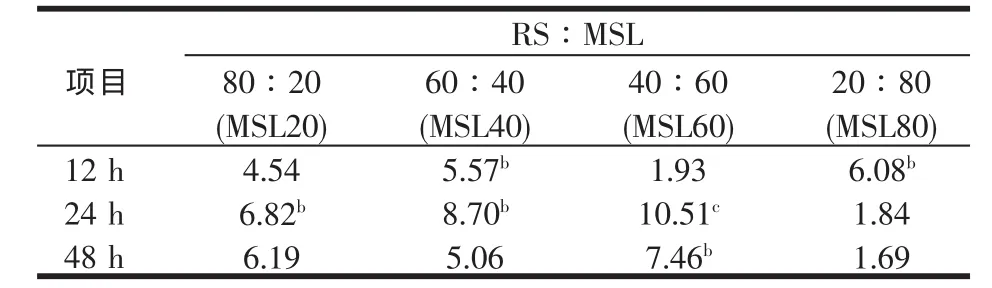
表5 稻草与不同比例苜蓿组合在产气量(GP)上的组合效应
表5反映的是RS与MSL混合培养时的产气量及其单独培养时产气量的加权值之差的百分比(本研究中定义为RS与MSL混合培养时在产气量上的组合效应值),即各混合发酵基质在不同培养时间点累计产气量的组合效应值,表5同时还标明了应用t检验比较分析各组合的观察值与预测值显著水平。从表5可以看出,除MSL80在培养到12 h组合效应达到峰值外 (P<0.05),其余 3 组(MSL20、MSL40、MSL60)均在24 h达到峰值(P<0.05或 P<0.01),而以 MSL60组亦即当苜蓿添加比例占发酵基质总量的60%时,组合效应最大为10.51%(P<0.01)。各组的组合效应在达到峰值后,随着培养时间的延长缓慢下降。12 h MSL80的组合效应最大,其次是MSL40。MSL80在12 h后急剧下降至 24 h的 1.84%(P>0.05),MSL40 与 MSL20 在 12 h后上升至24 h的峰值(P<0.05)。24 h以MSL60最大,其次是MSL40与MSL20,48 h的组合效应只有MSL 60 达到显著水平(P<0.05),其余差异不显著(P>0.05),最差的是MSL80。Liu等[20]的研究证明,稻草或碳酸氢铵(NH4HCO3)处理的稻草与禾本科干草或桑叶混合培养时,自12至96 h几乎所有水平(25%、50%、75%与100%)的组合效应均为正值,且组合效应值总的趋势是随培养时间延长而降低,但同样并非所有时间点的组合效应均达到显著水平。本研究结果与这些结果相似。同样有人在未经处理的秸秆中添补棉粕以及在尿素处理的秸秆中添补花生粕观察到了正组合效应,但未达到显著水平(P>0.05)。可是,Sampath[34]等用体外产气法(自12、52至166 h)研究未经处理的粟秸添补不同比例的花生粕观察到正组合效应,且达显著水平(P<0.05)。与本研究中的苜蓿相似,花生粕、棉粕与桑叶均含有较多的快速可发酵碳水化合物与蛋白质。Cone等[35]与Groot[36]的研究证明初期产气主要是基质中水溶组分如糖与蛋白质等的发酵所贡献。因此,可以认为稻草基础日粮添补苜蓿的组合效应可能是由于苜蓿为纤维分解菌提供了可发酵的能量与蛋白质(氨基酸或肽),加速纤维分解菌的增殖引起。就单一的产气指标评定组合效应而言,稻草基础日粮中添补苜蓿的比例以占整个日粮总量的60%为宜。
2.4 挥发性脂肪酸产量及其组合效应
2.4.1 挥发性脂肪酸产量
RS添补不同比例的MSL,对体外培养12~48 h乙酸、丙酸与丁酸及总VFAs产量,以及乙酸与丙酸比的影响见表6~表10,从这些表可以看出,乙酸、丙酸与丁酸及总VFAs产量自12~48 h,均随时间延长而增加,且各时间点均随MSL比例的增加而增加,与Sommart[37]及王旭[32]等的结论相似,显著水平见相应表。表明基质中MSL水平影响VFAs的生成,本研究中48 h总VFAs位于41.51 mmol/l到55.45 mmol/l的范围,与瘤胃液中的浓度相似[25],表明没有发生体外批次培养常见的酸累积现象,从而保证微生物的正常生长。体外培养时所产生的气体与挥发性脂肪酸有很大的关系,产气量高的挥发性脂肪酸产量亦高,不同MSL水平组总VFAs产量随培养时间延长的变化规律与前述产气量的变化结果相一致。丙酸是反刍动物主要的生糖前体物质,易发酵碳水化合物有利于形成丙酸发酵型[38],本研究中丙酸产量随MSL在混合发酵基质中比例的增加而增加,有关显著水平见表7,可能与苜蓿细胞内容物中所含的非结构性碳水化合物有关。反刍动物挥发性脂肪酸的产量与其能量代谢密切相关,总VFAs的提高表明底物的消化率上升,而若总VFAs中丙酸的比例上升,则表明消化后能量的利用率较高,再结合考察表10中的乙酸/丙酸摩尔比值(多数组间差异不显著)可知,MSL40、MSL60、MSL80与MSL100四个混合组的能量利用率均随总VFAs的提高而略有提高,这与段智勇[24]在研究稻草NDF与玉米淀粉的组合效应时,发现基质经体外培养发酵后,基质的消化率和能量的消化率均上升,但能量的利用率并没有提高的研究结果相反,可能与所用的发酵基质不同有关,段智勇[24]所用的稻草NDF为纯营养素,而玉米则为营养素载体的饲料形式,本研究中的RS与MSL均为营养素载体的不同饲料形式,MSL除含有可降解蛋白、苜蓿总苷外,还含有水溶性物质等。
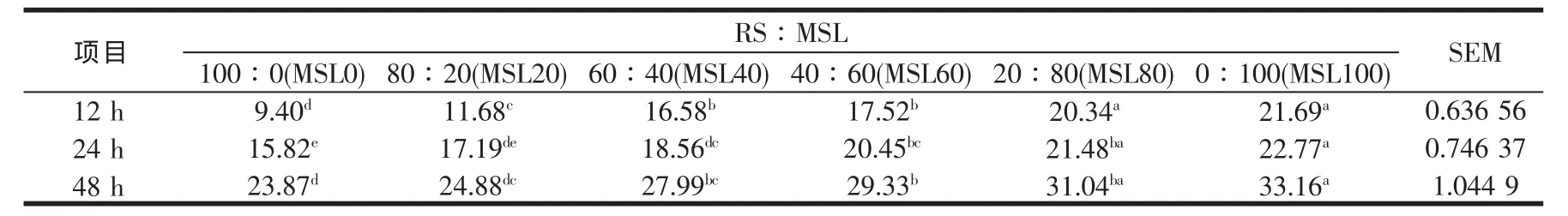
表6 稻草与不同比例苜蓿组合体外培养12~48 h乙酸产量的变化(mmol/l)
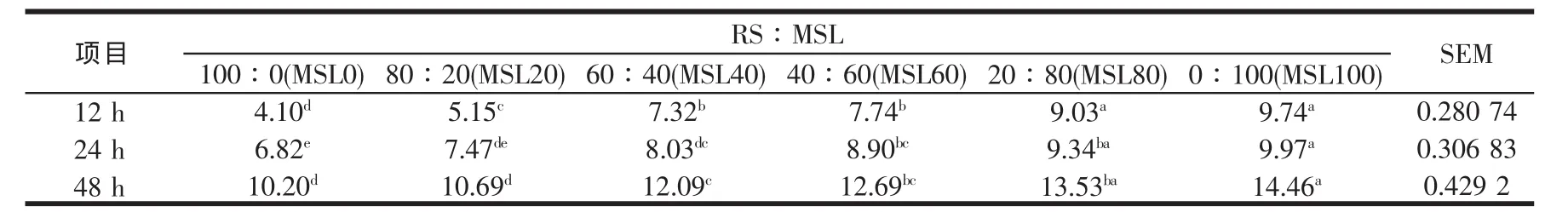
表7 稻草与不同比例苜蓿组合体外培养12~48 h丙酸产量的变化(mmol/l)
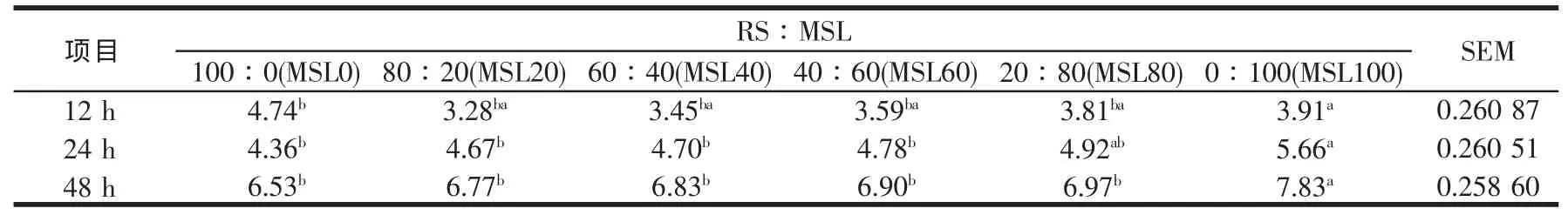
表8 稻草与不同比例苜蓿组合体外培养12~48 h丁酸的变化(mmol/l)
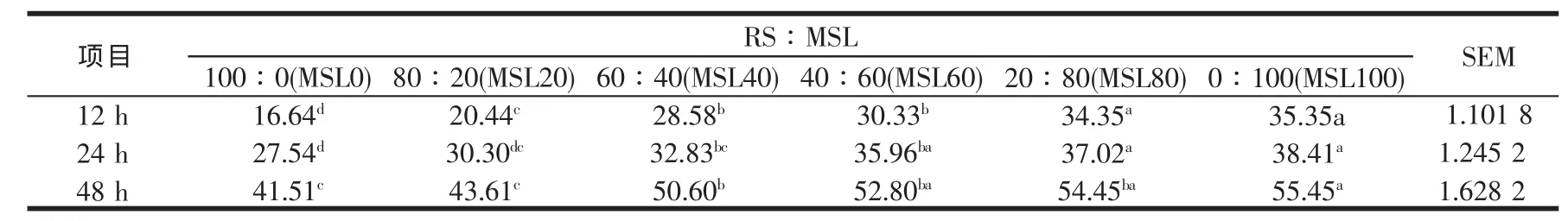
表9 稻草与不同比例苜蓿组合体外培养12~48 h总挥发性脂肪酸的变化(mmol/l)

表10 稻草与不同比例苜蓿组合体外培养12~48 h乙酸/丙酸摩尔比的变化
至于乙酸/丙酸比,RS与不同比例MSL组合体外培养12~48 h乙酸/丙酸摩尔比在所测定的时间点均随MSL比例的增加而减少,随培养时间的延长而增加,显著水平见表10。乙酸/丙酸比值在Sommart等[25]与段智勇[24]报道的范围内(2.11~2.56),较王旭[32]报道的要高,但纯稻草的乙酸/丙酸比值较Sommart等[25]报道的2.56与段智勇[24]报道的纯稻草NDF的2.53要低,造成这些差异的原因可能与发酵的基质、基质内不同组分的互作有关。Sinclair等[39]研究表明,根据碳水化合物和蛋白质在瘤胃的降解特性,通过日粮组分间的互补组合而使碳水化合物与蛋白质发酵同步,不仅可以改变瘤胃发酵类型,同时有利于维持瘤胃内环境的稳定。并指出能氮同步性高的日粮瘤胃挥发性脂肪酸(VFAs)稳定,且同步性效应对丙酸产量影响总趋势是同步性高,丙酸产量高,间接说明随着MSL的提高,基质的同步性提高。从表10还可以说明,RS添补不同比例的MSL没有改变瘤胃微生物的发酵类型,表明总体而言,总挥发性脂肪酸(VFAS)、乙酸与丙酸的摩尔比不受MSL所含瘤胃可降解蛋白的影响。但从表7可看出丙酸产量趋向随MSL水平的提高而提高,丙酸产量提高的速度要高于乙酸,乙酸与丙酸的摩尔比随MSL水平的提高而降低是由于丙酸产量提高所至。由于丙酸是反刍动物利用效率较高的一种挥发性脂肪酸,说明在适当的比例范围内(本研究中为40%~100%),尤其是在 60%~100%,“RS-MSL”组合的能量利用效率有提高的趋势,且这种能量利用效率似乎主要与MSL的添加比例成正比,这与段智勇[24]报道的能量的利用效率不存在正的组合效应甚至负的组合效应相一致。
2.4.2 总挥发性脂肪酸的组合效应(见表11)
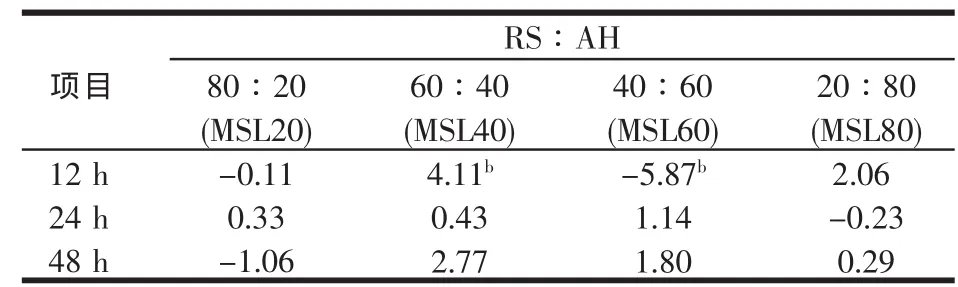
表11 稻草与不同比例苜蓿组合体外培养12~48 h总挥发性脂肪酸的组合效应
从表11可以看出,稻草与不同比例苜蓿组合体外培养12~48 h总VFAs的组合效应,除MSL40外,其余3组在不同时间点多为负值,即组合效应为负值。除在12 h,MSL40与MSL60组合效应显著(P<0.01)外,其余差异均不显著(P>0.05)。所测定时间点“RS-MSL”的组合效应变化不具规律性,在12 h与48 h MSL40的组合效应最大,而在24 h MSL60组合效应最大,表明对于多时间点的体外培养,用单项指标很难准确评定RS添补MSL的组合效应。
2.4.3 乙酸/丙酸摩尔比的组合效应(见表12)
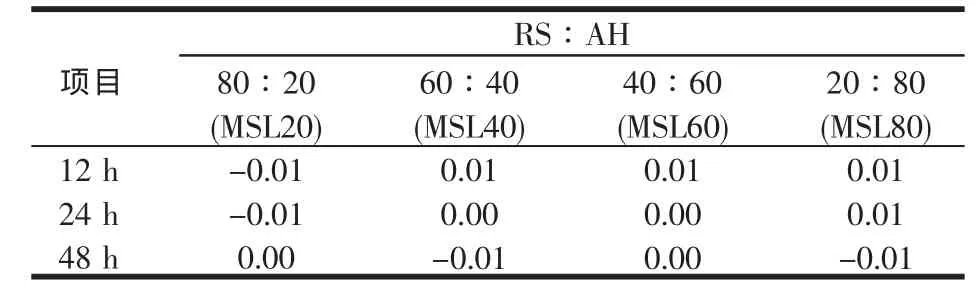
表12 稻草与不同比例苜蓿组合体外培养12~48 h乙酸/丙酸摩尔比的组合效应
从表12可知,稻草与不同比例苜蓿组合体外培养12~48 h乙酸/丙酸摩尔比的组合效应较小,甚至出现负值。负值表明乙酸/丙酸值降低,在能量利用率上表现了略正的组合效应。总体而言,稻草基础日粮添补不同比例的苜蓿后,在总VFAs与乙酸/丙酸摩尔比上不像产气那样表现出明显的组合效应。段智勇[24]在研究不同饲料(稻草、羊草与苜蓿)来源的NDF与不同来源的淀粉(玉米淀粉与小麦淀粉)的组合效应时发现,多数组合在产气量上发生正组合效应的同时,总挥发性脂肪酸浓度发生了正效应,乙丙酸比例也为正效应,表明脂肪酸浓度上升了,乙丙酸比例亦随之上升,即在发生组合效应时,能量的消化率上升,而其利用率则下降,本研究结果除乙酸/丙酸摩尔比的组合效应与段智勇[24]略有差异外,其余与段智勇[24]报道的基本相似。
2.5 微生物氮产量及其组合效应
2.5.1 微生物氮产量(见表13)
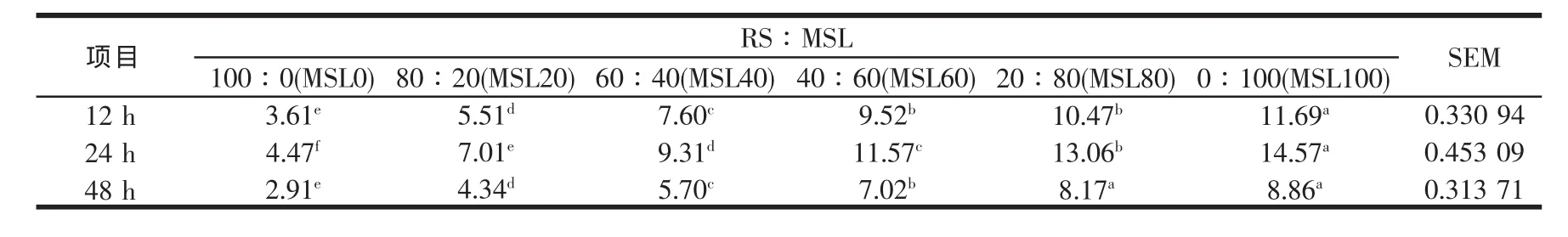
表13 稻草与不同比例苜蓿组合体外培养12~48 h微生物氮的变化(mg/100ml)
从表13可以看出,微生物氮(MN)随发酵基质中MSL比例的提高而增加,24 h前随发酵时间的延长而增加,在24 h达到最大值,随后下降,有关显著水平详见表13。培养初期可能由于底物中苜蓿细胞内容物中的非结构性碳水化合物,能为瘤胃微生物提供可消化的能量及苜蓿瘤胃降解蛋白所提供的营养素如氨(NH3)、肽与含硫氨基酸以及支链脂肪酸等,故可启动细菌生长,刺激纤维分解菌增殖,细菌总群落迅速增殖,直到底物中可利用能和可利用氮受到限制时,菌体蛋白合成开始下降。各处理组MN迅速增殖期均出现在培养24 h前,在24 h达到峰值,此后逐渐下降。Sommart等[37]亦发现体外微生物的合成效率在24 h后下降,这种下降与36 h后的NH3-N浓度下降同步。微生物的合成效率在24 h后下降可能与发酵基质减少有关,或与瘤胃微生物发生溶菌有关。本研究48 h的NH3-N浓度比24 h低,看来主要与发酵基质减少有关。
体外产气间接反映了用于发酵的底物中碳水化合物组分的降解,与挥发性脂肪酸(VFA)的产量呈正相关,但与微生物产量不一定呈正相关,甚至是负相关。Blümmer等[40]的研究证明,产气量或VFA与微生物产量呈负相关。本研究中的产气量、总VFA与MN除产气量的个别组外均随苜蓿在混合发酵基质中的比例升高而升高,也就是说这三者之间未出现负相关。
2.5.2 微生物氮产量的组合效应
稻草基础日粮添补不同比例苜蓿在微生物氮(MN)上的组合效应见表14,均为正组合效应。根据系统整体营养调控理论[41]原理,与单个粗饲料相比,由于多个粗饲料组成的混合发酵底物具有正组合效应,优化了微生物整体利用可发酵底物的能力[26],同时更接近供体瘤胃内底物组成,理论上菌体蛋白产量应该最大。Lee等[42]以稻草与精料配置了两种能氮释放同步和极不同步的日粮,体外培养结果表明同步性高的日粮微生物氮产量高。从本试验结果看,各时间点均以MSL60的组合效应最大,其次为MSL40的,说明稻草中添补60%或40%的苜蓿后营养素(能、氮)更加平衡,能氮释放同步性高于其它组,更能提高动物生产性能[43]。从而证实在以低质秸秆为基础的日粮中,适当补充蛋白质饲料(或氨基酸)、可发酵氮源,可以实现能氮的同步释放,激发饲料间正组合效应,充分发挥饲料的生产率。王旭[32]的研究亦证实了这一点,她在将玉米秸、谷草分别与沙打旺等量混合后,再将此混合粗饲料与精料按7:3混合,发现其微生物氮产生量远高于混合前各单个粗饲料以及各单个粗饲料与精料混合的产生量(P<0.05)。
在瘤胃内,日粮含氮物质和能量载体物质经瘤胃微生物的同化作用,以可利用养分的形式在微生物和动物机体之间协调分配。微生物对蛋白质和碳水化合物的利用具有明显的互作效应[44,45],瘤胃微生物氮的产量在很大程度上依赖于瘤胃内可利用能与可利用氮的利用率。瘤胃微生物生长受许多因素制约,其中当能量和养分之间的供给不匹配,尤其是当微生物对可利用能和可利用氮的利用不同步时,会限制微生物的生长。如果蛋白质不足或利用不充分,则会降低碳水化合物(CHO)的利用率;反之,如果CHO和蛋白质的利用不匹配,则会造成氮素(主要以氨的形式)损失。
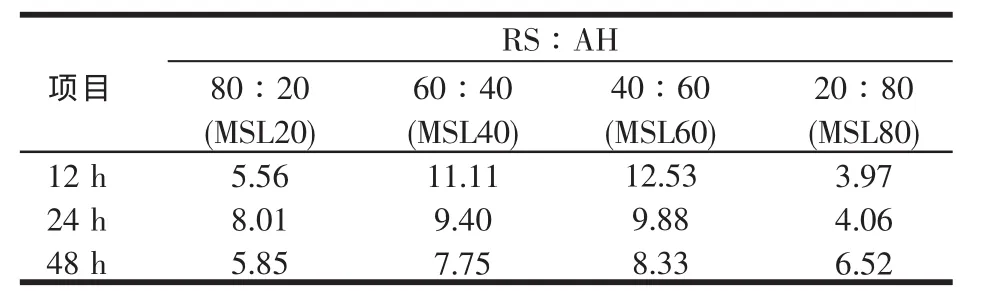
表14 稻草与不同比例苜蓿组合体外培养12~48 h微生物氮的组合效应
2.6 稻草与添补不同比例苜蓿体外发酵组合效应的综合评定
碳水化合物在瘤胃发酵释放的碳原子,主要被用于合成气体(CO2与CH4)、VFAs与微生物。其中VFAs与微生物经代谢为宿主(反刍动物)提供能量(占机体总能的70%~80%)与蛋白质,而气体则呼出体外。故在进行稻草与不同比例苜蓿体外发酵参数组合效应的综合评定时,主要选择产气量、总VFAs与微生物氮3个指标进行综合评定。
卢德勋[46]针对体外培养中多时间点、多指标组合效应的计算,提出了组合效应综合指数(MFAEI),对饲料间的组合效应进行了整体量化,由此可对饲料间组合效应的大小进行了直观而明确的比较。笔者集成现有组合效应的评定技术,改进了卢德勋[46]的MFAEI,经改进的组合效应综合评定指数(IMFAEI)的计算见下列公式。IMFAEI继承了卢德勋[46]MFAEI的整体观、动态观,不同点在于引入了现流行的单个时间点、单个指标组合效应的计算方法[20]。本研究在计算时IMFAEI只考虑产气量、总VFAs与微生物氮(MN)3个单项指标对组合效应的整体贡献。
单项组合效应值(SFAEI)的计算为:

注:A1系单一基础饲料秸秆(此为稻草,下同)各培养时间点(此为12 h、24 h与48 h,下同)各单一指标(此为GP,总 VFAs及MN)的组合效应值;A2为单一添补饲料(此为苜蓿)各培养时间点各单一指标的组合效应值;A3为A1与A2以不同比例构成的混合物各培养时间点各单一指标的组合效应值;C为基础饲料秸秆在混合饲料中的比例,(1-C)为添补饲料在混合饲料中的比例,A4为每个时间点A3总和。n为测定各单一指标组合效应值时间点的个数(此为3)。
多项组合效应值(MFAEI)的计算是将GP、总VFAs与MN的单项组合效应值(SFAEI)相加。
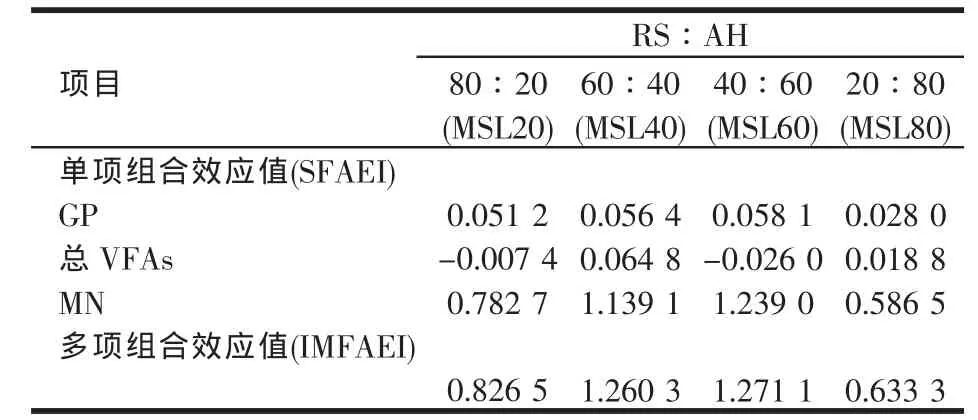
表15 稻草与不同比例苜蓿组合体外培养12-48 h组合效应的综合评定
从表15可以看出,稻草添补不同比例苜蓿的组合效应经 IMFAEI综合评定的结果为:MSL60>MSL40>MSL20>MSL80,与 GP、总 VFAs与 MN 评定结果的排序并不一致。本研究的结果表明,稻草基础日粮以添补40%~60%的苜蓿效果较好,能够实现组合效应的最大化。同时从表15还可以看出,稻草基础日粮中即使添补20%的苜蓿亦能取得较好的效果,添加80%的苜蓿组合效应值则显著降低。正如卢德勋[41]所指出的,任何问题都有一个“度”,而不是越多越好,适量才会出现正面效应,反之,出现负面效应。参木有[47]的研究证明反刍动物日粮中适宜的饲草替换秸秆的比例为30%~60%,本研究稻草基础日粮添补苜蓿的适宜比例在此范围内。
3 结论
本研究表明:稻草基础日粮以添补40%~60%的苜蓿效果较好。
[1]张吉鹍,包赛娜,邹庆华.稻草与不同饲料混合在体外消化率上的组合效应研究[J].草业科学,2010,27(11):137-144.
[2]张吉鹍.反刍动物秸秆基础日粮补饲苜蓿的组合效应[J].中国奶牛,2007(5):16-19.
[3]Dixon R M.Maximizing the rate of fibre digestion in the rumen[A].In Ruminant Feeding Systems Utilizing Fibrous Agricultural Residues(ed Dixon R M)[M].Camberra,ACT.Australia,1986:49-67.
[4]Topps JH.Forage legumes as protein supplements to poor quality diets in the semi-arid tropics [A].In Rumen Ecology Research Planning(eds.Wallace R J.and Lahlou-Kassi A).Proceedings of a Workshop held at ILRI[C].Addis Ababa,Ethiopia,1995:183-190.
[5]李占武.复合草颗粒生产及饲喂奶牛试验 [J].草业科学,2011,28(3):464-466.
[6]郭孝,介晓磊,哈斯通拉格,等.日粮中添加高微量元素苜蓿青干草对杜泊羊生产性能的影响[J].草业科学,2009,26(1):100-104.
[7]胡发成,段军红.苜蓿草粉代替奶牛饲料中部分精料的效果试验[J].草业科学,2006,23(5):72-74.
[8]夏先林,江萍,李时春,等.不同方式处理稻草和不同日粮组成育肥黄牛的饲养效果[J].草业科学,2003,20(6):30-31.
[9]阳伏林,龙瑞军,丁学智,等.秸秆和苜蓿干草不同比例组合对人工瘤胃pH、氨态氮及产气量的影响 [J].饲料工业,2007,28(17):50-53.
[10]唐赛涌,张永根.外法评定玉米青贮与稻秸之间组合效应的研究[J].饲料工业,2009,30(9):26-29.
[11]雷冬至,金曙光,乌仁塔娜.用体外产气法评价不同粗饲料与相同精料间的组合效应[J].饲料工业,2009,30(3):30-33.
[12]张吉鹍,刘建新.玉米秸秆与苜蓿之间组合效应的综合评定研究[J].饲料博览 (技术版),2007(3):5-10.
[13]AOAC.Official Methods of Analysis.Association of Official Analytical Chemists(15th Ed.)[M].DC,USA.,1990.
[14]Van Soest P J,Robertson J B,Lowis B A.Methods for dietary fiber,neutral detergent fiber,and nonstarch polysaccharides in relation to animal nutrition [J].Journal of Dairy Science,1991,74:3583-3597.
[15]Theodorou M K,Williams B A,Dhanoa M S,et al.A simple gas production method using a pressure transducer to determine the fermentation kinetics of ruminant feeds[J].Animal Feed Science and Technolgy,1994,48:185-197.
[16]Mauricio RM,Mould M L,Dhanoa M S,et al.A semi-automated in vitro gas production technique for ruminant feedstuff evaluation[J].Animal Feed Science and Technolgy,1999,79:321-330.
[17]冯宗慈,高民.通过比色测定瘤胃液氨氮含量方法的改进[J].内蒙古畜牧科学,1993(4):40-41.
[18]Zinn R A,Owens F N.A rapid procedure for purinemeasurement and it's use for estimating net ruminal protein synthesis[J].Canadian Journal of Animal Science,1986,66(1):157-166.
[19]Makkar H P S,Becker K.Purine quantification in digesta from ruminants by spectrophotometic and HPMSL methods[J].British journal of Nutrition,1999,81:107-112.
[20]Liu JX,Susenbeth A,Südekum K H.In vitro gas production measurements to evaluate interactions between untreated and chemically treated rice straws,grass hay,and mulberry leaves[J].Journal of Animal Science,2002,80:517-524.
[21]Henning PH,Steyn D G,Meissner H H.The effect of energy and nitrogen supply pattern on rumen bacterial growth in virto[J].Animal Production,1991,53:165-175.
[22]Pirt S J.Principles of Microbe and Cell Cultivation[A].Blackwell science[M].Oxford,UK.1975.
[23]Mould F L,Orskov E R,Mann SO.Associative effects ofmixed feeds.1.Effects of type and level of supplementation and the influence of the rumen fluid pH on cellulolysis in vivo and dry matter digestion of various roughages.Animal Feed Science and Technolgy,1983/1984,12:241-251.
[24]段智勇.反刍动物日粮中淀粉与纤维的组合效应及其机理的研究[J].杭州:浙江大学动物科学学院,2006.
[25]Sommart K,Parker D S,Rowlinson P,et al.Fermentation characteristics and microbial protein synthesis in an in vitro system using cassava,rice straw and dried ruzi grass as substrates.Asian-Australasian Journalof Animal-Science,2000,8:1084-1093.
[26]Clark JH,Klusmeyer T H,Cameron M R.Symposium:Nitrogen Metabolism and amino acid nutrition in dairy cattle:Microbial Protein Synthesis and Flows of Nitrogen Fractions to the Duodenum ofDairy Cows[J].JournalofDairy Science,1992,75:2304-2323.
[27]Owens F N,Bergen W G.Nitrogen metabolism of ruminant animals:Historical perspective,current understanding and future implications.Journal of Animal Science,1983,57(Suppl.2):498.
[28]National Research Council.Ruminant nitrogen usage[M].Proceedings of the National Academy of Sciences,Washington,DC.1985.
[29]Schaefer D M,Davis C L,Bryant M P.Ammonia saturation constants for predominant species of rumen bacteria.Journal of Dairy Science,1980,63:1248.
[30]Petersen M K.Nitrogen supplementation of grazing liverstock[A].In:Proceeding Grazing Liverstock Nutrition Conference[C],University ofWuoming,Jackson.1987:115-122.
[31]HooverW H.Chemical factors involved in ruminal fiberdigestion[J].Journal of Dairy Science,1986,69:2755-2766.
[32]王旭.利用GI技术对粗饲料进行科学搭配及绵羊日粮配方系统优化技术的研究[D].呼和浩特:内蒙古农业大学动物科学与医学院,2003.
[33]布同良.体外产气法评定青贮玉米、羊草和苜蓿草之间的组合效应[D].杭州:浙江大学动物科学学院,2006.
[34]Sampath K T,Wood C D,Prasad C S.Effect of urea and byproducts on the in vitro fermentation of untreated and urea treated fingermillet straw[J].Journal of the science of food and agriculture,1995,67:323-328.
[35]Cone JW,Van Gelder A H.The influence of protein fermentation on gas production profiles[J].Animal Feed Science and Technolgy,1999,76:251-264.
[36]Groot C J,Cone JW,Williams B A,et al.Multiphasic analysis of gas production kinetics for in vitro fermentation of ruminant feeds[J].Animal Feed Science and Technolgy,1996,64:77-89.
[37]Sommart K.The use of cassava in ruminant diets based on low quality roughages[D].Ph.D.Thesis.University of Newcastle upon Tyne,Newcastle upon Tyne,England.1998.
[38]фrskov E R,McDonald I.The estimation of protein degradability in the rumen from incubation measurementsweighted according to rate ofpassage[J].Journalofagriculturalscience,1979,92:499-503.
[39]Sinclair L A,Garnsworthy PC,Newbold JR,et al.Effect of synchronizing the rate of dietary energy and nitrogen release in diets with a similar carbohydrate composition on rumen fermentation and microbial protein synthesis in sheep[J].Journal of agricultural science,1995,124:463-472.
[40]Blümmel M,Becker K.The degradability characteristics of 54 roughages and neutral detergent fibre as described by gas production and their relationship to voluntary feed intake[J].British Journal of Nutrition,1997,77:757-768.
[41]卢德勋.反刍动物营养调控理论及其应用[J].内蒙古畜牧科学(特刊).
[42]Lee H J,Kim E J,Maeng W J,Cockburn.JE,Scollan N D.Effects of dietary asynchrony on rumen function studies using rumen simulation continuous culture [A],Proceedings of the British sociery of Animal science Annual Meeting[C],1997,203.
[43]FranciO,Acciaioli A.Mathematicalmodels for the innovative interpretation of the associative effect[J].Options Méditerranéennes,Seire B,Etudes et Recherches,1998,17:73-78.
[44]Nocek JE.In situ and othermethods to estimate ruminal protein and energy digestibility[J].a review.Journal of Dairy Science,1988,71:2051-2069.
[45]Oldham JD.Protein-energy interrelationships in dairy cows[J].Journal of Dairy Science,1984,67:1090.
[46]卢德勋.见:王旭.利用GI技术对粗饲料进行科学搭配及绵羊日粮配方系统优化技术的研究[D].呼和浩特:内蒙古农业大学动物科学与医学院,2003.
[47]参木有.玉米秸秆不同加工调制技术的效果和方法研究 [D].呼和浩特:内蒙古农业大学动物科学与医学院,2001.
(编辑:刘敏跃,lm-y@tom.com)
Com prehensive study of associative effects of rice straw m ixed w ith vary levels of M edicago sativa L.on in vitro fermentation parameters
Zhang Jikun,Zou Qinghua,Wang Jinfen,Xiong Ligen
To overall evaluation research the associative effects of rice straw(RS)supplemented with Medicago sativa L.(MSL)on in vitro fermentation parameters.48 h in vitro batch incubation was practiced in a single-factor randomized design to investigate the associative effects of RSmixed with varying MSL levels of 0,20%,40%,60%,80%and 100%(MSL0,MSL20,MSL40,MSL60,MSL80 and MSL100)on in vitro fermentation traits at 12,24 and 48 h individually,and the improved multiple-factors associative effects index (IMFAEI)was used.The range of parameters of various groups at different time was:pH 6.75~6.88,NH3-N 3.11~28.74 mg/100ml,MN 2.91~14.57 mg/ml.48 h cumulative gas production and total volatile fatty acids were 120.1~162.4ml/g OM and 41.51-55.45mmol/l individually.The IMFAEI ranked from greatest to least in the following order:MSL60(1.2711),MSL40(1.2603),MSL20(0.8265),and MSL80(0.6333).40%~60%MSL is the optimal volume supplemented to ruminant RS basal diet.
rice straw;medicago sativa L.;in vitro fermentation;associative effects;comprehensiveevaluation
S816.32
A
1001-991X(2011)17-0040-09
张吉鹍,江西省农业科学院畜牧兽医研究所,博士,研究员,330200,江西南昌莲塘南莲路602号。
邹庆华、熊立根,单位及通讯地址同第一作者。
王金芬,山东省滨州职业学院。
2011-04-25
反刍动物饲料安全评价项目、国家自然科学基金[31060313]与江西自然科学基金[2008GZN0007]资助
