白萝卜提取物对大鼠非酒精性脂肪肝的药效作用
由 宏,郝 睿,赵功玲,朱本忠,朱 毅,*,罗云波
(1.中国农业大学食品科学与工程学院,北京 100083;2.河南科技学院食品学院,河南 新乡 453003)
白萝卜提取物对大鼠非酒精性脂肪肝的药效作用
由 宏1,郝 睿1,赵功玲2,朱本忠1,朱 毅1,*,罗云波1
(1.中国农业大学食品科学与工程学院,北京 100083;2.河南科技学院食品学院,河南 新乡 453003)
研究白萝卜提取物对大鼠非酒精性脂肪肝病的影响。实验用白萝卜提取物采用旋转蒸发的方法制备,使用脂肪乳剂灌胃法进行造模,设置低、中、高3个剂量处理组,分别以0.3、1、3mL/kg的剂量对SD大鼠进行灌胃。实验8周后观察各组大鼠的肝部组织病理学特点,并对血清中的脂类以及脂质过氧化相关酶类进行检测。结果显示:与模型组相比,雄性高剂量处理组大鼠血清甘油三酯(TG)以及丙二醛(MDA)水平明显降低,而还原性谷胱甘肽(GSH)明显增高。此外,肝脏病理切片显示白萝卜提取物有助于缓解脂肪在雄性大鼠肝中的积聚,而雌性大鼠的相关指标并无显著性差异。因此,白萝卜提取物可降低雄性非酒精性脂肪肝大鼠体内的脂质过氧化程度,从而起到延缓其非酒精性脂肪肝发展的作用。
非酒精性脂肪肝;白萝卜提取物;病理学诊断
非酒精性脂肪肝(nonalcoholic fatty liver disease,NAFLD)是一种无过量饮酒史的以肝实质细胞脂肪变性和脂肪储积为特征的临床病理综合征,肝脏组织学活检表现为肝细胞脂肪储积、小叶内炎症伴气球样变、纤维化或Mallory透明小体[1]。包括单纯性脂肪肝(liver steato)、脂肪性肝炎(nonalcoholic steatohepatitis, NASH)和脂肪性肝硬化3个阶段[2]。形成NAFLD的原因有很多,这其中主要包括日常膳食的营养、使用药物的情况、家族基因遗传情况等。目前对实验动物的非酒精性脂肪肝造模方法主要分为基因缺陷型造模法(如使用瘦素受体缺陷性db/db小鼠作为实验动物)[3],营养缺陷型造模法(如使用无蛋氨酸和胆碱的饲料喂养实验动物)[4-5]或营养过剩型造模法(如使用高脂饲料喂养实验动物)[6-8]等。由于更加贴近人类患者的发病过程,营养过剩型造模法被更广泛的使用。
白萝卜(Raphanus sativus L.)既是人们喜食的蔬菜又是我国中医治疗常用的药物,其性味辛甘而凉;入肺、胃两经;具有消除积滞、清热化痰、宽中下气之功效[9]。近年来,国内外对白萝卜的研究逐渐增多,蒋全德等[10]通过实验表明白萝卜提取物能够使大鼠胃排空加快,并且这种促进作用存在量-效关系。而脂肪类物质的加速排空可以缩短其在体内的保留时间,从而对脂肪在肝中的积聚起到缓解作用。JRS(日本白萝卜提取物)也被证明对碳水化合物和脂类代谢都有着有益的影响[11]。此外,白萝卜提取物中含有一种生物活性很强的芥子油苷(4-(methylthio)-3-butenyl isothiocyanate),其已被证明有突出的抗癌、抗氧化、抗菌以及抗突变的能力[12-14]。
本实验以SD大鼠为研究对象,通过观察肝脏病理学切片以及各项相关生化指标,评价白萝卜提取物对非酒精性脂肪肝病的治疗与缓解作用,为开发利用白萝卜及其提取物的药用价值提供实验依据。
1 材料与方法
1.1 材料、试剂与仪器
体质量180~200g的健康成年Sprague-Dawley(SD)大鼠50只,雌雄各半,由北京军事科学院动物所提供。
新鲜白萝卜,品种为长春大根,购自北京天安农业有限公司。
造模用脂肪乳配方参考Zou等[15]的制作方法,原材料均由北京华阜康生物科技股份有限公司提供。配方如下:猪油400g、蔗糖150g、全脂奶粉80g、胆固醇100g、脱氧胆酸钠10g、吐温-80 36.4g、陶氏丙二醇31.1g、盐10g、饮用水300g、维生素粉2.5g、矿物质粉1.5g。
甘油三酯(TG)、总胆固醇(TC)、丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、高密度脂蛋白胆固醇(HDL-C)、丙二醛(MDA)和还原型谷胱甘肽(GSH)试剂盒 南京建成生物工程有限公司;其余试剂由北京化工厂生产并提供。
RE-52旋转蒸发仪 上海亚荣生化仪器厂。
1.2 白萝卜提取物的制备
36kg新鲜白萝卜,将白萝卜洗净切块后使用自制小型工业榨汁机对其破碎压榨,压榨过程中不断加入水和已经榨出的白萝卜汁,8层纱布过滤去掉沉渣后收集滤汁。将滤汁放入旋转蒸发仪中进行浓缩后得到白萝卜粗提物,其为黄绿色略有黏稠的液体。提取率5.72%,粗提物浓缩后1mL相当于原生药34.8g。
1.3 动物饲养及分组
大鼠50只,雌雄各半,随机平均分组情况如下:Ⅰ组为空白组,Ⅱ组为模型组,Ⅲ组、Ⅳ组和Ⅴ组分别为低、中、高剂量处理组(每日以0.3、1、3mL/kg剂量的白萝卜提取物灌胃)。雌雄分开饲养。
1.4 造模方法
适应性喂养动物一周后,除空白组外,其余各组大鼠每日以10mL/kg剂量灌胃脂肪乳。每日上午一次,连续4周。普通饲料和饮用水自由摄取。低、中、高剂量处理组在脂肪乳内分别加入不同剂量的白萝卜提取物(0.3、1、3mL/kg,以体质量计)。空白对照组、造模组和低、中剂量组以高剂量组的摄入液体体积为基准,使用同体积的生理盐水进行灌胃处理。
1.5 标本的采集和处理
在第4周最后一次给药后,对实验大鼠禁食处理12h,使用无水乙醚对其进行麻醉,取血后脱颈椎处死。观察外观后迅速解剖,取出肝脏后放入4%多聚甲醛溶液中进行保存。检测时使用石蜡包埋后切片,用HE法染色,光镜下观察组织病理学的变化。取出的血液于37℃水浴30min 后以4000r/min离心7min。取血清后放置于-80℃冰箱保存。血清生化指标采用试剂盒酶法检测。
1.6 测定指标
动物血清中指标包括甘油三酯(TG)、总胆固醇(TC)、丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、高密度脂蛋白胆固醇(HDL-C)、丙二醛(MDA)和还原型谷胱甘肽(GSH)均由北京德易生物医学技术有限公司使用商业用试剂盒进行检测,肝脏病理学HE染色切片由北京302医院病理科制作并拍照。
1.7 肝细胞脂肪变性程度评级
对每只大鼠肝细胞脂肪变性程度采用Yalniz等[16]的评级标准进行评价:组织病理学切片视野中未见细胞有脂肪变性的为0级;少于25%的细胞有脂肪变性情况的为1级;25%~50%的细胞有脂肪变性情况的为2级;50%~75%的细胞有脂肪变性情况的为3级;大于75%的细胞有脂肪变性情况的为4级。
1.8 数据处理方法
数据均采用SPSS 17.0软件进行单因素方差分析(ANOVA)和Duncan多重比较检验进行分析。实验结果以x±s表示,采用组间t检验,P<0.05为有显著性差异。
2 结果与分析
2.1 常规观察
空白对照组动物皮毛光亮整洁,行动灵活,反应迅速,体形变化较为规律。造模模型动物目光较为呆滞,精神萎靡,反应迟钝,腰围增长很快。提取物处理组的大鼠相对模型组而言情况有所缓和。不同性别的同组大鼠特征有细微差别,雄鼠治疗效果较为明显。
2.2 肝脏及其他脏器观察
空白对照组大鼠肝脏颜色鲜红,表面光滑,边缘较为锐利。造模组大鼠肝脏体积明显增大,颜色较浅并发黄,表面无光泽,边缘变钝,切面有油腻感。高剂量白萝卜提取物处理组的大鼠肝脏与空白对照组较为相似,低、中剂量白萝卜提取物处理组的治疗效果不明显,但比造模组的情况略有好转。
2.3 肝脏组织病理学检测

图1 各组雄性大鼠肝脏HE染色切片结构(×100)Fig.1 HE stained hepatic sections from different groups (×100)
病理学研究表明,雄性空白对照组大鼠的HE染色切片在光镜下结构清晰,肝细胞排列整齐,肝细胞核结构清晰,并无明显病变。雄性造模组大鼠的肝脏切片普遍显示肝细胞变大、肿胀,胞浆内脂滴将肝细胞核挤到边缘,病变以中央静脉周围最为明显并以其为中心向外扩散。白萝卜提取物处理组的雄性大鼠肝组织切片在光镜下较造模组有着不同程度的改善,呈现较轻的肝脂肪病变,肝细胞形态大体空白,如图1所示。雌性大鼠的肝脏病理学变化并不明显,未在文中提供。
2.4 各组大鼠肝细胞脂肪变性程度评级
评级结果显示,雄性大鼠的空白对照组中平均肝细胞脂肪变性等级为0。造模组为1.60±0.55,低剂量处理组为1.00±0.71,中剂量处理组为1.20±0.45,高剂量处理组为0.40±0.55。其中空白对照组和高剂量处理组等级显著低于其他各组等级(P<0.05)。雌性大鼠的评级结果均无显著性差异。
2.5 各组大鼠血清TC、TG和HDL-C水平比较
如表1所示,造模组与空白对照组大鼠相比较,雄性组的血清TC、TG水平都有一定增加,而HDL-C水平有一定程度的降低,但均无显著性差异。与造模组相比,高剂量处理组的雄性大鼠血清中TG水平显著降低(P<0.05),而低、中剂量组的降低效果并不明显。而雌性造模组大鼠的HDL-C水平相对空白对照组显著降低,而雌性高剂量处理组的HDL-C水平与空白对照组相比无显著性差异。
2.6 各组大鼠血清AST、ALT和AST/ALT的水平比较
如表2所示,造模组雄性大鼠与空白对照组相比较,AST/ALT值显著降低(P<0.05),而低、中剂量处理组与空白对照组相比较则无显著性差异。高剂量处理组的AST/ALT值比所有其他组都有显著性增高(P<0.05)。对雌性大鼠的研究表明,虽然低、高剂量处理组的AST/ALT值都比造模组有一定的增高,但差异并无显著性。

表1 白萝卜提取物对各组大鼠血清TG、TC和HDL-C值的影响(n=5)Table 1 Effect of white radish extract at different doses on serum TG, TC and HDL in SD rats (n=5)

表2 白萝卜提取物对各组大鼠血清AST、ALT和AST/ALT值的影响(n=5)Table 2 Effect of white radish extract at different doses on serum AST, ALT and AST/ALT in SD rats (n=5)
2.7 各组大鼠血清MDA和GSH水平比较
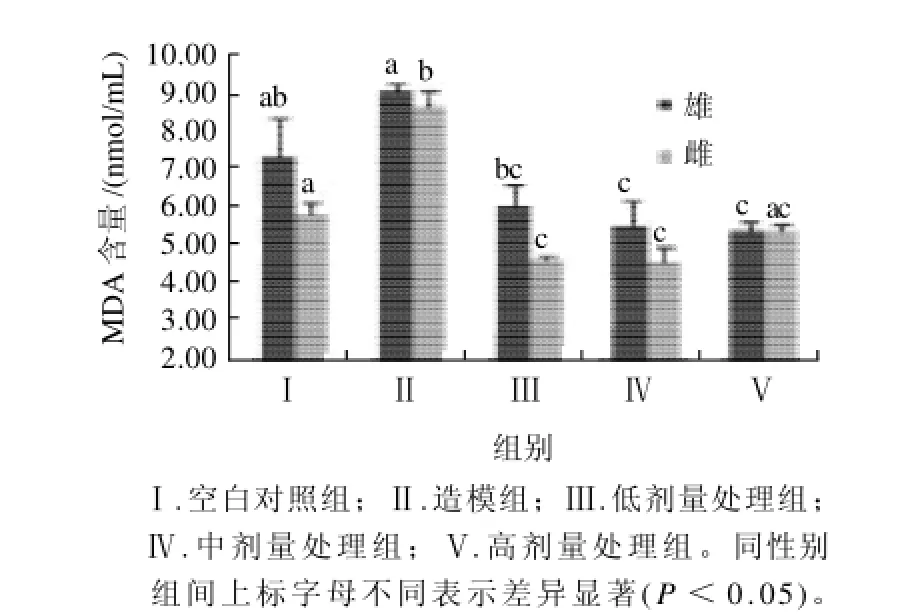
图2 各组大鼠血清丙二醛的水平比较(n=5)Fig.2 The serum MDA levels in rats from different experimental groups (n=5)
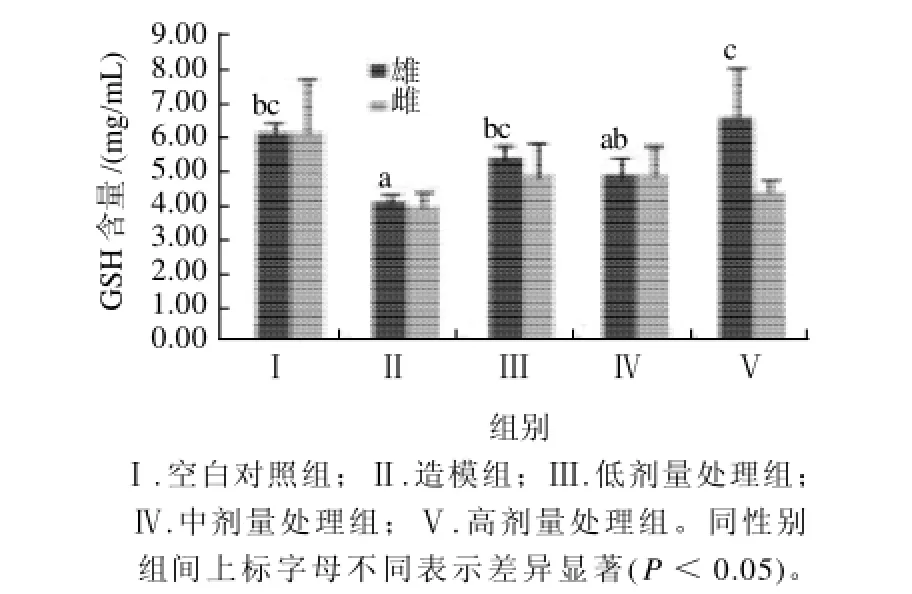
图3 各组大鼠血清还原型谷胱甘肽的水平比较(n=5)Fig.3 The serum GSH levels in rats from different experimental groups (n=5)
如图2、3所示,本实验中雄性造模组大鼠血清中的MDA含量较空白对照组有一定的增高,而GSH含量水平则有显著性的降低,白萝卜提取物对这两种脂质过氧化相关指标的影响非常明显。相对于疾病造模组,处理组雄性大鼠的血清MDA水平显著性降低(P<0.05),而低、高剂量组的GSH水平显著性增高(P<0.05)。
3 讨 论
本实验通过强饲法使SD大鼠摄入脂肪乳剂4周,成功地在实验动物体内模拟出了非酒精性脂肪肝的基本症状。但由各组大鼠肝细胞脂肪变性程度评级结果可以看出造模组大鼠的评级并未达到文献中提及的高度[16]。此外,病理学切片并未显示实验动物肝部出现纤维化以及严重功能性损伤。因此可以判断本实验中的造模组动物仅患有肝部单纯性脂肪病变,处于非酒精性脂肪肝第一阶段。
通过解剖后对脏器的观察,肝细胞脂肪变性程度评级以及病理学切片可以得出每日定量摄入的白萝卜提取物(3mL/kg)对高脂饲料诱导的雄性实验大鼠肝部脂肪过度聚集、肝细胞脂肪变性都有较为明显的改善作用。
对各组大鼠的血脂状况研究表明,高剂量的白萝卜提取物显示出了较强的降低雄性大鼠血清中TG的能力。同时,高剂量白萝卜提取物的处理对于缓解雌性大鼠由高脂饲料所诱导的高密度脂蛋白水平降低有着一定的效果。这表明高剂量的白萝卜提取物对于大鼠的血脂代谢异常有着一定的药效。
血清中的氨基转移酶水平的变化是衡量肝功能的重要指标,AST/ALT值是近年来被广为承认的一个评价脂肪肝发病严重情况的数据[17-18],AST/ALT值越大证明肝脏越健康。对实验动物的氨基转移酶水平的检测结果表明,白萝卜提取物对雄性大鼠的肝部有较为显著的保护作用,对雌性则并无显著影响。此外,在本实验中高剂量处理组的雄性大鼠的AST/ALT值显著高于空白组(P<0.05),而是否过高的AST/ALT值代表一些负面的影响还有待于进一步的研究。
MDA是体内脂质过氧化的最终产物,血清内MDA的大量增加证明机体内脂质过氧化反应的增多,非酒精性脂肪肝的发病原因之一就是肝脏聚集的自由基过多。而过量的自由基引导的过氧化反应可以破坏细胞膜的完整性从而导致肝细胞的破坏。GSH是机体合成的抗氧化剂和自由基清除剂,由其制成的药物阿拓莫兰是治疗非酒精性脂肪肝的重要辅助药物。对于雌性大鼠而言,白萝卜提取物对其血清MDA的含量水平同样有显著性的治疗效果,各组间雌性大鼠的GSH值虽表现出一定规律,但并未显示显著性差异。本实验中白萝卜提取物可以有效抑制雌雄两种性别大鼠体内由于摄入高脂食品带来的MDA大量增加。而其保护GSH不被破坏并刺激GSH生成的能力则主要在雄性大鼠体内体现。总体而言,相对于雄性大鼠,雌性大鼠的实验结果大多在组间没有显著性差异,这有可能表明雌性大鼠的肝脂代谢系统对外界的各种胁迫抗性都较雄性的更大。
莱菔(白萝卜)做为传统中药一直以整体进行应用,因此本实验中白萝卜提取物的成分并未被单独研究。但因为本实验证明白萝卜提取物对机体的抗氧化系统有很强的保护作用,所以可推断其主要成分可能是由天然强抗氧化剂异硫氰酸盐(isothiocyanate)[19]以及多酚、黄酮、抗坏血酸和过氧化物酶等有较强的抗氧化能力的物质组成[20]。
4 结 论
本动物实验证明高剂量(3mL/kg,相当于生药104g)白萝卜提取物对非酒精性脂肪肝的发展有较强的抑制作用,其原因可能来自于白萝卜提取物较强的抗脂质过氧化能力以及降低血液中甘油三酯积聚的能力。此外,本实验表明性别与脂肪肝的发病与治疗效果有一定的关系,而对这方面的深入认识还有待于进一步的研究。
[1] ALLARD J P, AGHDASSI E, MOHAMMED S, et al. Nutritional assessment and hepatic fatty acid composition in non-alcoholic fatty liver disease (NAFLD): a cross-sectional study[J]. Journal of Hepatology, 2008, 48(2): 300-307.
[2] FARRELL G C, LARTER C Z. Nonalcoholic fatty liver disease: from steatosis to cirrhosis[J]. Hepatology, 2006, 43(2 Suppl 1): 99-112.
[3] NAGAO K, INOUE N, INAFUKU M, et al. Mukitake mushroom (Panellus serotinus) alleviates nonalcoholic fatty liver disease through the suppression of monocyte chemoattractant protein 1 production in db/ db mice[J]. Journal of Nutritional Biochemistry, 2010, 21(5): 418-423.
[4] USTUNDAG B, BAHCECIOGLU I H, SAHIN K, et al. Protective effect of soy isoflavones and activity levels of plasma paraoxonase and arylesterase in the experimental nonalcoholic steatohepatitis model[J]. Digestive Diseases and Sciences, 2007, 52(8): 2006-2014.
[5] LARTER C Z, YEH M M, HAIGH W G, et al. Hepatic free fatty acids accumulate in experimental steatohepatitis: role of adaptive pathways[J]. Journal of Hepatology, 2008, 48(4): 638-647.
[6] LIEBER C S, LEO M A, MAK K M, et al. Model of nonalcoholic steatohepatitis[J]. American Journal of Clinical Nutrition, 2004, 79(3): 502-509.
[7] BAUMGARDNER J N, SHANKAR K, HENNINGS L, et al. A new model for nonalcoholic steatohepatitis in the rat utilizing total enteral nutrition to overfeed a high-polyunsaturated fat diet[J]. American Journal of Physiology - Gastrointestinal and Liver Physiology, 2007, 294(1): G27-G28.
[8] DENG Qinggao, SHE Hongyun, CHENG J H, et al. Steatohepatitis induced by intragastric overfeeding in mice[J]. Hepatology, 2005, 42(4): 905-914.
[9] 蒋全德, 王景杰, 黄裕新. 白萝卜及其提取物对胃肠动力作用的研究现状及展望[J]. 胃肠病学和肝病学杂志, 2006(3): 312-317.
[10] 蒋全德, 王景杰, 刘琳娜, 等. 白萝卜提取物对大鼠胃肠动力影响的实验研究[J]. 胃肠病学和肝病学杂志, 2006(3): 292-294.
[11] TANIGUCHI H, KOBAYASHI-HATTORI K, TENMYO C, et al. Effect of Japanese radish (Raphanus sativus) sprout (Kaiware-daikon) on carbohydrate and lipid metabolisms in normal and streptozotocin-induced diabetic rats[J]. Phytotherapy Research, 2006, 20(4): 274-278.
[12] BEEVI S S, MANGAMOORI L N, DHAND V, et al. Isothiocyanate profile and selective antibacterial activity of root, stem, and leaf extracts derived from Raphanus sativus L.[J]. Foodborne Pathogens and Disease, 2009, 6(1): 129-136.
[13] SHISHU, KAUR I P. Inhibition of cooked food-induced mutagenesis by dietary constituents: comparison of two natural isothiocyanates[J]. Food Chemistry, 2009, 112(4): 977-981.
[14] BEN SALAH-ABBES J, ABBES S, ABDEL-WAHHAB M A, et al. Raphanus sativus extract protects against Zearalenone induced reproductive toxicity, oxidative stress and mutagenic alterations in male Balb/c mice[J]. Toxicon, 2009, 53(5): 525-533.
[15] ZOU Yuhong, LI Jun, LU Chao, et al. High-fat emulsion-induced rat model of nonalcoholic steatohepatitis[J]. Life Sciences, 2006, 79(11): 1100-1107.
[16] YALNIZ M, BAH ECIOGLU I H, KUZU N, et al. Amelioration of steatohepatitis with pentoxifylline in a novel nonalcoholic steatohepatitis model induced by high-fat diet[J]. Digestive Diseases and Sciences, 2007, 52(9): 2380-2386.
[17] AHMED U, REDGRAVE T G, OATES P S. Effect of dietary fat to produce non-alcoholic fatty liver in the rat[J]. Journal of Gastroenterology and Hepatology, 2009, 24(8): 1463-1471.
[18] OHGO H, YOKOYAMA H, HIROSE H, et al. Significance of ALT/AST ratio for specifying subjects with metabolic syndrome in its silent stage [J]. Diabetes and Metabolic Syndrome: Clinical Research and Reviews, 2009, 3(1): 3-6.
[19] NAKAMURA Y, IWAHASHI T, TANAKA A, et al. 4-(Methylthio)-3-butenyl isothiocyanate, a principal antimutagen in daikon (Raphanus sativus; Japanese white radish)[J]. Journal of Agricultural and Food Chemistry, 2001, 49(12): 5755-5760.
[20] WANG Linsong, WEI Liqin, WANG Lin, et al. Effects of peroxidase on hyperlipidemia in mice[J]. Journal of Agricultural and Food Chemistry, 2002, 50(4): 868-870.
Effect of White Radish Extract on Nonalcoholic Fatty Liver Diseases in SD Rats
YOU Hong1,HAO Rui1,ZHAO Gong-ling2,ZHU Ben-zhong1,ZHU Yi1,*,LUO Yun-bo1
(1. College of Food Science and Nutritional Engineering, China Agricultural University, Beijing 100083, China;2. School of Food Science, Henan Institute of Technology, Xinxiang 453003, China)
In order to exploit the medicinal value of white radish, the effect of white radish extract on the amelioration of nonalcoholic fatty liver diseases in SD rats was explored. The white radish extract was prepared with a rotary evaporator. The rats in model group were treated with fat emulsion with white radish extract by gavage at the doses of 0.3, 1 mL/kg and 3 mL/kg. The pathological characteristics of liver tissues in rats with 8 weeks experiments were analyzed. Meanwhile, serum lipid and lipid peroxidases were determined. The results indicated that white radish extract at a high dose could significantly decrease the levels of serum TG and MDA and increase the levels of GSH in male rats. Moreover, white radish extract could alleviate the accumulation of lipid in the hepatocytes of male rats. However, no obvious change of these parameters in female rats was observed. Therefore, white radish extract can ameliorate nonalcoholic fatty liver diseases in SD male rats by decreasing the level of lipid peroxidation.
nonalcoholic fatty liver disease;white radish extract;pathological diagnosis
R151.3
A
1002-6630(2011)07-0300-05
2010-09-06
中央高校基本科研业务费专项资金项目(2009-1-86)
由宏(1986—),男,硕士研究生,研究方向为食品科学。E-mail:a_you_hong@163.com
*通信作者:朱毅(1973—),女,副教授,博士,研究方向为食品科学。E-mail:zhuyi_cau@126.com

