孔雀石绿抗原的合成及多克隆抗体的制备
王 梅,徐乃丰,刘丽强,匡 华,林 菲,宋珊珊,王泽路,胥传来,*
(1.苏州大学分析测试中心,江苏 苏州 215123;2.江南大学食品学院,江苏 无锡 214122)
孔雀石绿抗原的合成及多克隆抗体的制备
王 梅1,徐乃丰2,刘丽强2,匡 华2,林 菲2,宋珊珊2,王泽路2,胥传来2,*
(1.苏州大学分析测试中心,江苏 苏州 215123;2.江南大学食品学院,江苏 无锡 214122)
通过研究孔雀石绿(MG)抗原的合成和多克隆抗体的制备,探索研究食品中孔雀石绿残留的检测方法。本实验先合成含有羧基的孔雀石绿半抗原(CMG),并用液-质联用法进行分析鉴定。半抗原经重氮化法处理后分别偶联两种载体蛋白BSA和OVA,并通过紫外分光光度法进行鉴定。与CMG标准品和两种载体蛋白的紫外吸收光谱相比,偶联物的吸收峰发生了明显的偏移,计算得免疫原的偶联比为10.6:1,说明偶联成功。通过免疫制备多克隆抗体,并通过间接ELISA法对CMG抗血清的效价进行检测,并进一步检测抗体的特异性,两只兔子的IC50值分别为8.1ng/mL和4.6ng/mL。
孔雀石绿;抗原;多克隆抗体;间接ELISA法
孔雀石绿(CMG)(结构式见图1)是一种工业染料,具有抗菌杀虫作用,被广泛应用于真丝、羊毛、皮革、麻制品、陶瓷制品和棉布等的染色中;还可用作生物染色剂,将细胞或组织染成蓝绿色,以便于在显微镜下观察[1-5]。利用血液中的血色素催化隐性孔雀石绿与过氧化氢反应,使无色的隐性孔雀石绿转变为孔雀石绿的现象,在刑侦中可用于检测不易察觉的血迹。另外,孔雀石绿能抑制细胞分裂,从而产生良好的抗菌和杀菌作用。由于价格低廉,孔雀石绿曾被广泛地用于预防和治疗水产品的水霉病、鳃霉病和寄生虫病等;也曾被用于水产品的运输和存放过程[6-11]。但是孔雀石绿具有高毒性、高残留和致癌、致畸和致突变作用,严重威胁人类健康,因此检测孔雀石绿残留具有十分重要的意义[12-16]。
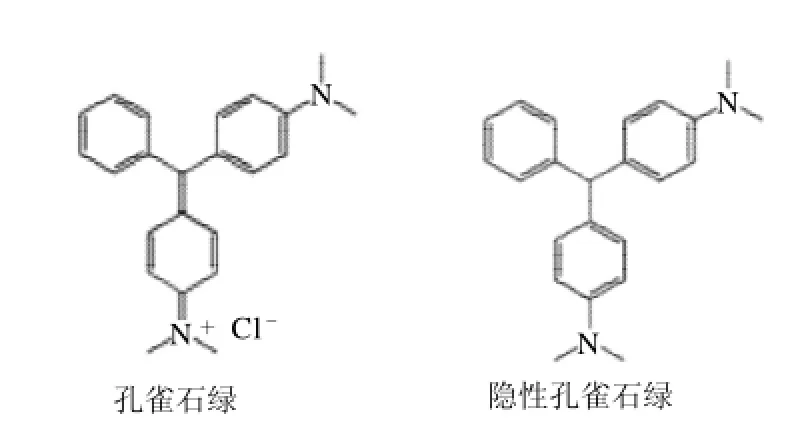
图1 孔雀石绿和隐性孔雀石绿结构图Fig.1 Structures of malachite green (MG) and leucomalachite green
1 材料与方法
1.1 材料与试剂
孔雀石绿、对羧基苯甲醛、N,N-二甲基苯胺(DMA)、2-吗啉乙磺酸(2-morpholino-ethanesulfonic acid,MES)、N-羟基琥珀酰亚胺(NHS)、碳二亚胺(EDC)、离子交换树脂 上海晶纯试剂有限公司;无水氯化锌、无水乙醇、二甲基亚砜(DMSO) 国药集团化学试剂有限公司;四甲基联苯胺(TMB) 华美生物工程公司;Milli-Q超纯水 美国Millipore公司;牛血清白蛋白(BSA)、卵清蛋白(OVA) 美国Sigma-Aldrich公司。
1.2 仪器与设备
TGL-40B台式低速离心机 上海安亭科学仪器厂;石英自动双重纯水蒸馏器 金坛市荣华仪器制造有限公司;ZD-9556水平摇床 太仓科教器材厂;Costar 96孔可拆酶标板 上海吉泰生物科技有限公司;Multiska Mks酶标仪、可调试移液器 英国Thermo Labsystems公司;Agilent 6890N气相色谱-Agilent 5973N型质谱检测器 美国Finigon质谱公司;Alliance型高效液相色谱系统、Symmetry C18色谱柱(250mm×4.6mm,5μm) 美国Waters公司。
1.3 方法
1.3.1 孔雀石绿人工抗原的制备
1.3.1.1 孔雀石绿半抗原的合成
将12mmol对羧基苯甲醛、38mmol蒸馏得到的N,N-二甲基苯胺和36mmol无水氯化锌溶解在60mL无水乙醇中,在N2保护下,95℃加热回流24h。室温冷却后,加入 30mL甲醇,并滴加1mol/L HCl调节 pH 值至 3.0~5.0,得到微绿色的晶体。过滤溶液,并冲洗晶体,真空干燥得到约3.6g羧基化的隐性孔雀石绿。
将1.2g CMG和1.2g氧化铅加入到24mL的1mol/L HCl溶液中,45℃加热回流24h。反应液室温冷却后,加入30mL甲醇,过滤并将滤液旋转蒸发干燥,得到约1.9g羧基化的孔雀石绿衍生物。
1.3.1.2 孔雀石绿人工免疫原的合成
取30mg CMG溶解于4mL 0.1mol/L、pH6.0 MES溶液(含50% DMSO)中,离心去除溶液中不溶物。加入18.75mg NHS搅拌溶解,反应10min后加入30mg EDC,继续搅拌反应4h,得到A液;取50mg cBSA溶解于2mL 0.05mol/L、pH8.0的硼酸盐缓冲液中,为B液。将A液缓慢逐滴加入B液中,磁力搅拌24h,保持溶液体系pH8.0。反应完全后用0.01mol/L PBS溶液透析48h,每8h换水,透析完毕,置于4℃冰箱中保存待用。
1.3.2 多克隆抗体的制备
1.3.2.1 免疫程序
选两只健康新西兰大白兔,分笼饲养,标号1、2分组。将抗原用生理盐水溶解稀释,第一次用弗氏完全佐剂乳化,使抗原质量浓度为1mg/mL,初次免疫颈背部皮内多点注射。初免后的免疫称为加强免疫,加强免疫用弗氏不完全佐剂乳化,进行肌肉注射。注射频率,初免至二免间隔30d,以后15d注射一次,注射量与初免相同,共注射5次。注射方法:首次为皮内注射,用手术剪把兔子脊椎两侧的毛剪掉,露出皮肤,用注射器进行皮下注射,使用弗氏完全佐剂。中间的免疫为肌肉注射,注射部位在兔子大腿和臀部位置的肌肉,注意不要伤到兔子的神经线。使用弗氏不完全佐剂。三次免疫后从耳缘静脉采血,采入离心管中,5000r/min离心8min。吸取上层血清放入另一个离心管中,标号冷藏保存待检。具体免疫程序见表1。

表1 兔子免疫程序Table 1 Immunization procedure for rabbits
1.3.2.2 效价、包被抗原和抗体的最适工作浓度测定
采用间接ELISA方法测定效价、包被抗原和抗体的最适工作浓度。将包被缓冲液系列稀释250、500、1000、2000、4000、8000倍后包被96孔酶标板,100μL/孔,于4℃冰箱过夜。取回至室温,以0.01mol/L PBST溶液作为洗涤液,洗涤3min后拍干,重复3次。以下洗涤方法相同。充分洗涤后,用封闭液封闭,200μL/孔,置于4℃冰箱过夜。洗涤后,置于37℃烘箱内15min烘干,置于4℃冰箱备用。
将采集的免疫血清系列梯度稀释250、500、1000、2000、4000、8000、16000、32000倍,对应加入到酶标板的每行,100μL/孔,室温孵育30min后洗涤、拍干;加入酶标二抗,100μL/孔,室温孵育30min后洗涤、拍干;加入显色液(TMB与底物液比例为1:10),100μL/孔,暗处反应15min后,取出加入终止液(2mol/L H2SO4),100μL/孔,用酶标仪测定450nm波长处的光密度值。
选择阳性血清的OD值大于1.0,同时与阴性血清的OD值差距最大的包被原稀释浓度、抗体稀释浓度为最佳工作浓度。阳性血清的OD值不小于阴性对照孔的2.1倍并且OD值大于0.1,此时血清的稀释倍数即为血清的效价。
1.3.2.3 免疫血清特异性的检测
要获得高灵敏度、高特异性的抗血清,不仅要求合适的工作浓度、高效价,同时要考察其特异性的强弱,绘制抑制标准曲线,测定其半数抑制率IC50值。
以所得最佳包被浓度对包被原进行系列梯度稀释并包被,设置两个对照,置于4℃冰箱保存过夜。取出洗涤后以封闭液封闭,200μL/孔,置于4℃冰箱保存过夜。取出洗涤,拍干。第一排加抗体稀释液,第二排起分别加7个浓度的孔雀石绿标准溶液,50μL/孔。以最佳稀释浓度稀释抗体并添加,50μL/孔,充分振荡混匀,37℃孵育30min。取出洗涤5次,拍干。加入3000倍稀释的酶标二抗,100μL/孔,37℃烘箱中反应30min。洗涤3次,拍干,加入显色液,100μL/孔,37℃暗处反应15min。加终止液(2mol/L浓硫酸),100μL/孔,酶标仪上检测OD值,各浓度的B/B0。

式中:B0为孔雀石绿标准品溶液添加0ng/mL时的OD值,即阴性对照孔的校正值。
以B/B0为纵坐标,以孔雀石绿标准品溶液添加的系列梯度浓度的对数值为横坐标作图,即得孔雀石绿的抑制标准曲线。IC50表示达到最大OD值一半时所添加的孔雀石绿标准品浓度。
1.3.3 偶联比的测定

式中:εCMG-BSA、εBSA、εCMG分别为CMG-BSA、BSA、CMG对应的摩尔消光系数。
2 结果与分析
2.1 孔雀石绿衍生结果

图2 孔雀石绿半抗原的液相图谱Fig.2 Liquid chromatogram of malachite green hapten
反应后相对分子质量为374,通过LC-MS检测分析得出,出峰时间在4.118min(图2),对应的质谱如图3所示,质谱图中有374、373、371的片段峰,初步说明衍生成功,即可初步确定得到了所需要的人工半抗原。
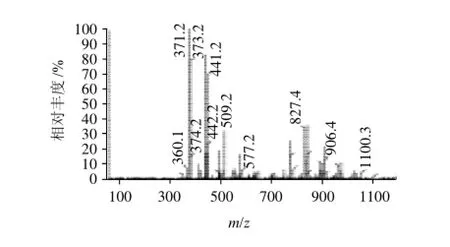
图3 孔雀石绿人工半抗原的质谱图Fig.3 Mass spectrum of malachite green hapten
2.2 偶联物的紫外光谱分析
2.2.1 孔雀石绿人工免疫原的鉴定
配制相同浓度的人工半抗原、免疫原和cBSA,用紫外分光光度计检测,结果见图4。
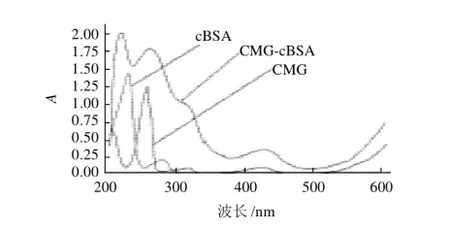
图4 CMG-cBSA偶联的紫外图谱Fig.4 UV-visible spectrum of CMG-cBSA conjugate
由图4可知,半抗原在255、317、425、618nm波长处有特征吸收峰,BSA在波长280nm左右处具有特征吸收峰,而合成的人工免疫原不仅在波长240nm和320nm左右具有与代谢物半抗原相似的特征吸收峰,而且在与相同浓度的BSA溶液进行比较时,可以明显看出,它的吸光度要比相同浓度BSA的吸光度普遍偏高,尤其在300nm波长以后,BSA的吸光度趋向于0,而偶联物仍然具有吸光度,且在320nm特征吸光度处出现与代谢物半抗原相似的吸收峰,根据叠加原理可知,代谢物半抗原与BSA成功偶联。
2.2.2 孔雀石绿人工包被原的鉴定
配制一定浓度的人工半抗原、包被原和OVA,其中免疫原与OVA浓度相同,用紫外分光光度计扫描波长在200~800nm之间,结果见图5。
从图5可以看出,半抗原在255、317、425、618nm波长处有特征吸收峰,OVA在波长280nm左右处具有特征吸收峰,而合成的人工免疫原不仅在波长240nm和320nm左右具有与代谢物半抗原相似的特征吸收峰,而且在与相同浓度的BSA溶液进行比较时,可以明显看出,它的吸光度要比相同浓度BSA的吸光度普遍偏高,尤其在300nm以后,BSA的吸光度趋向于0,而偶联物仍然具有光吸收,且在320nm特征吸光度处出现与代谢物半抗原相似的吸收峰,根据叠加原理可知,代谢物半抗原与OVA成功偶联。
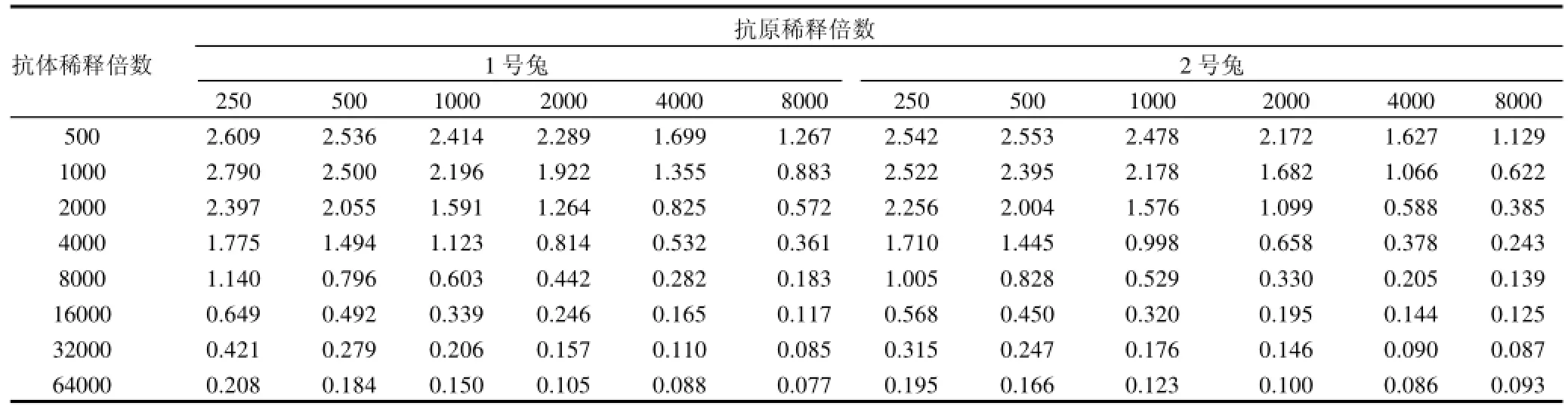
表2 免疫血清的效价Table 2 Titer of antiserum

图5 CMG-OVA偶联的紫外图谱Fig.5 UV-visible spectrum of CMG-OVA conjugate
2.2.3 偶联比的确定
通过1.3.3节公式计算出CMG-BSA即人工免疫原的偶联比是10.6:1,证明偶联有效。同理计算出CMG-OVA的偶联比是20.5:1,与空间位点的结合效率比较高,说明包被原偶联成功。
2.2.4 最佳工作点和效价的测定
阴性血清光密度值为0.090,从表2可以看出,1号和2号兔子的效价分别为8000和4000,相对应的最佳工作浓度(抗原稀释倍数/抗体稀释倍数) 为250/8000和250/8000。
2.2.5 抗体特异性的测定
经抗体特异性检测,两只兔子抗孔雀石绿抗体的IC50分别为8.1ng/mL和4.6ng/mL,从而2号兔子较1号兔子好。
3 结 论
在本研究中,通过化学合成的方法成功的合成出两种不同载体的孔雀石绿人工抗原并通过两种不同手段分别对其结构和免疫效果进行了验证。
仪器分析手段:用化学方法合成羧基化的孔雀石绿半抗原并用液质联用进行分离、检测,证明有目标相对分子质量的产物出现且有一定含量。对于蛋白偶联产物,利用紫外光谱对其进行扫描,通过产物和CMG以及两种蛋白标准品图谱的对比,发现明显的紫外吸收峰偏移,证明在结构上已经完成偶联。
免疫检测手段:对已合成好的偶联产物进行方法学实验,对新西兰大白兔进行免疫,提取血清后进行ELISA检测,通过和阴性血清的对比,其光密度值远高于阴性血清的光密度值,区别较明显,由此可以证明该抗原能够成功刺激动物免疫系统产生抗体。
[1] 胥传来, 王利兵. 食品免疫化学与分析[M]. 北京: 科学出版社, 2009.
[2] 邱绪建, 林洪, 江洁. 渔药孔雀石绿及其关联化合物检测方法研究进展[J]. 海洋水产研究, 2005, 26(2): 92-961.
[3] 孙满义, 杨贤庆, 岑剑伟, 等. 水产品中孔雀石绿的研究进展[J]. 食品工业科技, 2009(2): 312-315.
[4] 何丽华, 沈国顺, 邹伟. 孔雀石绿及其危害[J]. 特养与水产, 2006, 27 (5): 45-46; 48.
[5] 王权, 郭德华, 李健, 等. 孔雀石绿间接竞争ELISA检测方法的建立[J]. 畜牧与兽医, 2010, 42(2): 6-9.
[6] 张宾, 王予辉. 常用动物实验操作指南[M]. 上海: 上海中医药大学出版社, 2007.
[7] 邢玮玮, 王榕妹, 王俊卿, 等. 酶联免疫吸附分析法测定水产品及水中孔雀石绿和无色孔雀石绿[J]. 化学与研究, 2010, 22(1): 42-46.
[8] 沈玉栋, 王宇, 孙远明, 等. 隐孔雀石绿半抗原与全抗原设计、合成及鉴定[J]. 食品科学, 2008, 29(7): 263-266.
[9] 于慧梅. 食品中硝基呋喃代谢物和孔雀石绿的分析方法研究[D]. 北京: 北京化工大学, 2008.
[10] 刘爱红, 张琳. 农药残留与食品安全[J]. 安徽农业科学, 2007, 35(13): 4017-4018
[11] 胡昌勤, 刘炜. 抗生素微生物检定法及其标准操作[M]. 北京: 气象出版社, 2004.
[12] MASCHER D G, UNGER C P, MASCHER H J. Determination of neomycin and bacitracin in human or rabbit serum by HPLC-MS/MS [J]. Journal of Pharmaceutical and Biomedical Analysis, 2007, 43(2): 691-700.
[13] FOSTER F J, WOODBUR Y L. The use of malachite green as a fish fungicide and antisptic[J]. Prog Fish Cult, 1936, 18(3): 7-9.
[14] HERNANDO M D, MEZCUA M, SUAREZ-BAREENA J M A, et al. Liquid chromatography with time of flight mass spectrometry simultaneous determination chemotherapeutant residues in salmon[J]. Analytica Chimica Acta, 2006, 562(2): 176-184.
[15] BERGWERFF A A, SCHERPENISSE P. Determination of residues of malachite green in aquatic animals[J]. Journal of Chromatogy B: Analysis Technology Biomed Life Science, 2003, 788(2): 351-359.
[16] LEE K C, WU J L, CAI Z W. Determination of malachite green and leucomalachite green in edible goldfish muscle by liquid chromatography-ion trap mass spectrometry[J]. Journal of Chromatography B, 2006, 843(2): 247-251.
Synthesis of Artificial Antigen and Preparation of Polyclonal Antibody for Malachite Green
WANG Mei1,XU Nai-feng2,LIU Li-qiang2,KUANG Hua2,LIN Fei2,SONG Shan-shan2,WANG Ze-lu2,XU Chuan-lai2,*
(1. Analytical and Testing Center, Suzhou University, Suzhou 215123, China;2. School of Food Science and Technology, Jiangnan University, Wuxi 214122, China)
In order to determine malachite green (MG) residues in food, the synthesis of antigen and preparation of polyclonal antibody for MG were explored. In this study, carboxylic malachite green (CMG) hapten was first synthesized and analyzed by LC-MS. The hapten was coupled separately with the two carrier proteins BSA and OVA by diazotization method, and identified by UV-visible spectroscopy method. Compared with CMG standard, BSA and OVA, the absorption peaks CMG-BSA and CMG-OVA displayed a marked shift, indicating that the successful conjugation between CMG and BSA or OVA, and the coupling ratio of the immunogen CMG-BSA was calculated to be 10.6:1. Polyclonal antibody for MG was prepared by immunization with CMG-BSA and evaluated using the titer of anti-CMG antisera determined by indirect ELISA. Furthermore, two rabbits were used to evaluate antibody specificity with determined IC50values of 8.1 ng/mL and 4.6 ng/mL, respectively.
malachite green (MG);antigen;polyclonal antibody;indirect ELISA
R392.11
A
1002-6630(2011)07-0282-04
2010-07-16
王梅(1981—),女,实验师,硕士,研究方向为残留物检测。E-mail:wangmei1222@suda.edu.cn
*通信作者:胥传来(1965—),男,教授,博士,研究方向为食品安全。E-mail:xcl@jiangnan.edu.cn

