螺旋藻β-胡萝卜素代谢控制分析及其新方法的研究
王 芳,庞广昌*,王景川
(天津市食品生物技术重点实验室,天津商业大学生物技术与食品科学学院,天津 300134)
螺旋藻β-胡萝卜素代谢控制分析及其新方法的研究
王 芳,庞广昌*,王景川
(天津市食品生物技术重点实验室,天津商业大学生物技术与食品科学学院,天津 300134)
代谢控制分析(MCA)的两大难题是获得酶活性的扰动和通量控制系数(FCC)的计算,需要借助基因操作和复杂的计算推理。研究表明数量性状基因座(QTL)效应和通量控制系数(FCC)具有极其相似的分布规律,均呈L形分布,即代谢通量具有与数量性状一致的遗传变异规律。因此,本实验将螺旋藻(Spirulina)β-胡萝卜素(β-carotene)的代谢通量作为一个数量性状,运用主成分分析、通径分析等数量遗传学分析方法研究其代谢途径中酶对通量的影响方式和程度。在相关分析的基础上计算得到了基于主成分分析的控制系数Cpi和基于通径分析的控制系数R2i,对比分析表明这两组控制系数的变化规律基本一致,表明螺旋藻β-胡萝卜素合成途径中番茄红素-β-环化酶(LYC-B,CpLYC-B=0.161,R2LYC-B=0.2601)、RuBP羧化酶(RuBisCO,CpRuBisCO=0.121,R2RuBisCO=0.2453)、磷酸甘油酸变位酶(PGM,CpPGM=0.163,R2PGM=0.2320)、丙酮酸脱氢酶(PDHC,CpPDHC=0.119,R2PDHC=0.1584)和异柠檬酸脱氢酶(ICDH,CpICDH=0.172,R2ICDH= 0.1935)5种酶对β-胡萝卜素的代谢通量的分布或改变起主要控制作用。这两种方法简便易行,简化了实验操作和计算过程,可为代谢工程育种及代谢控制分析提供新方法。
数量遗传学;代谢控制分析;主成分分析;通径分析;β-胡萝卜素
代谢控制分析理论(MCT)最初是由Higgins[1]提出经Kacser等[2]和Balley[3]发展和完善起来的,Heinrich等[4]首先提出为了解每步反应对整个代谢流的控制需测定途径中每一步酶反应。20世纪90年代初,随着基因重组技术的发展和应用,修饰和重构代谢网络得以实现,此后代谢控制分析(MCA)也逐步完善并得到广泛应用,认为代谢通量受途径中关键步骤的关键酶调控的传统代谢调控观点已经彻底被摒弃。现代代谢控制分析理论认为代谢系统中所有反应步骤都直接或者间接地对代谢通量和代谢物浓度产生影响,其基本研究对象是由代谢反应序列和代谢途径组成的代谢系统,其中单步反应是组成系统的基本结构单元。MCA可以在代谢系统发生酶活性的扰动时准确地量化每一种酶对代谢通量的控制作用,广泛应用在基因工程育种和途径分析中。然而获得酶活性的扰动往往需要借助基因操作,通量控制系数(FCC)的计算也过于复杂,这些局限性很大程度限制了MCA的发展和应用。因此,简化代谢控制分析,探索更加简单易行的分析方法已成为代谢工程育种工作中亟待解决的难题。
代谢调控网络是由代谢途径中所有酶和代谢物质所构成的复杂网络,而相关分析、主成分分析和通径分析等多元统计分析方法是研究复杂网络的有力工具[5]。为了寻求代谢控制分析的新方法并简化通量控制系数的计算过程,本实验引入统计学分析方法研究螺旋藻β-胡萝卜素合成途径中主要的酶对β-胡萝卜素代谢通量的控制作用,并尝试结合相关分析建立基于主成分分析和通径分析的符合统计学原理的控制系数,以期对代谢控制分析进行简化。
1 材料与方法
1.1 材料、培养基与试剂
本实验选取6株螺旋藻(代号分别为:438、834、791、971、nm和gg),其中前4株为引进品种,后两株由本课题组筛选保藏。
AB液体培养基(g/L):NaHCO313.61、Na2CO34.03、KH2PO40.5g、NaNO32.5、K2SO41、NaCl 1、MgSO4·7H2O 0.2、CaCl2·2H2O 0.04、PIV 6mL,A51mL。
其中A5(mg/100mL):H3BO3286、MnCl2·4H2O 181、ZnSO4·7H2O 22、MnSO4·7H2O 250、CuSO4·5H2O 7.4、Na2MoO42.1;PIV(mg/L):Na2EDTA 750、FeCl3·7H2O 97、MnCl2·4H2O 41、ZnCl25、CoCl2·6H2O 2、Na2MoO4·2H2O 4。将配制好的培养基分装后,121℃灭菌30min。
β-胡萝卜素标准品 美国Fluca公司;三磷酸腺苷(ATP)、二磷酸腺苷(ADP)、一磷酸腺苷(AMP)、烟酰胺腺嘌呤二核苷酸(NADH)、烟酰胺腺嘌呤二核苷酸磷酸(NADPH)、二乙胺基乙基纤维素(DEAE)、乙二胺四乙酸(EDTA)、磷酸烯醇丙酮酸、2,3-二磷酸甘油酸、3-磷酸甘油酸、2-磷酸甘油酸、3-磷酸甘油醛、6-磷酸果糖、1,6-二磷酸果糖、6-磷酸葡萄糖脱氢酶、醛缩酶、丙酮酸 美国Sigma公司;其他试剂均为分析纯。
1.2 仪器与设备
HPG-280BX光照培养箱 哈尔滨市东联电子技术开发有限公司;3K15高速冷冻离心机 美国Sigma公司;752型紫外-可见光分光光度计 上海精密科学仪器有限公司;VCX 105超声波细胞粉碎机 美国Sonic&Materis公司;Fluoroskan Ascent FL荧光-化学发光检测仪 美国Thermo公司。
1.3 方法
1.3.1 螺旋藻培养
将6株活化好的藻种按OD560nm=0.150分别接入装有AB液体培养基的三角瓶中,每个品种接种3个平行,随机摆放在光照培养箱中静置培养6~8d,培养温度为33℃,光照度为5000lx。
1.3.2 净光合速率的测定
净光合速率的测定采用黑白瓶法。将1.3.1节处理后的藻体(2g)分别放入500mL的黑白瓶中,采用虹吸的方法充满AB培养基,把所有的空气赶出后,将白瓶和黑瓶密闭,在不同温度(22、25、30、33、35、37、40℃),光照度为5000lx的条件下生长2h,用碘量法[6]分别测定光合作用前后黑白瓶中溶解氧的浓度。根据溶解氧浓度的变化、光合作用时间及藻体的鲜质量即可求出螺旋藻的净光合速率。
1.3.3 β-胡萝卜素代谢通量分析
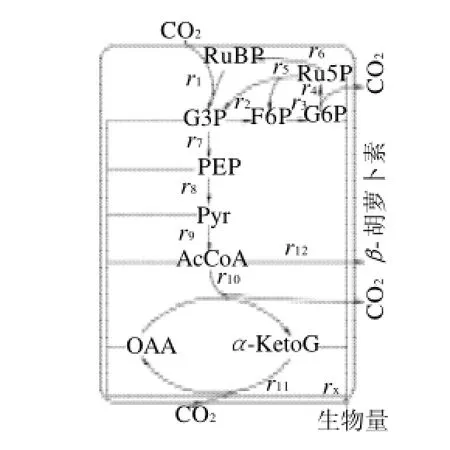
图1 螺旋藻β-胡萝卜素的代谢网络Fig.1 Metabolic network of β-carotene in Spirulina
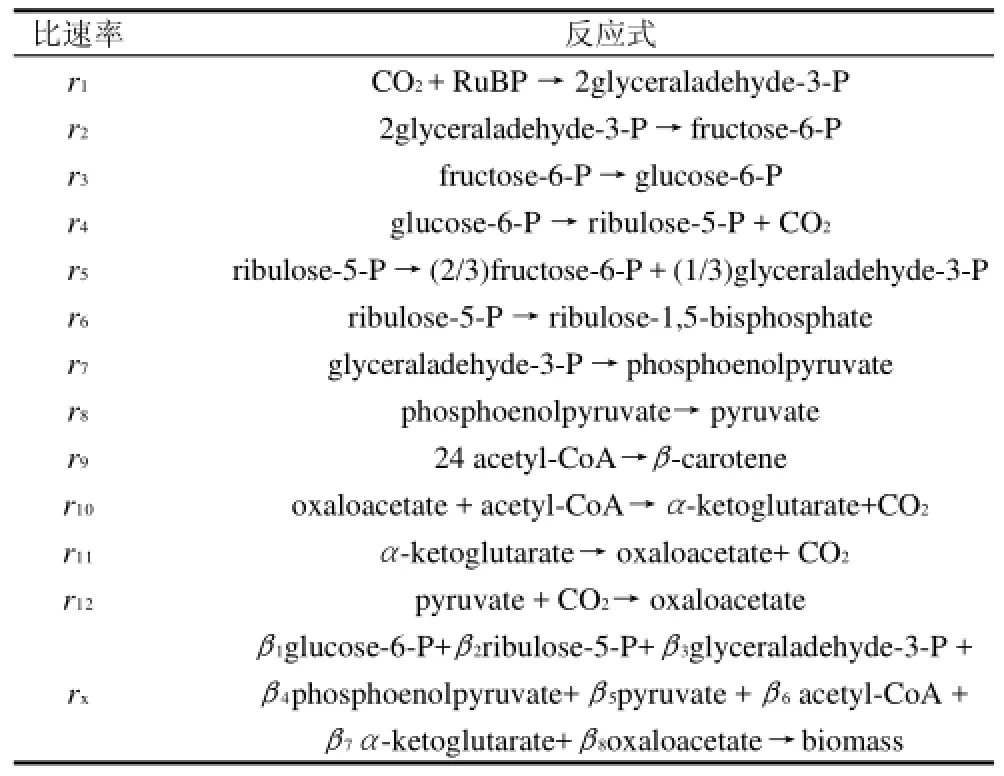
表1 螺旋藻的代谢反应Table 1 Metabolic reaction of Spirulian

表2 螺旋藻生长的前体需求系数Table 2 Precursor requirement coefficients for Spirulina

表3 螺旋藻代谢通量模型方程式Table 3 Metabolic flux model equation of Spirulina
从图1可知,所选取的代谢网络共有10个中间代谢物,2个代谢产物,若以一个总的方程式表示细胞生长过程,各前体物质及其需求系数[8]见表2,其反应速率用rx表示[9],共可构建13个方程,平衡方程为10个(表3),因此系统的自由度df =13-10=3,通过实验可以测定的值有:藻体比生长速率、净光合速率和β-胡萝卜素比生成速率。因此,已知速率为3,此方程可以得到唯一解。
1.3.4 酶活性测定
粗酶液制备:藻液OD560nm达到0.8左右时取样,冰浴下迅速冷却,然后于4℃、2000r/min离心5min。弃去上清液,沉淀用PBS洗涤2~3次后用酶抽提液(pH7.4 100mmol/L HEPES缓冲液,10mmol/L KCl、0.5mmol/L二硫苏糖醇、0.2%曲拉通-100)溶解,冰浴下用超声波细胞破碎仪破碎(至镜检细胞完全破碎)后,取上清液即粗酶液。
酶活性测定方法:本实验测定螺旋藻中β-胡萝卜素合成代谢途径11种相关酶的活性:RuBP羧化酶(RuBisCO)、葡萄糖-6-磷酸脱氢酶(G6PD)、己糖激酶(HK)、磷酸果糖激酶(PFK)、磷酸甘油酸激酶(PGK)、磷酸甘油酸变位酶(PGM)、丙酮酸激酶(PK)、丙酮酸脱氢酶(PDHC)、异柠檬酸脱氢酶(ICDH)和α-酮戊二酸脱氢酶(α-KGDHC)活性的测定参考文献[10-12],番茄红素-β-环化酶(LYC-B) 活性的测定参考文献[13]。
1.3.5 多元统计分析方法
相关性分析,主成分分析[14]和通径分析[15]多元统计分析用SPSS 16.0 for Windows软件实现。
2 结果与分析
2.1 β-胡萝卜素代谢通量分析及其与11种酶活性的相关性分析
分别测定了供试藻对数生长期的比生长速率、净光合速率和β-胡萝卜素比生成速率,结果见表4。将表4中的数据代入平衡方程(表3),用Matlab7.0求解即可求出β-胡萝卜素的代谢通量。
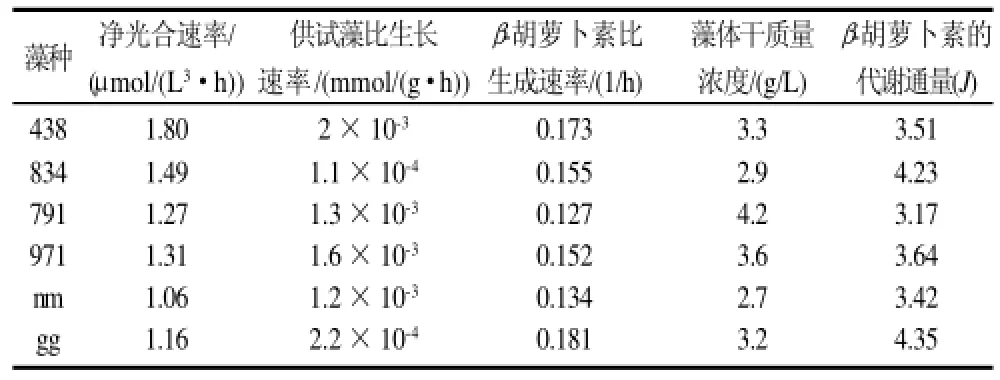
表4 供试藻的生理参数和β-胡萝卜素的代谢通量Table 4 Physiological parameters and β-carotene metabolic flux of tested Spirulina
2.2 11种酶的活性及其与代谢通量的相关性分析
分别测定6株螺旋藻β-胡萝卜素合成途径中11种相关酶的活性,并对11种酶活性与β-胡萝卜素代谢通量作相关分析,用SPSS 16.0 for Windows软件包输出分析结果见表5。
从表5可知,各种酶之间以及各种酶与代谢通量之间均存在不同程度的相关性,有些达到显著或极显著水平,这表明β-胡萝卜素合成途径中的每一种酶都影响代谢通量,而且各种酶之间的相互作用比较明显,这符合代谢网络调控观点。相关分析直观地反映了代谢网络的特征,同时也可看到各种酶与代谢通量的关系十分复杂,还需要作更深入的分析以了解酶对代谢通量的控制作用。
2.3 基于主成分分析的代谢控制分析
经KMO检验和Bartlett球度检验,11种酶活性数据适合因子分析。用SPSS 16.0 for Windows对11种酶的活性进行主成分分析,结果见图2。
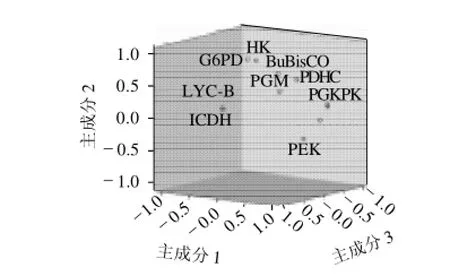
图2 酶活性主成分三维坐标分布图Fig.2 Distribution of principal components in three-dimensional coordinate of enzyme activities
通过分析提取3个主成分(图2、表3),累积贡献率达到了92.564%,其中第一主成分贡献率为39.635%,主要反映了磷酸果糖激酶(PFK)、磷酸甘油酸激酶(PGK)、丙酮酸激酶(PK)、磷酸甘油酸变位酶(PGM)、丙酮酸脱氢酶(PDHC)和α-酮戊二酸脱氢酶(α-KGDHC),这些酶大都是线性途径中的酶,这些酶对β-胡萝卜素代谢通量的控制作用最显著;第二主成分贡献率28.137%,主要反映了RuBP羧化酶(RuBisCO)、葡萄糖-6-磷酸脱氢酶(G6PD)和己糖激酶(HK),这几种酶主要集中在代谢网络(图1)第一个节点三磷酸甘油醛(G3P)附近,这是一个柔韧性较强的节点,这个节点的下行(PEP方向)流量直接影响β-胡萝卜素的代谢通量;第三主成分贡献率24.792%,主要反映了异柠檬酸脱氢酶(ICDH)和番茄红素-β-环化酶(LYC-B),这两种酶位于乙酰辅酶A的两个分支上,这也是一个柔性节点,LYC-B的活性直接决定β-胡萝卜素的产量。

表5 各种酶之间的相关系数Table 5 Person correlation coefficients between enzyme activities
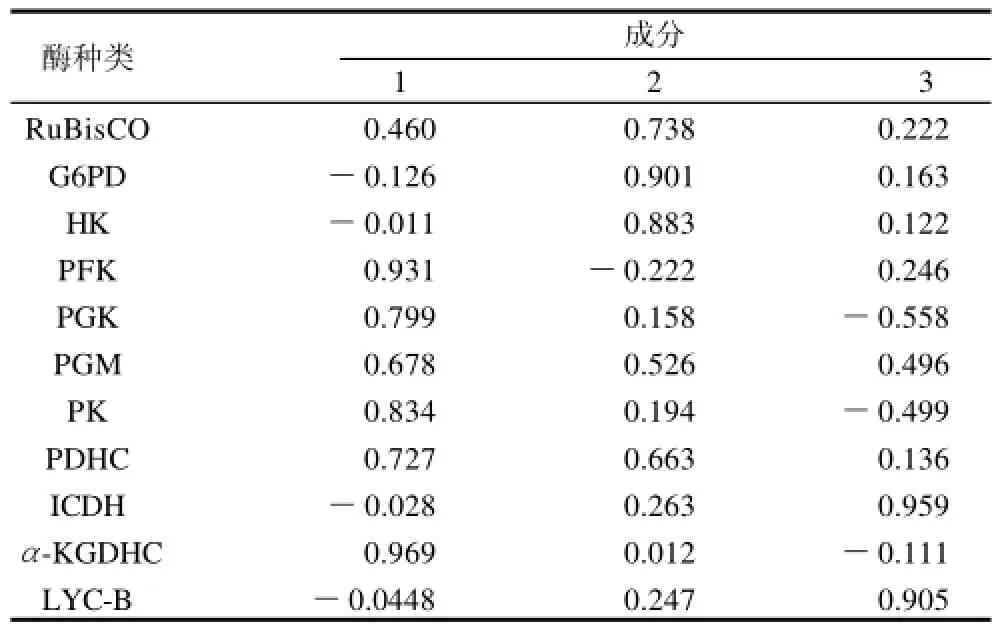
表6 主成分载荷矩阵Table 6 Principal component matrix
用表6中的数据除以主成分相对应的特征值开平方根便得到3个主成分中每个指标所对应的系数(表7)。以每个主成分所对应的特征值占所提取主成分总的特征值之和的比例作为权重计算综合主成分中每个指标所对应的系数。该系数综合反应了每种酶对代谢通量的控制作用,将其归一化后的数值记为Cpi。从表7可知,异柠檬酸脱氢酶(ICDH,CpICDH=0.172),磷酸甘油酸变位酶(PGM,CpPGM=0.163),番茄红素-β-环化酶(LYC-B,CpLYC-B=0.161),RuBP羧化酶(RuBisCO,CpRuBisCO=0.121)和丙酮酸脱氢酶(PDHC,CpPDHC=0.119)对β-胡萝卜素代谢通量起主要控制作用,其中以ICDH的控制作用最强;而丙酮酸激酶(PK,CpPK=-0.012)和磷酸甘油酸激酶(PGK,CpPGK=-0.026) 对β-胡萝卜素代谢通量具有一定的控制作用。
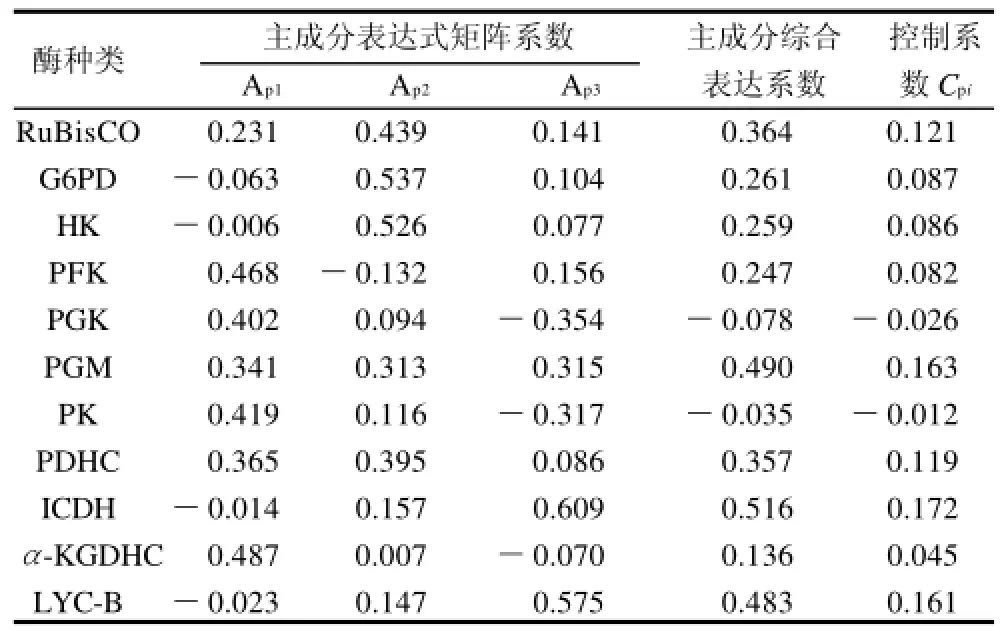
表7 主成分表达式矩阵系数和基于主成分分析的控制系数Table 7 Principal component expression coefficient matrix and control coefficient based on principal component analysis
2.4 基于通径分析的代谢控制分析
在相关分析的基础上对11种酶进行通径分析。通径分析能全面了解多变量间的相互关系,包括作用方式及其影响程度,将简单相关系数代入正规方程即可求解出通径系数(P)[16-17](表8)。
通径分析结果(表8,图3)显示,11种酶活性对β-胡萝卜素通量的相对重要性依次为:番茄红素-β-环化酶(LYC-B,Py.11=0.3426)>RuBP羧化酶(RuBisCO,Py.1= 0.3151)>异柠檬酸脱氢酶(ICDH,Py.9=0.2744)>磷酸甘油酸变位酶(PGM,Py.6=0.2414)>丙酮酸脱氢酶(PDHC,Py.8=0.1425)>磷酸果糖激酶(PFK,Py.4=0.1123)>葡萄糖-6-磷酸脱氢酶(G6PD,Py.2=0.0884)>己糖激酶(HK,Py.3=0.0681)>α-酮戊二酸脱氢酶(α-KGDHC,Py.10= -0.0147)>丙酮酸激酶(PK,Py.7=-0.1242)>磷酸甘油酸激酶(PGK,Py.5=-0.1352),这个通径系统的相关指数R2=0.8854,说明这10种酶决定了β-胡萝卜素通量88.54%的变异,剩下11.46%的变异归属于其他未知因素和实验误差。直接影响较大的几种酶LYC-B、RuBisCO、ICDH、PGM与β-胡萝卜素代谢通量的相关系数也较大,说明这几种酶对β-胡萝卜素代谢通量起主要控制作用;α-KGDHC、PK和PGK对代谢通量具有一定的负效应,尤以后两者较为明显。

图3 11种酶通径图谱Fig.3 Path diagram of 11 enzymes
通径分析还能清晰地反映出某种酶通过其他酶对代谢通量产生的间接影响,用Pxi→xj→y表示第i种酶通过第j种酶对通量的间接效应,表8列出了这些间接作用。其中以Px1→x6→y= 0.2352,Px8→x11→y= 0.2315,Px11→x4→y= 0.1841等较为明显,也有一些酶的间接效应为负,例如:Px8→x11→y=-0.2315,Px6→x4→y=-0.1655,Px3→x10→y= -0.1586等。
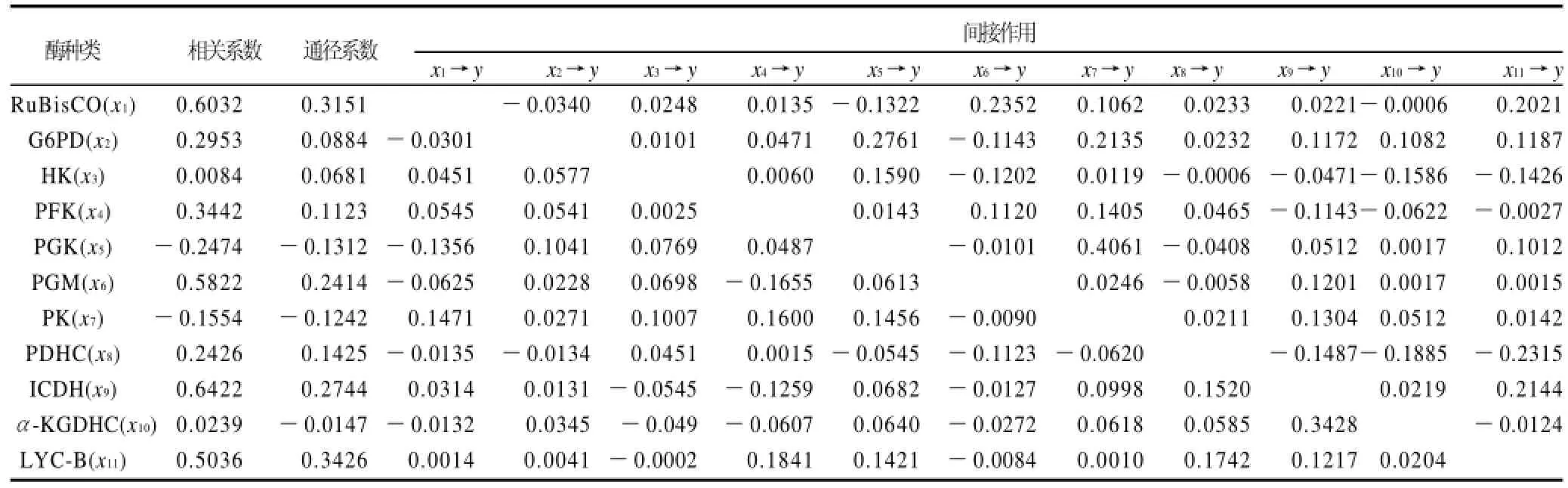
表8 通径分析结果Table 8 Result of path analysis

表9 11种酶的决定系数Table 9 Determination coefficients of 11 enzymes
上述通径分析精细地反映了各种酶对代谢通量的直接和间接影响,为考察酶对通量的综合控制作用将xi对y的控制系数R2i[16]定义为:
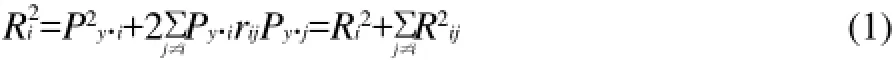
式中:R2i为直接决定系数;R2ij=2Py.irijPy.j为间接决定系数。
R2i反映了xi通过x1、x2、xp的相关网对y的综合决定作用,它不仅包含了xi对y的直接决定作用R2i,还包含了与xi有关的间接决定系数∑R2ij。由式(1)可计算出11种酶的决定系数,结果见表9。
表9显示,螺旋藻β-胡萝卜素合成途径中,番茄红素-β-环化酶(LYC-B,R2LYC-B=0.2601)、RuBP羧化酶(RuBisCO,R2RuBisCO=0.0424)、磷酸甘油酸变位酶(PGM,R2PGM=0.2112)、丙酮酸脱氢酶(PDHC,R2PDHC=0.1484)和异柠檬酸脱氢酶(ICDH,R2ICDH=0.1865)对β-胡萝卜素代谢通量具有相对较高的决定系数,说明这5种酶对β-胡萝卜素通量起主要控制作用;己糖激酶(HK,R2HK= 0.0643),葡萄糖-6-磷酸脱氢酶(G6PD,R2G6PD=0.0424)和磷酸果糖激酶(PFK,R2PFK=0.0214)的决定系数相对较低,均不到0.1,说明它们对β-胡萝卜素通量的影响很小;而磷酸甘油酸激酶(PGK,R2PGK= -0.0653),丙酮酸激酶(PK,R2PK= -0.0792)和α-酮戊二酸脱氢酶(α-KGDHC,R2α-KGDHC=-0.0152)的决定系数为负值,说明对β-胡萝卜素通量具有较为明显的控制作用。
2.5 两种方法分析结果的比较

图4 两组控制系数对比图Fig.4 Comparative plots of control coefficients from both groups
分别建立了基于主成分分析和通径分析的代谢控制系数,为考察基于数量遗传学方法建立的两组控制系数是否能真实地反映β-胡萝卜素合成途径中11种酶对其代谢通量的控制作用,将这两组数据进行了对比分析。
如图4所示,两组控制系数具有良好的相关性,所反映的酶控制代谢通量规律的一致性较好, LYC-B、RuBisCO、PGM、ICDH和PDHC 5种酶对β-胡萝卜素的代谢通量起着主要控制作用;HK、G6PD等酶的控制作用较小;PGK和PK对通量均具有一定的负控制作用。α-KGDHC的控制系数出现不一致的,这可能是由于统计样本偏小和实验误差所致。总体来说这两组基于数量遗传学方法建立的控制系数很好地反映了β-胡萝卜素合成途径中11种酶对其代谢通量的调控规律,而且所需的实验操作简单易行,控制系数的计算过程符合统计学原理,达到了简化代谢控制分析的目的。
3 结 论
本研究引入多元统计学方法建立并计算了基于主成分分析的控制系数Cpi和基于通径分析的控制系数R2i,这两组控制系数的对比分析表明它们具有较好的一致性,均反映出LYC-B、RuBisCO、PGM、ICDH和PDHC 5种酶对β-胡萝卜素的代谢通量起着主要控制作用,提高这些酶的活性将可很大程度提高β-胡萝卜素的通量;PGK和PK对β-胡萝卜素的代谢通量均具有一定的负控制作用,如果螺旋藻中这两种酶的活性较高,将抑制β-胡萝卜素的生物合成,从而降低其通量。清楚地了解螺旋藻β-胡萝卜素合成途径中各种酶对其代谢通量的控制作用,对螺旋藻β-胡萝卜素的途径分析、基因工程育种工作和代谢工程生产实践都具有一定的借鉴和指导意义。而且,这两种方法很大程度地简化了基于酶活性扰动的代谢控制分析,简便易行。
[1] HIGGINS J. Dynamics and control in cellular reactions[M]//CHANCE B, ESTABROOK R K, WILLIAMSON J R. Control of energy metabolism. New York: Acad, Press, 1965: 13-46.
[2] KACSER H, BURNS J A. The molecular basis of dominance[J]. Genetics, 1981, 97: 639-666.
[3] BALLEY J E. Toward a science of metabolic engineering[J]. Science, 1991, 252: 1668-1674.
[4] HEINRICH R, RAPOPORT T. A linear steady-state treatment of enzymatic chains[J]. Eur J Biochem, 1974, 42: 89-95.
[5] BOST B, DILLMANN C, de VIENNE D. Fluxes and metabolic pools as model traits for quantitative genetics. I. the L-shaped distribution of gene effects genetics[J]. December, 1999, 153(4): 2001-2012.
[6] GB/T 7489—1987 水质溶解氧的测定 碘量法[S]. 北京: 中国标准出版社, 1987.
[7] 王景川, 庞广昌. 螺旋藻β-胡萝卜素代谢通量调控规律的研究[J].食品科学, 2008, 29(10): 665-669.
[8] 马红武, 赵学明, 郭晓峰, 等. 结合元素组成数据进行细胞生长过程代谢通量分析[J]. 化工学报, 2002, 53(8): 847-853.
[9] PIERCE V A, CRAWFORD D L. Rapid enzyme assays investigating the variation in the glycolytic pathway in field-caught populations of Fundulus heteroclitus[J]. Biochem Gen, 1994, 32(9/10): 315-330.
[10] TEUSINK B, PASSARGE J, REIJENGA C A, et al. Can yeast glycolysis be understood in terms of in vitro kinetics of the constituent enzymes? Testing biochemistry[J]. Eur J Biochem, 2000, 267(17): 5313-5329.
[11] 李可伟. 温度对嗜酸乳杆菌乳酸代谢通量调控规律的研究[D]. 天津:天津商业大学, 2007.
[12] DHARMAPURI S, ROSATI C, PALLARA P, et al. Metabolic engineering of xanthophyll content in tomato fruits[J]. FEBS Letters, 2002, 519: 30-34.
[13] 白奕. 多指标综合评价的主成分分析模型及其原理[J]. 陕西师大学学报: 自然科学版, 1998, 26(2): 105-106.
[14] 李加纳. 数量遗传学概论[M]. 成都: 西南师范大学出版社, 2007.
[15] VISSERA D, HEIJNEN J J. Dynamic simulation and metabolic redesign of a branched pathway using linlog kinetics[J]. Metab Eng, 2003, 5(3): 164-176.
[16] WU Liang, WANG Weiming, van WINDEN W A, et al. A new framework for the estimation of control parameters in metabolic pathways using lin-log kinetics[J]. Eur J Biochem, 2004, 271(16): 3348-3359.
[17] 袁志发, 周静芋, 郭满才, 等. 决定系数: 通径分析中的决策指标[J].西北农林科技大学学报: 自然科学版, 2001, 29(5): 131-133.
Metabolic Control Analysis of β-Carotene in Spirulina
WANG Fang,PANG Guang-chang*,WANG Jing-chuan
(Tianjin Key Laboratory of Food Biotechnology, College of Biotechnology and Food Science, Tianjin University of Commerce, Tianjin 300134, China)
Two problems of metabolic control analysis are the acquisition of enzyme activity distribution and the calculation of flux control coefficient (FCC), which often needs gene manipulation and complicated calculation. A large number studies indicated that both quantitative trait loci (QTL) effect and flux control coefficient revealed similar L-shaped distribution. Therefore, metabolic flux of β-carotene in Spirulina was considered as a quantitative trait. Principal component analysis and path analysis were used to explore the control effects of enzymes on metabolic flux for the first time. The control coefficients based on principal component analysis (Cpi) and path analysis (R2i) were established after correlation analysis between enzymes and metabolic flux. Comparative analysis results indicated control coefficients from both groups had a consistent change trend. Therefore, five enzymes including lycopene β-cyclase (LYC-B, CpLYC-B= 0.161, R2LYC-B= 0.2601), ribulose-1,5-bisphosphate carboxylase (RuBisCO, CpRuBisCO= 0.121, R2RuBisCO= 0.2453), phosphoglyceromutase (PGM, CpPGM= 0.163, R2PGM= 0.2320), pyruvate dehydrogenase (PDHC, CpPDHC = 0.119, R2PDHC = 0.1584) and isocitrate dehydrogenase (ICDH, CpICDH = 0.172, R2ICDH = 0.1935) played an important role in the flux of β-carotene. The two established methods in this study are simple and accurate so that these methods with simplified operation and calculation process will provide new strategies for metabolic engineering breeding and metabolic control analysis.
quantitative genetics; metabolic control analysis; principal component analysis; path analysis;βcarotene
Q591
A
1002-6630(2011)07-0237-07
2010-05-27
天津市重点科技攻关专项(06YFGZNC04200)
王芳(1984—),女,硕士研究生,主要从事代谢工程和食品免疫学研究。E-mail:wangfang841208@163.com
*通信作者:庞广昌(1956—),男,教授,博士,主要从事食品生物技术及食品免疫学研究。E-mail:pgc@tjcu.edu.cn

