针刺对高脂血症大鼠主动脉内皮NF-κB表达的影响
蔡 辉 袁爱红 (南京军区南京总医院中西医结合科,江苏 南京 210002)
NF-κB是受细胞还原状态影响的转录因子〔1〕,能够被致动脉粥样硬化食谱和氧化低密度脂蛋白等〔2〕参与动脉粥样硬化形成的细胞产物激活。NF-κB系统与氧化应激和炎症的调节有着密切且通用的联系〔3~5〕。在人类的一些炎性疾病中已经发现了 NF-κB 的激活〔6,7〕。研究显示,NF-κB 参与了再狭窄和动脉粥样硬化的脉管系统增殖紊乱的发病机制〔8,9〕,在增厚的纤维变性的内膜-中膜和粥样斑块里存在高水平活化的NF-κB,而在健康血管中几乎检测不到活化的NF-κB〔10〕。本文在前人研究的基础之上探讨针刺是否能对高脂饮食诱导的高脂血症大鼠主动脉内皮NF-κB的表达产生影响。
1 材料与方法
1.1 实验动物 刚断乳的SD雄性大鼠26只,体重54~69 g,由南京军区南京总医院动物实验中心提供〔实验动物使用许可证号 SYXK(苏)2003-0032〕。
1.2 实验方法 所有SD大鼠均适应性喂养1 w,根据体重随机分为自配方高脂饲料组(17只)和普通饲料组(对照组,9只),喂养12 w后,空腹过夜,球后静脉取血3 ml,室温静置1 h后,3 000 r/min离心5 min,分离血清置-20℃冰箱保存,测NO和髓过氧化物酶(MPO)。然后根据体重将高脂饲料组大鼠随机分为模型组(8只)和针刺组(9只),针刺组选取后三里、内庭、心俞三穴,进针后,每穴快速行针1 min,后三里和内庭接通G6805Ⅱ型电针仪连续波15 min,强度1 mA,频率10 Hz。每次选取一侧肢体,两侧轮流,周一到周六治疗,周日休息,连续4 w。实验期间所有大鼠均自由摄食饮水。
1.3 观察指标和检测方法 实验结束后,禁食24 h,用20%氯胺酮,以1 ml/100 g剂量麻醉后,剪开胸腹腔,暴露心脏,于冰盘中分离主动脉,剪一段2 cm长主动脉置4%甲醛固定液中固定,其余置液氮中保存待测各项指标。甘油三酯(TG)用TPOPAP法,总胆固醇(TC)用CHOD-PAP法,高密度脂蛋白胆固醇(HDL-C)和低密度脂蛋白胆固醇(LDL-C)用选择性沉淀法,NO用硝酸还原法,SOD活力用黄嘌呤氧化酶法,MDA用硫代巴比妥酸法,试剂盒由南京建成生物工程研究所提供;NF-κB采用免疫组化法,以平均光密度表示,试剂盒由南京凯基生物公司提供。
1.4 统计学方法 两组比较用独立样本t检验,多组资料组间比较用单因素方差分析,方差齐性用LSD,方差不齐用Games-Howell。统计软件用SPSS15.0,数据以±s表示。
2 结果
2.1 针刺干预前高脂组与对照组血清指标 高脂组大鼠TG、TC、HDL 和 LDL 明显高于对照组(P=0.000、0.000、0.001、0.037)。高脂大鼠MPO明显高于对照组,NO明显低于对照组(P=0.002,0.000)。见表 1。
表1 针刺干预前各组血清指标检测结果(±s)

表1 针刺干预前各组血清指标检测结果(±s)
与对照组比较:1)P<0.05,2)P<0.01
组别 TG(mmol/L) TC(mmol/L) HDL-C(mmol/L) LDL-C(mmol/L) NO(μmol/L) MPO(U/L)对照组(n=9) 0.929 0±0.049 9 1.830 7±0.075 4 1.061 4±0.056 1 0.195 3±0.017 0 23.076 9±1.138 74 2.281 2±2.549 4高脂组(n=17) 1.824 6±0.086 41)3.385 3±0.226 72)1.724 8±0.159 52) 0.407 7±0.092 6 13.074 9±0.762 3 52.229 8±1.563 6
2.2 针刺干预后各组主动脉氧化应激相关指标 模型组NO明显低于对照组(P=0.009),针刺组NO较模型组明显升高(P=0.002);模型组SOD明显低于对照组(P=0.012),针刺组比模型组明显升高(P=0.015);模型组MDA明显高于对照组(P=0.002),针刺组MDA明显降低(P=0.004)。见表2。
表2 干预后各组主动脉NO、SOD和MDA检测结果(±s)
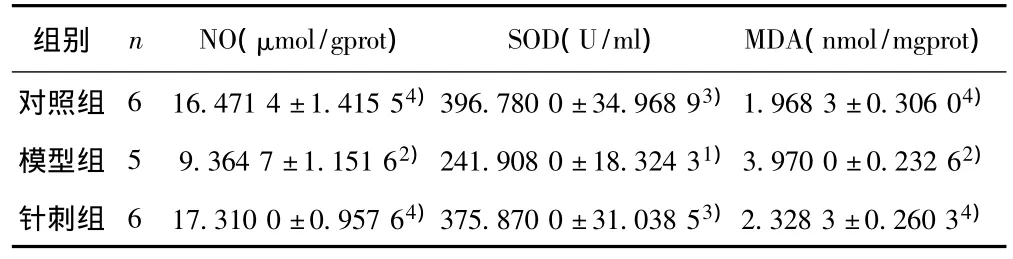
表2 干预后各组主动脉NO、SOD和MDA检测结果(±s)
与对照组比较:1)P<0.05,2)P<0.01;与模型组比较:3)P<0.05,4)P<0.01
组别 n NO(μmol/gprot) SOD(U/ml) MDA(nmol/mgprot)对照组 6 16.471 4±1.415 54)396.780 0±34.968 93)1.968 3±0.306 04)模型组 5 9.364 7±1.151 62)241.908 0±18.324 31)3.970 0±0.232 62)针刺组 6 17.310 0±0.957 64)375.870 0±31.038 53)2.328 3±0.260 34)
2.3 各组主动脉内皮NF-κB的表达 模型组平均光密度明显高于对照组(0.505 8±0.083 2,0.215 0±0.021 1,P=0.02),针刺组明显低于模型组(0.312 0±0.019 3,P=0.012),高于对照组(P=0.000)。
3 讨论
高脂饮食能够使机体的氧化应激水平增加〔11〕。本研究结果显示,与普通饲料喂养的大鼠相比,高脂饮食喂养的SD大鼠,血清TG、TC、MPO和主动脉MDA均明显升高,血清和主动脉NO及主动脉SOD均明显降低,说明高脂饮食诱导SD大鼠发生高脂血症,造成机体氧化应激水平的增加,损伤了主动脉内皮。血管内皮损伤与心血管疾病的发生发展密切相关。
NF-κB是由Rel家族组成的二聚体转录因子群,包括5个紧密联系的 DNA 结合蛋白:RelA(p65)、RelB、c-Rel、NF-κB1(p50)、NF-κB2(p52),享有一个高度保守的300个氨基酸长度的N端Rel同源区(RHD),RHD是进行DNA结合、二聚化和核转移的功能区域。NF-κB快速而短暂的激活对生理功能的实现具有重要意义,但是各种刺激诱导NF-κB持久活化则会造成内环境的恶化。研究显示,NF-κB与氧化应激的反应过程密切相关,研究显示在培养液中直接加入H2O2激活了不同品系细胞株的 NF-κB〔12〕。
本研究中模型组大鼠主动脉内皮NF-κB表达明显增强,分析其原因可能与氧化应激和炎症反应有关。其机制可能为:一方面高脂时机体严重的氧化应激状态增加了活性氧(ROS)的释放,Deng等研究认为各种因素引起的细胞内ROS的增加都能够激活NF-κB〔13〕。ROS和氧化应激激活了NEMO核输出级联,促进了ⅠKK复合物和NF-κB信号的活化〔14〕,并且该激活依赖于组织的种类和 ROS的浓度〔4〕;激活的 NF-κB抑制了JNK信号,造成了ROS进一步的增加〔5〕。另一方面,高脂饮食产生的氧自由基可能引起了主动脉的炎症反应。当ROS在细胞内形成时,NF-κB活性上调,导致细胞因子、化学因子、细胞内黏附分子以及激活免疫与炎症系统的炎性酶的表达。NF-κB信号通过化学因子、细胞因子以及他们各自的受体诱导的自分泌环结构上的激活发送,导致巨噬细胞、粒细胞、T细胞和B细胞的分化,这些细胞密切参与了炎症过程。研究显示,ROS能够诱导DNA损伤和改变细胞内信号转导途径,其中最重要的是通过NF-κB的信号。
与模型组相比,针刺组大鼠主动脉NO、SOD明显升高,MDA和NF-κB的表达显著降低,说明针刺能够增强高脂大鼠的抗氧化能力,对高脂大鼠主动脉内皮具有保护作用,该作用可能是通过对NF-κB信号系统的调节实现的。推测针刺抑制NF-κB的可能机制有二:针刺直接抑制了NF-κB基因的表达;或者针刺抑制了ⅠκB激酶系统的活性。至于其具体机制,在今后的研究中将继续摸索。
1 Winyard PG,Blake DR.Antioxidants,redox-regulated transcription factors,and inflammation〔J〕.Adv Pharmacol,1997;38(3):403-21.
2 Rubbo H,O'Donnell V.Nitric oxide,peroxynitrite and lipoxygenase in atherogenesis:mechanistic insights〔J〕.Toxicology,2005;208(2):305-17.
3 Kabe Y,Ando K,Hirao S,et al.Redox regulation of NF-kappa B activation:distinct redox regulation between the cytoplasm and the nucleus〔J〕.Antioxid Redox Signal,2005;7(3-4):395-403.
4 Gloire G,Dejardin E,Piette J.Extending the nuclear roles ofⅠkappaB kinase subunits〔J〕.Biochem Pharmacol,2006;72(9):1081-9.
5 Papa S,Bubici C,Zazzeroni F,et al.The NF-kappa B-mediated control of the JNK cascade in the antagonism of programmed cell death in health and disease〔J〕.Cell Death Differ,2006;13(5):712-29.
6 Simmonds RE,Foxwell BM.Signalling,inflammation and arthritis:NF-kappaB and its relevance to arthritis and inflammation〔J〕.Rheumatology(Oxford),2008;47(5):584-90.
7 Hajra L,Evans AⅠ,Chen M,et al.The NF-kappa B signal transduction pathway in aortic endothelial cells is primed for activation in regions predisposed to atherosclerotic lesion formation〔J〕.Proc Natl Acad Sci U S A,2000;97(16):9052-57.
8 Maruyama Ⅰ,Shigeta K,Miyahara H,et al.Thrombin activates NF-kappa B through thrombin receptor and results in proliferation of vascular smooth muscle cells:role of thrombin in atherosclerosis and restenosis〔J〕.Ann N Y Acad Sci,1997;811(3):429-36.
9 Brand K,Page S,Walli AK,et al.Role of nuclear factor-kappa B in atherogenesis〔J〕.Exp Physiol,1997;82(2):297-304.
10 Brand K,Page S,Rogler G,et al.Activated transcription factor nuclear factor-kappa B is present in the atherosclerotic lesion〔J〕.JClin Ⅰnvest,1996;97(7):1715-22.
11 Haan JB,Witting PK,Stefanovic N,et al.Lack of the antioxidant glutathione peroxidase-1 does not increase atherosclerosis in C57BL/J6 mice fed a high-fat diet〔J〕.J Lipid Res,2006;47(6):1157-67.
12 Berg R,Haenen GR,Berg H,et al.Transcription factor NF-kappaB as a potential biomarker for oxidative stress〔J〕.Br J Nutr,2001;86(S1):S121-7.
13 Deng L,Lin Lee YC,Claret FX,et al.2-acetylaminofluorene up-regulates rat mdr1b expression through generating reactive oxygen species that activate NF-kappa B pathway〔J〕.J Bioi Chem,2001;276(1):413-20.
14 Wuerzberger Davis SM,Nakamura Y,Seufzer BJ,et al.NF-kappaB activation by combinations of NEMO SUMOylation and ATM activation stresses in the absence of DNA damage〔J〕.Oncogene,2007;26(5):641-51.

