罗格列酮在人结肠癌氟尿嘧啶化疗增敏作用中对细胞凋亡的影响
胡啸玲 汤恢焕 周志刚 尹 峰 刘文捷 (中南大学湘雅医院,湖南 衡阳 4200)
大肠癌是世界常见的恶性肿瘤之一,对化疗敏感性低、多药耐药致晚期肿瘤死亡率高,故寻找高效、毒副作用小的大肠癌耐药逆转方法具有重要社会效益和广阔临床应用前景。研究报道过氧化物酶体增殖因子活化受体 γ(PPARγ)配体罗格列酮(ROZ)抗肿瘤机制有:①诱导细胞凋亡〔1〕;②改变细胞周期〔2〕;③诱导肿瘤细胞分化〔3〕;④抑制环氧合酶 2(COX-2)表达〔4〕;⑤诱导肿瘤抑制基因酪氨酸磷酸酶蛋白(PTEN)表达上调〔5〕;⑥调节醛脱氢酶 3(ALDH3)表达〔6〕;⑦调节抗肿瘤免疫〔7〕;⑧抑制肿瘤细胞转移相关蛋白的表达;⑨抑制肿瘤新生血管形成等〔8〕。本文通过观察 ROZ和 5-氟尿嘧啶(5-Fu)对人结肠癌细胞系 HT-29细胞的体外诱导凋亡作用以及在无细胞毒作用浓度下 ROZ和 5-Fu联合用药时的化疗增敏作用,初步探讨其诱导体外培养 HT-29细胞凋亡及可能机制。
1 材料与方法
1.1 材料 HT-29细胞系购自中国典型培养物中心。核转录因子(NF)-κB、PPARγ、Bcl-2、Bax购自迈新生物技术有限公司;聚丙烯酰胺凝胶电泳所用各种分子生物学试剂均购自Amreco公司;流式细胞仪,Beckerman coulter EPICS-XL;图像分析系统(PIPS-2020),重庆天海医疗设备有限公司。
1.2 方法
1.2.1 AO/EB荧光染色显微镜观察细胞凋亡 取对数生长期细胞,消化,制成单细胞悬液,接种于 50 ml培养瓶中,每瓶4.5ml细胞悬液,含 HT-29细胞 4×107个。细胞置 37℃、95%湿度、含 5%CO2培养箱孵育 12 h后取出,ROZ组加入 0.5 ml不同浓度的 ROZ溶液,使各组 ROZ终浓度分别为 1.0、10.0、100.0μmol/L;ROZ与 5-Fu联合组加入 0.25 ml ROZ(终浓度为 1.0μmol/L)溶液和 0.25 ml不同浓度的 5-Fu溶液,使 5-Fu溶液终浓度分别为 3.0、6.0、12.0μg/L;环胞素A(CsA)与 5-Fu联合组加入 0.25 ml CsA(终浓度为 50 ng/ml)溶液和 0.25 ml的 5-Fu溶液(终浓度 6.0μg/L);5-Fu组加入 0.5 ml不同浓度的 5-Fu溶液,终浓度分别为 3.0、6.0、12.0μg/L;对照组换等量培养基,培养 24h。以胰酶消化,收集约 1×107个细胞,离心弃上清液加磷酸盐缓冲液(PBS)洗 3次,制成细胞悬液,吸95μl细胞悬液加入 5μl吖啶橙(AO)染液,充分混匀,滴于玻片上,分别计数。细胞凋亡率(%)=〔(早期凋亡细胞+晚期凋亡细胞)/全部细胞〕×100%。
1.2.2 流式细胞术分析细胞周期和细胞凋亡率 取对数生长期细胞,弃去旧培养基,以胰酶消化,制成单细胞悬液,接种于50 ml培养瓶中,每瓶 4.5 ml细胞悬液,含 HT-29细胞 4×107个。细胞置 37℃,95%湿度,含 5%CO2培养箱孵育 12 h后取出。进行分组处理,其分组、各组液体的浓度与 1.2.1相同,对照组换等量培养基,培养 24 h后,收集 1×106以上细胞,PBS洗 2遍,弃上清液,用 75%乙醇固定,过夜,PBS洗 3次后,经0.5g/L的 RnaseA消化 30 min,终浓度 65 mg/L的碘化丙啶(PI)染色 1 h后流式细胞仪(型号为 FACS420)测定,分析细胞周期,计算凋亡率。
1.2.3 Western印迹分析 观察 ROZ处理 HT-29后 PPARγ、NF-κB、Bcl-2、Bax蛋白表达情况。细胞培养至对数生长期时,加 ROZ及 PPARγ特异阻断剂白杨素(阳性对照药)处理。作量效关系研究时用 Roz(终浓度为 1.0,10.0,100.0μmol/L)分别处理对数生长期 HT-29细胞,培养 12 h后收集细胞;作时效关系研究时用 10.0μmol/L的ROZ分别处理对数生长期 HT-29细胞,0、4、8、12 h后收集细胞。以冷 PBS洗 2次,滤纸吸干,加入适量的裂解液置于冰上孵育 30 min,细胞刮收集细胞于EP管,4℃离心,12 000 r/min×10 min,上清液即为细胞总蛋白,用二喹啉甲酸(BCA)试剂进行蛋白定量。调节每份样品浓度,以每孔 20μg的蛋白量上样,样品加入等体积的 2×十二烷基硫酸钠(SDS)加样缓冲液,沸水煮沸 10 min,根据不同蛋白分子量用不同浓度的 SDS-聚丙烯凝胶(PAGE)电泳后转膜,加入相应的Ⅰ抗、Ⅱ抗孵育,用辣根过氧化物酶-电化学荧光法(HRP-ECL)显影压片。
1.3 统计学分析 采用SPSS10.0统计软件进行分析,one-way ANOVA和 t检验法分析,数值用±s表示。
2 结 果
2.1 流式细胞仪分析ROZ、5-Fu对 HT-29细胞凋亡和细胞周期的影响
2.1.1 ROZ对细胞凋亡的影响 流式细胞术显示HT-29细胞的自然凋亡率为(1.82±0.26)%,1.0μmol/L的 ROZ并不诱导细胞凋亡。见表 1。
表1 流式细胞仪检测ROZ对 5-Fu诱导HT-29细胞凋亡的影响(±s,n=3,%)
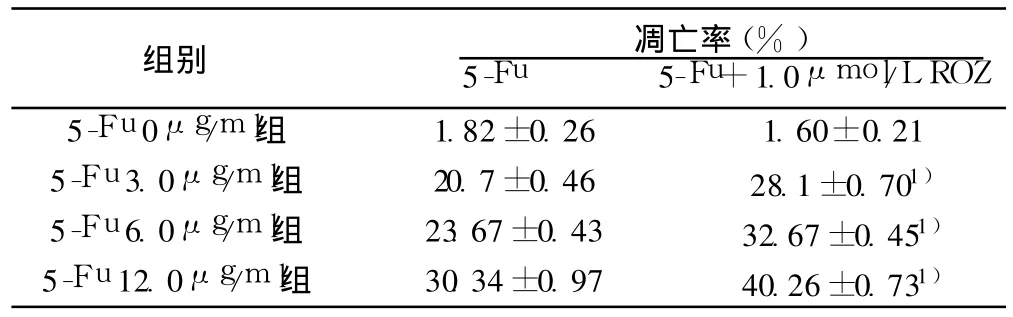
表1 流式细胞仪检测ROZ对 5-Fu诱导HT-29细胞凋亡的影响(±s,n=3,%)
与 5-Fu组比较:1)P<0.01
组别 凋亡率(%)5-Fu 5-Fu+1.0μmol/L ROZ 5-Fu 0μg/ml组 1.82±0.26 1.60±0.21 5-Fu 3.0μg/ml组 20.7±0.46 28.1±0.701)5-Fu 6.0μg/ml组 23.67±0.43 32.67±0.451)5-Fu 12.0μg/ml组 30.34±0.97 40.26±0.731)
2.1.2 ROZ促进5-Fu诱导 HT-29细胞凋亡 不同浓度的 5-Fu(3.0,6.0,12.0μg/ml)与细胞作用 72 h后,一定程度上诱导HT-29细胞凋亡,但与 ROZ(1.0μmol/L)合用时,其凋亡率均有增加。见表 1,图 1。
2.1.3 ROZ联合不同浓度 5-Fu对HF-29细胞凋亡周期的影响 见表 2。
2.2 AO/EB荧光染色法检测ROZ对HT-29细胞凋亡的影响HT-29细胞的自然凋亡率为(1.43±0.25)%。1.0、10.0、100.0μmol/L的 ROZ作用 72 h后凋亡率分别为(1.44±0.07)%,(2.34±0.23)%,(14.13±1.36)%。此结果与流式细胞术所检测结果一致。
2.3 AO/EB荧光染色法检测 ROZ与 5-Fu合用时对 HT-29细胞凋亡的影响 当1.0μmol/L ROZ作用 72 h后,HT-29细胞的凋亡率为(1.44±0.07)%,与二甲基亚砜(DMSO)对照组细胞凋亡率〔(1.15±0.13)%〕无明显差异,提示 1.0μmol/L ROZ无诱导HT-29细胞凋亡作用。5-Fu(3.0、6.0、12.0μg/ml)组的凋亡细胞率分别为(13.91±0.38)%,(18.16±0.42)%,(23.14±2.69)%,当 1.0μmol/L ROZ联合不同浓度的 5-Fu(3.0、6.0、12.0μg/ml)处理 HT-29细胞,其凋亡率分别为(27.35±0.86)%,(33.89±1.16)%,(38±1.62)%。凋亡细胞较单用 5-Fu明显增加(P<0.01)。CsA(5 ng/ml)组、5-Fu(6.0μg/ml)+CsA(5 ng/ml)+ROZ(1.0μmol/L)组凋亡率分别为(1.21±0.20)%、(38.62±1.05)%。
荧光显微镜下观察细胞,正常形态饱满,细胞质呈绿色,核染色为亮绿色,核形态较为规则,均为圆形或椭圆形;5-Fu(6.0μg/ml)、ROZ(1.0μmol/L)和 5-Fu(6.0μg/ml)联合 ROZ(1.0μmol/L)分别处理 72h的 HT-29细胞可见部分细胞体积明显变小,细胞外形皱折,结构模糊,呈致密浓染的桔黄色或红色荧光,可见细胞胞浆减少、细胞核染色质固缩偏向一边,核碎裂和核裂解为质膜包绕的碎片,细胞膜完整,表面有牙状突起等凋亡细胞形态学改变,并可见细胞碎片。凋亡率以 5-Fu联合 ROZ组最高,呈剂量依赖性。见图 1。
2.4 Western印迹法测定 ROZ对 HT-29细胞 PPARγ、NF-κB、Bcl-2、Bax表达的影响 3.0μmol/L的 ROZ处理 HT-29细胞4 h后 PPARγ表达上调,NF-κB表达下调、Bcl-2表达下调、Bax表达上调,呈时间依赖性。见图 2。1.0,10.0,100.0μmol/L ROZ和白杨素 100.0μmol/L分别处理 HT-29细胞 12 h,PPARγ和 Bax蛋白表达上调,NF-κB和 Bcl-2蛋白表达下调、Bcl-2/Bax比例下降,呈浓度依赖性。与空白对照组比较,有显著性差异(P<0.05)。而使用 PPARγ特异阻断剂白杨素后,上述作用即可逆转。见图 3、图 4,表 3~表 5。
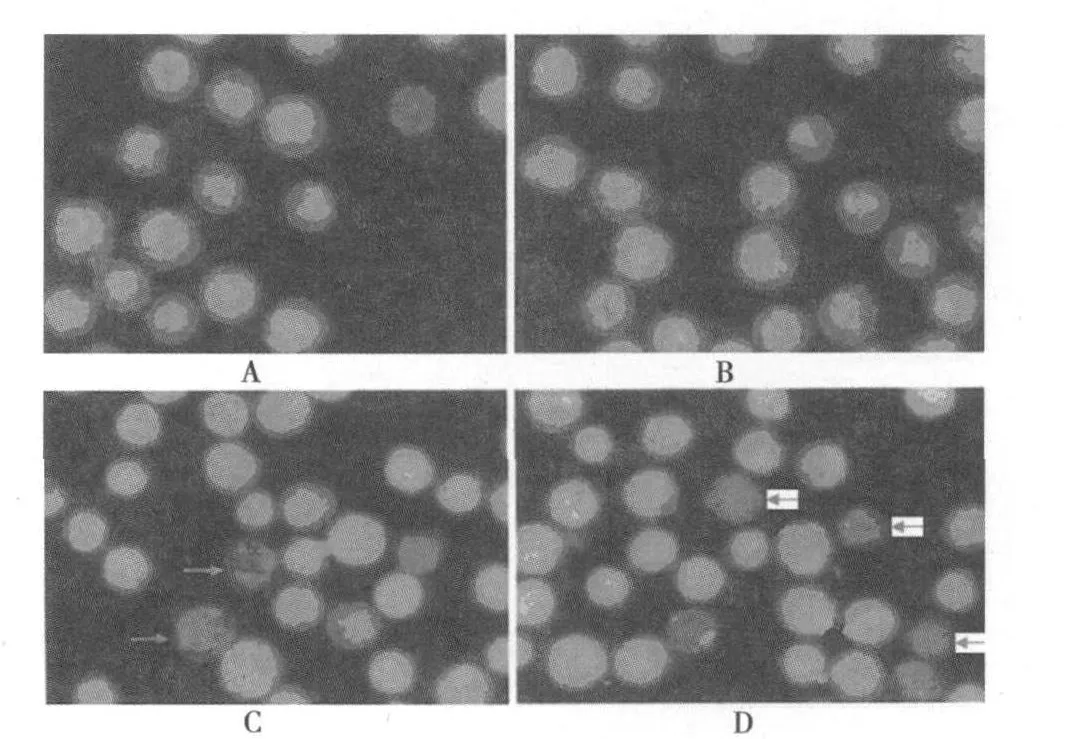
图1 AO/EB荧光染色荧光显微镜观察 ROZ与5-Fu合用诱导 HT-29细胞凋亡作用(×400)

表2 罗格列酮联合不同浓度 5-Fu(μmol/L)对 HT-29细胞凋亡周期的影响
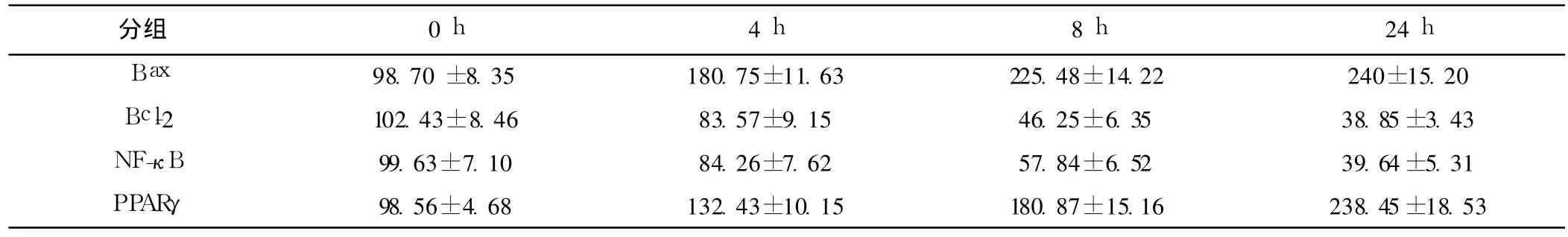
表3 罗格列酮(3.0μmol/L)对 HT-29细胞不同时间各组蛋白表达的影响
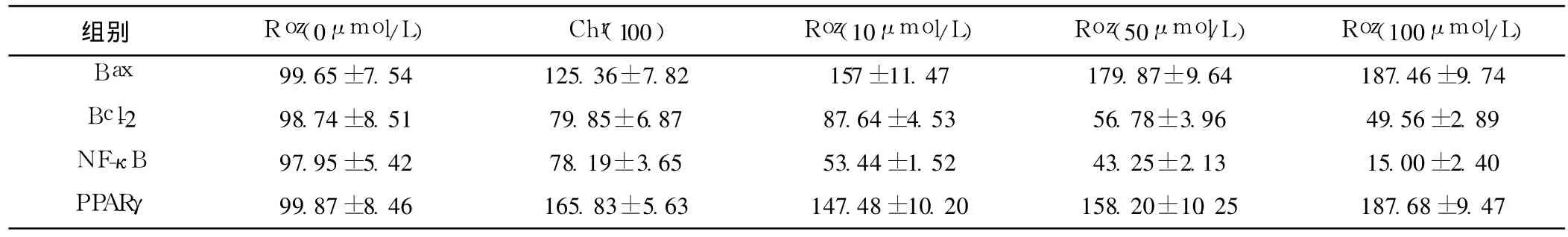
表4 不同浓度罗格列酮对HT-29细胞各组蛋白表达的影响

表5 PPARγ阻断剂白扬素与不同浓度 ROZ相互作用后对 HT-29细胞 Bcl-2/PPARγ蛋白表达的影响

图2 HT-29细胞不同时间 Bax、Bcl-2、NF-κB、PPARγ蛋白表达的影响
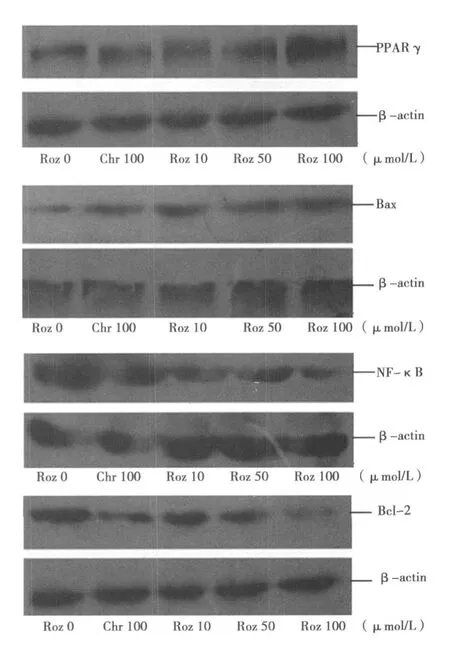
图3 不同浓度 ROZ对 HT-29细胞 PPARγ、Bax、NF-κB、Bcl-2蛋白表达的影响

图4 PPARγ阻断剂与不同浓度ROZ相互作用后对 HT-29细胞 Bcl-2、PPARγ蛋白表达的影响
3 讨 论
3.1 ROZ对HT-29细胞的作用及可能机制 PPAR是 1990年发现的一类与甲状腺激素和维甲酸受体密切相关的核激素受体,可分为 PPARα、PPARβ、PPARγ三个亚族〔9〕。其中生物学功能最复杂和研究最多的是 PPARγ。近年来大量研究〔10,11〕发现 PPARγ在多种肿瘤组织及其癌旁组织中均有表达,如肺、乳腺、前列腺及消化道肿瘤及其癌旁组织中,PPARγ配体能促进肿瘤细胞凋亡,从而起到对肿瘤的化学预防和治疗作用。因此,本文用 PPARγ合成配体 ROZ作用于体外培养的 HT-29细胞,观察其对HT-29细胞的凋亡影响,并通过对相关的分子生物学指标的检测,初步探讨其作用机制。
本实验通过 FCM分析、AO荧光染色法及 Western印迹证实 PPARγ的配体 ROZ对 HT-29细胞有促进凋亡作用。FCM周期分析显示,ROZ能诱导HT-29细胞调亡,呈剂量依赖性,它使 HT-29细胞阻滞于G1期。同时通过 Western印迹法对与细胞周期和凋亡相关的一些基因的表达进行了检测,结果显示,ROZ作用后,HT-29细胞的 PPARγ蛋白核内表达上调、NF-κB蛋白、Bcl-2蛋白表达下调、Bax蛋白表达上调。这提示 ROZ对HT-29细胞所产生的抑制作用可能是通过二条通路实现的:一是影响细胞周期的进程,二是诱导细胞凋亡。
NF-κB能调控许多基因表达,在肿瘤的形成和转移过程中发挥重要作用。生理状态下 NF-κB位于胞质内,呈非活性状态与 NF-κB抑制蛋白(IκB)结合,一旦被病毒、氧化剂、炎症细胞因子等刺激剂激活后便与IκB解离而转入核内与特异的启动子结合,从而调控基因的表达〔12〕。研究发现〔13,14〕,NF-κB过度激活与许多病毒和非病毒的恶性肿瘤有关,如肝癌、大肠癌,肺癌等,NF-κB导致癌症的发生是因为细胞因子或其受体基因转录的激活,阻断了凋亡。其次 NF-κB活化可直接作用于 DNA复制或具有促进细胞周期素D1(Cyclin D1)表达及 G1/S转换功能,使细胞过度增殖导致癌症的发生〔15〕。体外实验表明抑制 NF-κB能促进肿瘤细胞发生凋亡〔16〕。本实验证明 NF-κB因子在HT-29细胞上呈激活状态,HT-29细胞经ROZ处理后与对照组比较,NF-κB蛋白核内表达明显下调,而 HT-29细胞出现增殖抑制,凋亡率增加。
本研究证实PPARγ蛋白在 HT-29细胞的胞浆及核膜上表达,ROZ作用后,PPARγ蛋白在核内表达明显上调,与 Chen等〔17〕人结果相一致。HT-29细胞经 ROZ处理后与对照组比较,NF-κB蛋白核内表达明显下调。这提示 PPARγ的合成配体 ROZ抑制 HT-29细胞增殖促进 HT-29细胞发生凋亡,与激活 PPARγ受体进而抑制 NF-κB有关。
Bcl-2基因是一种抗凋亡基因,其编码的蛋白Bcl-2是一种结合于核膜、线粒体膜和内质网膜外表面的蛋白质,Bcl-2通过改变膜对一些离子、小分子或蛋白质的通透性而参与细胞凋亡的调控。Bcl-2可通过多种途径起到抗细胞凋亡作用而Bax促进细胞凋亡,细胞内Bcl-2的数量过多会使正常细胞转化为肿瘤细胞,即使接受凋亡信号也不会发生凋亡〔18〕。本研究证实,HT-29细胞经 ROZ处理后,与对照组比较 Bcl-2蛋白表达明显下降,而 Bax蛋白表达增高,Bcl-2/Bax比值降低,HT-29细胞增殖抑制,细胞凋亡率增加。
有研究证实〔19,20〕,NF-κB通过诱导或上调抗凋亡基因Bcl-2抑制凋亡。本研究通过 Western印迹法对与细胞周期和凋亡相关的一些基因的表达进行检测,发现 ROZ作用后,HT-29细胞的 NF-κB蛋白核内表达下调、Bcl-2蛋白表达下调、Bax蛋白表达上调,Bcl-2/Bax比值降低从而抑制HT-29细胞增殖,促进 HT-29细胞凋亡。这提示 HT-29细胞经 ROZ作用后,PPARγ受体活化、下调 NF-κB蛋白、Bcl-2蛋白表达,下调 Bcl-2/Bax比值,发挥抑制肿瘤细胞增殖,诱导细胞凋亡的作用。而使用 PPARγ特异阻断剂后,上述作用即可消失,PPARγ受体不能活化,而BCL-2蛋白表达上调。
3.2 ROZ增加HT-29细胞对 5-Fu的敏感性及可能机制 对化疗耐药性的研究表明,NF-κB、Bcl-2与化疗耐药相关。Bcl-2/Bax比值可作为预测肿瘤患者是否存在耐药的一项指标。另外有研究表明,NF-κB通过诱导或上调抗凋亡基因,能激活 B细胞淋巴瘤/Bcl-2家族中抗凋亡蛋白(AL/Bfl-1)而抑制由肿瘤坏死因子-α(TNF-α)引起的细胞凋亡〔19〕。 Chen等〔17〕人研究证实:15d-PGJ2,环格列酮可显著抑制 NF-κB表达进而下调 bcl-2的表达,从而抑制HT-29细胞生长和诱导细胞凋亡。本研究已证实ROZ可通过与PPARγ受体来影响一些和肿瘤耐药有关的基因表达。Cox等〔21〕报道临床常规剂量口服给药后,ROZ的人体血药峰值浓度为 1.67μmol/L。AO染色荧光显微镜法和FCM法结果皆显示:ROZ、5-Fu能诱导 HT-29细胞凋亡,呈剂量依赖性。1.0μmol/L ROZ能明显增强5-Fu对HT-29细胞凋亡诱导作用。ROZ使 HT-29细胞阻滞于 G1期,呈剂量依赖性。West印迹法显示,ROZ作用 24 h后 HT-29细胞的 PPARγ蛋白表达明显上调,NF-κB,Bcl-2蛋白表达上调,Bcl-2相关 X蛋白(BAX)蛋白表达上调,增强 5-Fu对HT-29细胞的增殖抑制或诱导凋亡作用。而 PPARγ的特异阻断剂白杨素可以逆转上述作用。因此认为 ROZ可通过激活 PPARγ受体,进而抑制NF-κB、Bcl-2蛋白表达,下调 Bcl-2/Bax比值,增敏 5-Fu对 HT-29细胞的增殖抑制和诱导凋亡作用。
综上所述,ROZ诱导HT-29细胞增殖和凋亡机制之一可能与抑制肿瘤细胞NF-κB进而抑制Bcl-2蛋白表达,上调Bax蛋白表达有关。而 ROZ增强HT-29细胞对 5-Fu敏感性机制之一可能同样与这三种凋亡相关蛋白相互作用,使大肠癌细胞重新启动凋亡机制有关。
1 Shimada T,Kojima K,Yoshiura K,et al.Characteristics of the peroxisome proliferator activated receptor gamma(PPAP gamma)ligand induced apoptosis in colon cancer cells〔J〕.Gut,2002;50(5):658-64.
2 Koga H,Harade M,Ohtsubo M,et al.Troglitazone induces p27 Kipl-associated cell-cycle arrest through down-regulation SKp 2 in human hepatoma cells〔J〕.Hepatology,2003;37(5);1086-96.
3 Kato M,Kusumi T,Tsuchida S,et al.Induction of differentiation and peroxisome proliferator-activated receptor gamma expression in colon cancer cell lines by troglitazone〔J〕.J Cancer Res Clin Onxol,2004;130(2):73-9.
4 Yang WL,Frucht H.Activation of the PPAR pathways induces apoptosis and cox-2 inhibition in HT-29 human colon cancer cell〔J〕.Carciongenesis,2001;22(2):1379-83.
5 Farrow B,Evers BM.Activation of PPAR gamma increases PTEN expression in pancreatic cancer cells〔J〕.Biochem Biophys Res Commun,2003;30(1):50-3.
6 Canuto RA,Maggiora M,Trombett A,et al.Aldehydedehydrogenase 3 expression is decreased by clofibrate via PPARgamma induction in JM2 rat hepatoma cell line〔J〕.Chem Biol Interact,2003;143:29-35.
7 Rumi MA,Sato H,Ishihara S,et al.Growth inhibition of esophageals-quamous carcinoma cells by peroxisomeproliferator-activated receptor-gamma ligands〔J〕.JLab Clin Med,2002;140(1):17-26.
8 Hashimoto K,Eghridge RT,Evers BM.Peroxisome proliferator-activated receptor gamma ligand inhibits cell growth and invasion of human pancreatic cancer cells〔J〕.Int J Gastointest Cancer,2002;32(1):7-22.
9 Kornblau SM,Thall P,Estrov Z,et al.The prognostic impact on BCL-2 protein expression in acute mylogenous leukemia varies with cytogenetics〔J〕.Clin Cancer Res,1999;5(7):1758-66.
10 Kubota T,Koshizuka K,Williamson EA,et al.Ligand for peroxisome proliferator activated receptor gamma(troglitazone)has potent antitumor effect against human prostate cancer both in vitro and in vivo〔J〕.Cancer Res,1998;58(15):3344-52.
11 Koeffler HP.Peroxisome proliferator-activated receptor gamma and cancers〔J〕.Clin Cancer Res,2003;9(1):1-9.
12 Tsubouchi Y,Sano H,Kawahito Y,et al.Inhibition of human lung cancer cell growth by peroxisome proliferator-activated receptor-gamma agomists through induction of apoptosis〔J〕.Biochem Biophys Res Commun,2000;270(2):400-5.
13 Evans AR,Limp-Foster M,Kelley MR.Going APE over ref-1〔J〕.Mutat Res,2000;461(2):83-108.
14 Sakuda S,Tamura S,Yamada A,et al.NF-kappaB activation in non-parenchymal liver cells after partial hepatectomy in rats:possible involvement in expression of heparin-binding epidermal growth factor-like growth factor〔J〕.JHepatol,2002;36(4):527-33.
15 Hinz M,Krappmann D,Eichten A,et al.NF-kappaB function in growth control:regulation of cyclin D1 expression and G0/G1-to-S-phasetransition〔J〕.Mol Cell Biol,1999;19(4):2690-8.
16 许凯黎.细胞凋亡基因异常调控在肿瘤和肺癌发生及发展中的研究进展〔J〕.中国癌症杂志,1997;7(1):4-6.
17 Chen GG,Lee JF,Wang SH,et al.Apoptosis induced by activation of peroxisome-proliferator activated receptor-gamma is associated with Bcl-2 and NF-kappaB in human colon cancer〔J〕.Life Sci,2002;70(22):2631-46.
18 Li P,Nihawan D,Budihardjo I,et al.Cytochrome Cand dATP-dependent formation of Apaf-1/caspase-9 complex initiates an apoptotic protease cascade〔J〕.Cell,1997;91(4):479-89.
19 Wang CY,Guttridge DC,Mayo MW,et al.NF-kappaB induces expression of the Bcl-2 homologue Al/Bfl-1 to preferentially suppress chemotherapy-induced apoptosis〔J〕.Mol Cell Biol,1999;19(9):5923-29.
20 Tamatani M,Chen YH,Matsuzaki H,et al.Tumor necrosis factor induces Bcl-2 and Bcl-x expression through NF kappaB activation in primary hippocampal neurons〔J〕.JBiol Chem,1999;274(13):8531-8.
21 Cox PJ,Ryan DA,Hollis FJ,et al.Absorption,disposition,and metabolism of rosiglitazone,a potent thiazolidinedione insulin sensitizer,in humans〔J〕.Drug Metab Dispos,2000;28(7):772-80.

