黄酮类化合物改性方法的研究进展
张红城,吴正双,高文宏,董 捷,*
黄酮类化合物改性方法的研究进展
张红城1,吴正双2,高文宏2,董 捷1,*
(1.中国农业科学院蜜蜂研究所,北京 100093;2.华南理工大学轻工与食品学院,广东 广州 510641)
黄酮类化合物是一类具有广泛应用的植物化学物,由于其结构的不同,生理活性有很大差异,因此可以通过改性,使天然黄酮类物质发挥特定功能。本文综述了国内外对黄酮类化合物的几种改性方法,包括糖基化、去糖基化、酰化、甲基化以及其他改性方法,并阐述改性前后生理活性的变化。
黄酮类化合物;改性方法;生物活性
黄酮类化合物是植物多酚的一个亚群,是植物重要的一类次级代谢产物,广泛存在于水果、蔬菜、豆类、茶叶等许多食源性植物中。黄酮类化合物泛指两个苯环(A环与B环)通过中央三碳链连结而成的一系列C6—C3—C6化合物(图1),主要是指以2-苯基色原酮为母核的化合物[1],这种基本结构上不含糖基的黄酮类化合物为黄酮苷元,而连有糖基的为黄酮苷,主要是O-糖苷,也有少数的C-糖苷,如牡荆素、葛根素。根据C环结构的不同,可将黄酮类化合物分为黄酮类、黄酮醇类、黄烷酮类、黄烷醇类、儿茶酸类、花色素类、异黄酮类、查儿酮等。由于其结构千差万别,生理活性也多种多样,可以用作医疗药物、抗菌剂、抗氧化剂,能够治疗多种疾病和抑制医学上的机能紊乱。但天然黄酮类化合物大部分以黄酮苷的形式存在,黄酮苷类脂溶性较差,限制了其生物活性的发挥,而且部分黄酮苷类没有其苷元的特性。因此,可通过定向修饰黄酮类化合物的分子结构以发挥其特定功能。黄酮类化合物的修饰方法包括糖基化、去糖基化、酰化、甲基化等。
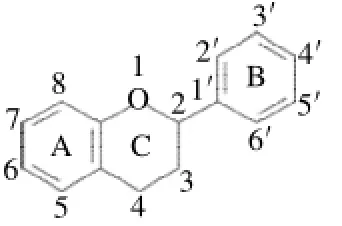
图1 黄酮类化合物的基本母核结构Fig.1 Generic structure of flavonoids
1 黄酮类化合物的糖基化修饰
许多研究人员从微生物中筛选出来一种酶——糖基转移酶,这种酶可以将葡萄糖基转移到黄酮类化合物的母体或糖基上以达到修饰目的。使用这种酶对黄酮类化合物的修饰作用叫作糖基化。糖基化作用主要是增加黄酮类化合物的水溶性和稳定性,降低其细胞毒性,但不足之处是黄酮类化合物的某些生物活性也有不同程度的下降。
Suzuki等[2]将糊精和芦丁溶于50%的水-甲醇中,再加入产自嗜热脂肪芽孢杆菌的环麦芽糊精葡聚糖转移酶和根霉葡萄糖糖化酶,制备出了高产量的水溶性芦丁衍生物。用纸层析、柱层析、真空冷冻干燥和甲醇-乙醇连续提取、分离该衍生物,得到纯净的微黄色的针状结晶。该纯化产物经酸、α-和β-葡萄糖苷酶水解后,用紫外、红外、1H和13C-核磁共振光谱分析水解产物的成分,结果表明,该纯化产物为4G-α-D-吡喃葡萄糖-芦丁,即糊精作为葡萄糖供体与芦丁的吡喃葡萄糖环上的C4结合的产物。这种化合物在水中的溶解度比芦丁的高约3000倍。
Ko等[3]先用PCR技术克隆出蜡状芽孢杆菌UDP-糖基转移酶(BcGT-1),并测定出了其基因序列,然后用His-标签在Escherichia coli BL21中表达出了这种酶,进一步纯化处理后,用来催化黄酮类物质的糖基化反应。结果发现BcGT-1能将尿苷二磷酸活化的糖基转移到苷元(如芹菜素、染料木素、坎非醇、木犀草素、柚皮素和槲皮素)上,接着对糖基化产物进行酸解,用薄层色谱(TLC)方法分析发现,水解产物中的糖类只有葡萄糖。该反应中,葡萄糖基优先转移到3-羟基上,如果没有3-羟基,也可以转移到7-羟基上。根据高效液相色谱(HPLC)和紫外(UV)光谱分析,坎非醇和槲皮素的糖基化产物是3-O-葡萄糖苷和7-O-葡萄糖苷,其中3-O-葡萄糖苷是主要产物;而芹菜素、木犀草素、柚皮素、染料木素因为没有3-羟基,糖基化产物为7-O-葡萄糖苷和4′-O-葡萄糖苷,其中7-O-葡萄糖苷是主要产物。另外,当糖基化位点在黄酮或黄酮醇的C-3′或C-4′羟基上时,反应产物发生蓝移,但糖基化位点在C-7羟基上时,没有蓝移现象。
Kim等[4]在大肠杆菌中表达出了一种糖基转移酶(XcGT-2),这种酶在大肠杆菌中可以作为肽硫转移酶的融合酶。接着,他们用这种酶催化黄酮类化合物的结构修饰反应,核磁共振光谱分析酶反应产物,结果发现:即使黄酮类化合物的C-3′和C-4′都含有羟基,但XcGT-2只特异性地将一个葡萄糖分子转移到C-3′羟基上。
Xiao等[5]研究了糖基化反应对黄酮类化合物结和牛血清白蛋白(BSA)能力的影响。结果发现,4种黄酮苷元(黄岑素、槲皮素、大豆苷元和染料木素)的糖基化产物与BSA的亲和力大大降低,根据糖基化位点和糖基的不同,亲和力一般下降1~3个数量级。吡喃葡萄糖基化产物(如大豆苷和燃料木苷)与BSA的亲和力下降5~10倍,而鼠李糖糖基化产物(如栎素)与BSA的亲和力下降5600倍。这在一定程度上证明了黄酮苷元比黄酮苷更容易被吸收的结论。而且研究表明,糖基化作用不但降低了黄酮类化合物的抗氧化能力,还降低了其疏水性。因此,疏水能力在黄酮类化合物结合蛋白质方面也可能起着重要作用。
Stevenson等[6]从绵羊的肝脏中制备出了葡糖醛酸基转移酶,并用其在Tris缓冲液(pH8.0)中催化水果多酚物质与尿苷二磷酸葡萄糖醛酸(UDPGA)的反应,发现黄酮类物质及其糖苷衍生物可以作为合适的底物而被葡萄糖苷酸化,但酚酸不易被葡萄糖醛酸化。同时,建立了体外细胞模型,并用葡糖醛酸基转移酶处理5种黄酮类物质——槲皮素、儿茶素、表儿茶素、根皮素、根皮苷,然后测试改性后的黄酮类物质对T细胞株和神经母瘤细胞进行实验,结果黄酮类物质葡萄糖苷酸的抗氧化能力(H2O2存在下)下降,IC50由原来的0.5μmol/L变成1~16μmol/L不等,葡萄糖苷的酸化作用弱化了黄酮类物质的细胞保护作用。
黄酮类物质一般是以O-糖基化衍生物的形式在植物中积累,但有些物种合成的主要是黄酮—C—糖苷,这种糖苷在植物学上和膳食组分中都有一定的活性,并且能够稳定水解。有学者在研究中发现了一种葡萄糖基转移酶(OsCGT),并从大米中将其克隆了出来。这种酶能够优先催化UDP-葡萄糖与2-羟基黄烷酮发生C-葡萄糖基化反应,其催化O-葡萄糖基化反应的能力甚微[7]。Cao等[8]用该酶催化2-羟基黄烷酮生成C-葡萄糖苷,但此产物不稳定,能够自发地脱水形成C-6和C-8葡萄糖基衍生物,因此可以再用一种脱水酶将2-羟基黄烷酮-C-葡萄糖苷专一性地转变成黄酮-C-6-葡萄糖苷。
2 黄酮类化合物的去糖基化
天然黄酮类化合物多以糖苷类形式存在,即通过O-糖苷键或C-糖苷键与糖基相连,由于糖的种类、数量、连接位置及连接方式的不同,可以组成各种各样的黄酮苷[9]。
研究发现,一些黄酮类化合物的糖苷和苷元的生物利用率明显不同。J a c o b s等[10]发现,黄酮醇苷元(aglycones)是植物细胞中的一种天然调控因子,能够调节生长素的极性运输和运输量,而黄酮醇糖苷对其没有调控活性。Ratty等[11]研究结果表明,一些黄酮苷元如5,7,4′-三羟基黄酮、柚皮素苷元、橘皮素苷元、香叶木素苷元、槲皮素苷元、根皮素苷元和杨梅黄酮苷元在抑制二氨基二苯甲烷(MDA)的生成上比它们的糖苷更有效。
Felgines等[12]通过小鼠体内的吸收动力学实验,研究了柚皮素、柚皮素-7-鼠李葡萄糖苷、柚皮素-7-葡萄糖苷的生物利用率,结果是柚皮素和柚皮素-7-葡萄糖苷的吸收动力学相似,而柚皮素-7-鼠李葡萄糖苷的生物利用率明显下降,可能是因为其在小肠内积累而不易被消化。Wiczkowski等[13]用香葱槲皮素和槲皮素葡萄糖苷做人体实验,结果显示,槲皮素的生物利用率是槲皮素葡萄糖苷的2~3倍。也有资料显示,带有二糖(如芸香糖)或三糖的花青素和儿茶素多聚体大多数不能被代谢掉,而是通过尿液直接被排泄出来[14-15]。
通过去糖基化可以对黄酮苷进行结构修饰,进而改变其生物活性。目前,去糖基的方法主要有化学法(主要为酸碱水解法)和酶法。
2.1 化学法去糖基
李珊珊等[16]用固体酸催化水解糖苷型大豆异黄酮,并研究了温度、进料配比以及接触时间对游离型异黄酮转化率的影响。结果表明:当溶剂与原料比为1:11(m/V)左右、甲醇与水的体积比为1:2、温度在60~70℃时,通过固定床两次水解,糖苷型异黄酮转化率可达90%。刘亚男等[17]以盐酸为催化剂,对蜂胶黄酮苷进行酸解实验。结果表明,酸水解方法可以有效地将蜂胶黄酮苷水解为黄酮苷元,其中芦丁水解转化率达59.1%,山奈酚、异鼠李素含量增至酸解前的2~4倍,酸解产物清除DPPH自由基的能力和对猪油的抗氧化作用均有明显提高。冯艳丽等[18]先用碱后用酸两步水解大豆异黄酮,促使丙二酰基异黄酮转变成葡萄糖苷型异黄酮,结果显示,大豆异黄酮中以染料木黄酮计的异黄酮总含量由287.09μg/g提高到532.76μg/g。Grohmann等[19]用稀硫酸水解橙皮苷水悬浮液得到橙皮素-7-葡萄糖苷。方法是:在25~180℃的温度范围内,用稀硫酸催化水解橙皮苷水悬浮液。当温度达到120℃或更高时,反应急剧加速,原因可能是高温使橙皮苷水溶性增加。然后用无水丙酮或低级醇从橙皮苷水解物中提取出了橙皮素-7-葡萄糖苷。
化学法选择性差,反应不易控制,加之需要高温高压,反应产物为多种物质的混合物,给后续分离带来极大的困难,同时排出大量的废液,给环境造成极大的污染。
2.2 酶法去糖基
Nielsen等[20]用橙皮苷酶处理含橙皮苷(橙皮素鼠李葡萄糖苷)的柑橘汁,并将这种柑橘汁与天然柑橘汁、强化果汁(橙皮苷含量是天然柑橘汁的3倍)在人体中做了随机双盲对照交叉实验。结果发现,柑橘汁经橙皮苷酶处理后,橙皮苷脱掉了一个鼠李糖转变成橙皮素-7-葡萄糖苷,人体摄入该果汁后,血浆中橙皮素的最大浓度比摄入天然柑橘汁的人群高4倍,比摄入强化果汁的人群高1.5倍,达到最大浓度的时间分别是(0.6±0.1)、(7.0±3.0)、(7.4±2.0)h(P<0.0001)。因此,去糖基作用可以提高橙苷皮苷的生物活性。
Mandalari等[21]用果胶酶L62和纤维素酶CO13P酶解佛手柑果皮中的低分子质量黄酮类物质。方法是:在50mmol/L乙酸钠缓冲溶液(pH5.0)中加入酶和底物,100r/min搅拌反应24h,HPLC分析黄酮糖苷和黄酮苷元。结果显示,果胶酶既有α-鼠李糖苷酶活性,又有β-葡萄糖苷酶的活性,能够分步依次除去鼠李糖基和葡萄糖基,但不能直接除去鼠李糖-葡萄糖聚合而成的芸香糖;果胶酶能够很好的水解黄烷酮糖苷(如橙皮苷),但水解黄酮醇糖苷(如芦丁)的能力相对弱些;纤维素酶CO13P单独使用时对黄酮苷没有脱糖基作用,但将这两种酶复合使用时,高达90%的黄酮糖苷被水解成其苷元。
Chuankhayan等[22]从交趾黄檀(D. cochinchinensis)和藓黄檀(D. nigrescens)中提取出β-葡萄糖苷酶,并用这两种不同来源的酶酶解大豆异黄酮,酶解产物用反向-高效液相色谱(RP-HPLC)和薄层色谱(TLC)法分析。结果,藓黄檀β-葡萄糖苷酶能比交趾黄檀β-葡萄糖苷酶更快地水解结合型和非结合型的异黄酮糖苷。反应16h后,60%的丙二酰大豆苷以及全部的大豆苷、黄豆黄苷、染料木苷、乙酰基大豆苷、乙酰基染料木苷、丙二酰染料木苷被藓黄檀β-葡萄糖苷酶水解。Turner等[23]同样用β-葡萄糖苷酶水解洋葱废弃物中的黄酮糖苷,经LC-MS/MS分析,槲皮素含量明显提高。另外,有一种黄酮苷——鱼藤黄酮糖苷几乎没有毒性,但是当鱼藤黄酮糖苷和β-葡萄糖苷酶同时存在时,对害虫有明显毒性,可能是β-葡萄糖苷酶将鱼藤黄酮糖苷水解成了鱼藤黄酮苷元[24]。
张红城等[25]用β-葡萄糖苷酶酶解蜂胶黄酮苷,经HPLC分析,酶解产物中杨梅黄酮、槲皮素、芹菜素、松属素等黄酮苷元的含量明显提高,并且酶解产物的还原力、清除DPPH自由基和·OH的能力也显著增强。
Park等[26]发现绿茶种子里含有两种莰菲醇糖苷——莰菲醇-3-O-[2-O-β-D-半乳糖-6-O-α-L-吡喃鼠李糖]-β-D-吡喃葡萄糖苷和莰菲醇-3-O-[2-O-β-D-吡喃木糖-6-O-α-L-吡喃鼠李糖]-β-D-吡喃葡萄糖苷,并使用β-半乳糖苷酶和橙皮苷酶联合水解这两种黄酮苷,得到纯度高达95%的莰菲醇。然后比较了莰菲醇及其这两种糖苷的抗氧化作用,发现莰菲醇比这两种糖苷能够更有效地清除1,1-二苯基-2-苦基苯肼(DPPH)自由基和抑制黄嘌呤氧化酶。莰菲醇清除DPPH自由基和抑制黄嘌呤氧化酶的IC50分别为(59.2±1.7)、(108.7±9.4)μmol/L。这两种糖苷清除DPPH自由基的IC50均大于1000μmol/L,抑制黄嘌呤氧化酶的IC50分别是(337.7±18.0)μmol/L和(223.4± 3.3)μmol/L。
值得注意的是,黄酮糖苷及其苷元的生物利用率目前仍存在着不同说法。Zubik等[27]研究了大豆异黄酮苷元和异黄酮葡萄糖苷的片剂在有着典型美国饮食习惯的美国女性中的吸收率,发现没有明显差别。Richelle等[28]用β-葡萄糖苷酶水解异黄酮,并用水解产物对6个绝经的欧洲妇女做人体实验。结果发现,将异黄酮苷水解成苷元并没有明显提高其在人体中的生物利用率。Morand等[29]和Hollman等[30]的实验结果是,槲皮素葡萄糖糖苷在大鼠中的吸收率比槲皮素和槲皮素芸香糖苷的都高。Setchell等[31]发现,尽管大豆黄素和染料木素苷元在血浆中的保留时间比其糖苷的短,但是,根据它们的血浆浓度曲线下面积(AUC)可以断定,糖苷形式的生理活性比苷元形式的高,可能是糖苷上连接的糖基能够作为保护基团,阻止了异黄酮的生物降解。但根据Izumi等[32]的报道,染料木素和大豆黄素在日本人体中以苷元形式被吸收时,生理活性比糖苷形式的都明显要高。之所以出现这种研究的差异,究其原因,可能是受试人体的种族背景、饮食习惯、肠道微生物菌群、食品基质、摄入剂量以及受试人群的数量都不相同。因此黄酮苷元和黄酮苷在不同的研究中,表现出来的不同生理活性。
总之,酶法结构修饰专一性强,反应条件也比较温和,不需要基团保护,可以定向地断开黄酮类物质的糖苷键,是一种非常好的黄酮类化合物的改性方法。
3 黄酮类化合物的酰化修饰
黄酮类化合物既可以与脂肪酸、芳香酸直接发生酯化反应,也可以与脂肪酸和芳香酸形成的乙烯酯发生酯交换反应,从而达到酰化修饰的目的。研究表明酰化修饰后,黄酮类化合物的脂溶性明显提高,并能促进脂肪及类脂代谢。目前,酰化修饰黄酮类物质最普遍的方法是酶法,主要使用的酶是南极假丝酵母(Candida antarctica)脂肪酶和枯草杆菌蛋白酶,酰化部位主要是黄酮糖苷上的糖基的伯羟基。
Stevenson等[33]用南极假丝酵母脂肪酶B(Novozym 435)为催化剂,羧酸为酰基供体,2-甲基-2-异丙醇为溶剂,直接酰化从水果中提取纯化的黄酮苷物质。所用酰基供体有硬脂酸、肉桂酸、苯丙酸及其羟基衍生物,酰基化率根据酰基供体的不同,在25%~95%的范围内波动,并且脂肪酶B对糖基上连有脂肪族伯羟基的糖苷(如柚皮素-7-鼠李葡萄糖苷)表现出高度的选择性。反应物中,只有柚皮苷和异槲皮素能够发生酰基化反应。尤其是在软脂酸存在下,酰基化作用能够大大提高黄酮苷在反应溶剂中的脂溶性和水溶性。
Ardhaoui等[34]也用南极假丝酵母脂肪酶在叔戊醇中合成了芦丁和七叶灵的芳香酯和脂肪酯,并研究了芳香酸和脂肪酸对酯化反应的影响。脂肪酸中,棕榈酸的初始速率最大,可能是因为其疏水性比十六烷二酸和16-羟基十六烷酸的高。对芳香酸而言,只有带有芳香亚基的(如肉桂酸、氢化肉桂酸、3,4-二羟基氢化肉桂酸和4-羟基苯乙酸)才可以发生酰化反应,而且芳香环的侧链和取代类型对反应也有很大影响。除了氢化肉桂酸外,其他酸与芦丁和七叶灵的初始反应速率都较低,产物转化率不高。因为氢化肉桂酸的侧链是饱和的,静电效应和位阻效应显著减小。然而,肉桂酸由于双键的存在,苯环静电相互作用仍然存在,而且这种不饱和键使得分子不能灵活变化,转化率和初始速率也较低。但不论使用何种酰基供体,七叶灵的转化产率和初始速度都比芦丁的高,因为芦丁是芸香糖苷,没有伯醇羟基,而七叶灵是葡萄糖苷,有伯醇羟基,这与Stevenson等[33]的研究相吻合。
Gayot等[35]也用南极假丝酵母脂肪酶催化柚皮苷和棕榈酸形成了6′-O-棕榈酸柚皮苷酯,溶剂为2-甲基-2-丁醇,酯化部位在柚皮苷的葡萄糖基的伯羟基上。在该酯化反应中,水分含量是反应的关键。反应前2-甲基-2-丁醇和柚皮苷如果被干燥的话,转化率可以提高63%。但是,酶不能被干燥脱水,因为水对蛋白质的三维结构是必不可少的,如果水失去,酶就会失活67%。由于酯合成过程中也会产生水,影响了反应进行的程度,因此反应24h后,可以在反应体系中加入100g/L的分子筛4A吸收这些水分,55h后,转化率达到43%。
Mellou等[36-37]同样利用南极假丝酵母脂肪酶B为催化剂,制备出了黄酮糖苷的酰化衍生物。他们在丙酮溶剂中先后以月桂酸乙烯酯和不饱和脂肪酸为酰基供体,合成了金圣草黄素糖苷衍生物和柚皮苷、芦丁衍生物。金圣草黄素糖苷连接酰基的位点是其糖基的伯羟基即C6′′羟基;柚皮苷和芦丁的酰化位点分别是其糖基的C6′′羟基和C3′′羟基。金圣草黄素糖苷上引入酰基后,其体外对低密度脂蛋白和血清的抗氧化性明显提高。油酸(十八碳不饱和脂肪酸)为酰基供体时,柚皮苷和芦丁的转化率分别是85%和70%。游离不饱和脂肪酸的性质对芦丁的转化率影响很小,与亚油酸直接酯化芦丁相比,游离不饱和脂肪酸乙酯和亚油酸乙酯与这两种黄酮苷的酯交换反应产物较少,转化率只有50%。另外,柚皮苷和芦丁及其酯类是一种肿瘤诱导的血管生成的主要调节体,它们调节血管内皮生长因子(VEGF)分泌的能力已经在K562淋巴母细胞瘤内被测定出来,结果表明芦丁和单个脂肪酸合成的酯能够更有效的减少K562细胞中VEGF的释放,这也说明它们的抗血管收缩和抗肿瘤特性更强。
Katasoura等[38]研究了不同反应参数在离子液体中对脂肪酶选择性酰化黄酮糖苷的影响。在以咪唑为基础的离子液体(1-丁基-3-甲基咪唑四氟硼酸(BF4)和1-丁基-3-甲基咪唑六氟硼酸(PF6))中,产物转化率、区域选择性和反应速率受多种因素的影响,包括所用的离子液体的类型、离子液体中的水分含量、反应温度以及底物的浓度和溶解度。对大多数葡萄糖苷而言,酰化位点都是在葡萄糖基的伯醇羟基上。在BF4中,酰化反应速率和反应的区域选择性都较高,生成的葡萄糖苷的溶解度都显著高于在PF6和丙酮中生成的葡萄糖苷。
Calis等[39]分别将鼠李素糖苷B,C和芦丁溶于无水吡啶中,然后加入酰基供体三氟乙基丁酯和三氟乙基肉桂酸,最后加入枯草杆菌蛋白酶催化酰化反应。结果显示,该酶催化酰化反应具有良好的选择性,黄酮苷上的葡萄糖基比半乳糖基更容易发生酰化反应,芦丁的酰化产物比鼠李糖苷B,C的稍高。而且,该酶催化黄酮三糖苷发生酰化反应的能力较低,可能是黄酮三糖苷上的糖基较多,增大了空间位阻作用。
资料显示,所有的脂肪酶和枯草杆菌蛋白酶都可以催化黄酮糖苷的酰化反应。然而,对黄酮苷元而言,酰化作用只有在假单胞菌脂肪酶和羧基酯酶同时存在时才能发生[40]。酰化反应能够得到一些单酯和二酯。酰化反应的位置取决于酶的种类,但对特定的酶而言,酰化反应的位点受黄酮化合物和酰基供体结构的影响。黄酮类化合物的结构与酰基供体的理化性质对酰化产物的转化率和初始反应速度都有很大影响[41]。
4 其他方面的结构修饰
程新丽[42]以芹菜素和白杨素为底物,将其溶于NaOH水溶液中,然后加入丙酮,边剧烈搅拌边逐滴加入硫酸二甲酯,合成了7-甲氧基/乙氧基、4′-甲氧基、7,4′-二甲氧基/二乙氧基衍生物,然后再以二甲氧基衍生物为底物,加入浓硫酸和饱和氯化钠溶液,合成了二甲氧基磺酸钠,结构表征方法是1H-NMR和X射线单晶衍射法。
汪秋安等[43]用化学方法合成的7,8-二氧五环黄酮和7,8-二氧六环黄酮。方法是:以干丙酮为溶剂,7,8-二羟基黄酮、二溴甲烷和二溴乙烷为底物,磁力搅拌下加入无水K2CO3,加热至回流。反应结束后,减压旋转蒸发除去溶剂,柱层析分离残留物,核磁共振光谱鉴定Rf值为0.75的组分的结构。
闰炳双等[44]利用黄酮类化合物有较强的抑制血小板聚集的活性和1-烷基取代咪唑类衍生物具有对血栓素A2(TXA2)合成酶较强的抑制作用,将咪唑基引入到黄酮的7-OH上,期望得到血栓素A2(TXA2)合成酶的抑制剂或对环氧化酶及血栓素A2(TXA2)合成酶均有抑制作用的先导化合物。同时,他们还根据药物的拼合原理合成了7-乙酰水杨酰氧基黄酮[45]。
Uyama[46]通过漆酶催化儿茶素发生氧化偶联反应,制备出了儿茶素多聚体,并研究了儿茶素多聚体和儿茶素的生化特性,发现儿茶素多聚体清除超氧阴离子的能力、抑制黄嘌呤氧化酶的能力明显高于儿茶素,而且儿茶素多聚体抑制黄嘌呤氧化酶的能力高于商业上用的别嘌呤醇。此外,儿茶素通过酶促氧化偶联反应能够提高对尿激酶和透明质酸酶的抑制作用。
5 展 望
黄酮类化合物对人类具有极其重要的医疗保健功效,对其改性的研究具有十分重要的理论价值和应用价值。现代分析技术的发展为深入研究黄酮类物质改性产物的种类、含量、成分鉴定及其生物利用率提供了有效手段。同时,对改性中相关酶及其酶学性质的研究,可加深对酶定向改性机制的理解。不同类型酶的底物存在较大差异,筛选合适的酶增大底物改性效率,寻找更加高效、环保、经济的改性方法,对天然黄酮类化合物进行改性并研究其生物利用率的变化也是未来研究的一个方向。
[1]WOLFE K L, LIU Ruihai. Structure-activity relationships of flavonoids in the cellular antioxidant activity assay[J]. Journal of Agricultural and Food Chemistry, 2008, 56(18): 8404-8411.
[2]SUZUKI Y, SUZUKI K. Enzymatic formation of 4G-alpha-D-glucopyranosyl-rutin[J]. Agricultural Biology and Chemistry, 1991, 55 (1): 181-187.
[3]KO J H, KIM B G, AHN J H. Glycosylation of flavonoids with a glycosyltransferase from Bacillus cereus[J]. Federation of European Microbiological Societies Microbiology Letters, 2006, 258(2): 263-268.
[4]KIM H J, KIM B G, KIM G A, et al. Glycosylation of flavonoids with E. coli expressing glycosyltransferase from Xanthomonas campestris[J]. Journal of Microbiology and Biotechnology, 2007, 17(3): 539-542.
[5]XIAO Jianbo, CAO Hui, WANG Yuanfeng, et al. Glycosylation of dietary flavonoids decreases the affinities for plasma protein[J]. Journal of Agricultural and Food Chemistry, 2009, 57(15): 6642-6648.
[6]STEVENSON D E, COONEY J M, JENSEN D J, et al. Comparison of enzymically glucuronidated flavonoids with flavonoid aglycones in an in vitro cellular model of oxidative stress protection[J]. in vitro Cellular and Developmental Biology-Animal, 2008, 44(3/4): 73-80.
[7]DU Yegang, CHU Hung, CHU I K, et al. CYP93G2 is a flavanone 2-hydroxylase required for C-glycosylflavone biosynthesis in rice[J]. Plant Physiol, 2010, 154(1): 324-333.
[8]CAO Hui, WU Donghui, WANG Hongxian, et al. Effect of the glycosylation of flavonoids on interaction with protein[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2009, 73(5): 972-975.
[9]吴立军, 吴继洲. 天然药物化学[M]. 北京: 人民卫生出版社, 2005: 173-174.
[10]JACOBS M, RUBERY P H. Naturally occurring auxin transport regulators[J]. Science, 1988, 241(4863): 346-349.
[11]RATTY K, DAS N P. Effects of flavonoids on nonenzymic lipid peroxidation: Structure activity relationship[J]. Biochemical Medicine and Metabolic Biology, 1988, 39(1): 69-79.
[12]FELGINES C, TEXIER O, MORAND C, et al. Bioavailability of the flavanone naringenin and its glycosides in rats[J]. American Journal of Physiology-Gastrointestinal and Liver Physiology, 2000, 279(6): 1148-1154.
[13]WICZKOWSKI W, ROMASZKO J, BUCINSKI A, et al. Quercetin from shallots (Allium cepa L. var. aggregatum) is more bioavailable than its glucosides[J]. Journal of Nutrition, 2008, 138(5): 885-888.
[14]WU Xianli, PITTMAN H E, MCKAY S, et al. Aglycones and sugar moieties alter anthocyanin absorption and metabolism after berry consumption in weanling pigs[J]. Journal of Nutrition, 2005, 135(10): 2417-2724.
[15]GONTHIER M P, DONOAN J L, TEXIER O, et al. Metabolism of dietary procyanidins in rats[J]. Free Radical Biological and Medicine, 2003, 35(8): 837-844.
[16]李珊珊, 吴彩娟, 苏宝根, 等. 固体酸催化水解糖苷型大豆异黄酮[J].中国油脂, 2004, 29(9): 28-30.
[17]刘亚男, 程艳华, 胡福良, 等. 蜂胶黄酮苷的酸解及酸解产物抗氧化性能的研究[J]. 食品科学, 2009, 30(3): 47-50.
[18]冯艳丽, 员明月, 夏艳. 碱法水解大豆异黄酮工艺研究[J]. 中国油脂, 2009, 34(4): 56-58.
[19]GROHMANN K, MANTHEY J A, CAMERCON R G. Acid-catalyzed hydrolysis of hesperidin at elevated temperatures[J]. Carbohydrate Research, 2000, 328(2): 141-146.
[20]NIELSEN I L, CHEE W S S, POULSEN L, et al. Bioavailability is improved by enzymatic modification of the citrus flavonoid hesperidin in humans: a randomized, double-blind, crossover trial[J]. Journal of Nutrition, 2006, 136(2): 404-408.
[21]MANDALARI G, BENNETT R N, KIRBY A R, et al. Enzymatic hydrolysis of flavonoids and pectic oligosaccharides from bergamot (Citrus bergamia Risso) peel[J]. Journal of Agricultural and Food Chemistry, 2006, 54(21): 8307-8713.
[22]CHUANKHAYAN P, RIMLUMDUAN T, SVASTI J, et al. Hydrolysis of soybean isoflavonoid glycosides by Dalbergia beta-glucosidases[J]. Journal of Agricultural and Food Chemistry, 2007, 55(6): 2407-2412. [23]TURNER C, TURNER P, JACOBSON G, et al. Subcritical water extraction and β-glucosidase-catalyzed hydrolysis of quercetin glycosides in onion waste[J]. Green Chemistry, 2006, 8(11): 949-959.
[24]SVASTI M R, SRISOMSAP C, SURARIT R, et al. Characterization of a novel rotenoid-β-glucosidase enzyme and its natural substrate from Thai rosewood[J]. Pure and Applied Chemistry, 1998, 70(11): 21-24.
[25]张红城, 董捷, 李春阳, 等. β-葡萄糖苷酶酶解蜂胶黄酮苷的研究[J]. 食品科学, 2008, 29(11): 332-336.
[26]PARK J S, RHO H S, KIM D H, et al. Enzymatic preparation of kaempferol from green tea seed and its antioxidant activity[J]. Journal of Agricultural and Food Chemistry, 2006, 54(8): 2951-2956.
[27]ZUBIK L M, MEYDANI M. Bioavailability of soybean isoflavones from aglycone and glucoside forms in American women[J]. American Journal of Clinical Nutrition, 2003, 77(6): 1459-1465.
[28]RICHELLE M, SYLVIE P M, STEFAN B, et al. Hydrolysis of isoflavone glycosides to aglycones by beta-glycosidase does not alter plasma and urine isoflavone pharmacokinetics in postmenopausal women[J]. Journal of Nutrition, 2002, 132(9): 2587-2592.
[29]MORAND C, MANACH C, BESSON C, et al. Respective bioavailability of quercetin aglycone and its glycosides in a rat model[J]. Biofactors, 2000, 12(1/4): 169-174.
[30]HOLLMAN P C, VARIES J H, van LEEUWEN S D, et al. Absorption of dietary quercetin glycosides and quercetin in healthy ileostomy volunteers[J]. American Journal of Clinical Nutrition, 1995, 62(6): 1276-1282.
[31]SETCHELL K D, BROWN N M, DESAI P. Bioavailability of pure isoflavones in healthy humans and analysis of commercial soy isoflavone supplements[J]. Journal of Nutrition, 2001, 131(4): 1362S-1375S.
[32]IZUMI T, PISKULA M K, OSAWA S, et al. Soy isoflavone aglycones are absorbed faster and in higher amounts than their glucosides in humans [J]. Journal of Nutrition, 2000, 130(7): 1695-1699.
[33]STEVENSON D E, WIBISONO R, JENSEN D J, et al. Direct acylation of favonoid glycosides with phenolic acids catalysed by Candida antarctica lipase B (Novozym435)[J]. Enzyme and Microbial Technology, 2006, 39(6): 1236-1241.
[34]ARDHAOUI M, FALCIMAIGNE A, ENGASSER J M, et al. Enzymatic synthesis of new aromatic and aliphatic esters of flavonoids using Candida antarctica lipase as biocatalyst[J]. 2004, 22(4): 253-259.
[35]GAYOT S, SANTARELLIS D, COULON D. Modification of flavonoid using lipase in non-conventional media: effect of the water content[J]. Journal of Biotechnology, 2002, 101(1): 29-36.
[36]MELLOU F, LAZARI D, SKALTSA H, et al. Biocatalytic preparation of acylated derivatives of flavonoid glycosides enhances their antioxidant and antimicrobial activity[J]. Journal of Biotechnology, 2005, 116(3): 295-304.
[37]MELLOU F, LOUTRARI H, STAMATIS H, et al. Enzymatic esterification of flavonoids with unsaturated fatty acids: Effect of the novel esters on vascular endothelial growth factor release from K562 cells[J]. Process Biochemistry, 2006, 41(9): 2029-2034.
[38]KATASOURA M H, POLYDERA A C, KATAPODIS P, et al. Effect of different reaction parameters on the lipase-catalyzed selective acylation of polyhydroxylated natural compounds in ionic liquids[J]. Process Biochemistry, 2007, 42(9): 1326-1334.
[39]CALIS I, PZIPEK M, ERTAN M, et al. Enzyme-mediated regioselective acylations of flavonoid glycosides[J]. Journal of Pharmaceutical Science, 1995, 20: 50-59.
[40]CHEBIL L, HUMEAU C, FALCIMAIGNE A, et al. Enzymatic acylation of flavonoids[J]. Process Biochemistry, 2006, 41: 2237-2251.
[41]CHEBIL L, ANTHONI J, HUMEAU C, et al. Enzymatic acylation of flavonoids: effect of the nature of the substrate, origin of lipase, and operating conditions on conversion yield and regioselectivity[J]. Journal of Agricultural and Food Chemistry, 2007, 55(23): 9496-9502.
[42]程新丽. 黄酮类化合物磺化反应及其衍生物晶体结构研究[D]. 西安:陕西师范大学, 2006.
[43]汪秋安, 廖头根, 汤建国. 7-羟基黄酮和7,8-二羟基黄酮的改良合成与结构修饰[J]. 湖南大学学报: 自然科学版, 2004, 31(5): 1-4.
[44]闫炳双, 孙铁民, 武振卿, 等. 7-(1-咪唑)-烷氧基黄酮衍生物的合成[J]. 中国药物化学杂志, 1995, 5(1): 44-48.
[45]闫炳双, 孙铁民, 武振卿. 7-乙酰水杨酰氧基黄酮衍生物的合成[J].中国药物化学杂志, 1994, 4(1): 36-40.
[46]UYAMA, H. Polymeric flavonoids: enzymatic synthesis and applications [C]//S Inaugural Symposium on Enzymes and Biocatalysis-2010, Shanghai, China, April 22-24, 2010.
Research Progress on Modification Methods for Flavonoids
ZHANG Hong-cheng1,WU Zheng-shuang2,GAO Wen-hong2,DONG Jie1,*
(1. Bee Research Institute, Chinese Academy of Agricultural Science, Beijing 100093, China;2. College of Light Industry and Food Sciences, South China University of Technology, Guangzhou 510641, China)
Flavonoids, a type of phytochemicals, have been extensively applied to treat and inhabit disease and medically functional disorders as healers, antimicrobial agents, as well as antioxidants. However, their poor water solubility and lipid solubility limit their application. In the present review, multiple methods for modification of flavonids, including glycosylation, deglycosylation, acylation, and methylation, as well as the change of their bioavailability before and after modification are introduced.
flavoniods;modification methods;biological activity
TS201.4
A
1002-6630(2011)03-0256-06
2010-05-07
国家现代农业(蜂)产业技术体系资助项目(NYCYTX-43);国家公益性行业(农业)科研专项经费项目(nyhyzx07-041)
张红城(1967—),男,副研究员,博士,研究方向为食品生物技术。E-mail:zzhc@sohu.com
*通信作者:董捷(1966—),女,研究员,硕士,主要从事功能食品与生物活性物质的研究。E-mail:jiedon@126.com

