曲酸遗传毒性的研究
陈永红,黄夏宁,邹志飞,谷康定,王 岚,刘慧智
曲酸遗传毒性的研究
陈永红1,黄夏宁2,邹志飞1,谷康定2,王 岚1,刘慧智1
(1.广东检验检疫技术中心,广东 广州 510623;2.华中科技大学同济医学院公共卫生学院,湖北 武汉 430030)
目的:研究曲酸遗传毒性及有关作用机制。 方法:采用小鼠骨髓细胞微核实验检测染色体损伤。用不同质量浓度曲酸(0、500、1000、1500、2000、2500μg/mL)诱导CHO-K1细胞,单细胞凝胶电泳实验检测CHO-K1细胞DNA损伤。 结果:1/2 LD50、1/4 LD50和1/8 LD50不同剂量曲酸诱导昆明小鼠微核实验结果显示,各质量浓度受试组与阴性对照组差别无显著性。单细胞凝胶电泳结果显示:曲酸作用质量浓度为 1000μg/mL,作用时间为6h时,即出现轻微DNA损伤;当曲酸作用质量浓度增大到2500μg/mL时,出现明显的DNA损伤。在24h内,或其他同一作用时间段,随着曲酸作用质量浓度增加,DNA损伤也呈增加趋势。实验未发现有明显的时间-效应关系。结论:体内小鼠骨髓细胞微核实验未观察到曲酸明显的遗传毒性,但体外实验高质量浓度曲酸在一定时间可导致DNA损伤。
曲酸;传代细胞株;微核实验;单细胞凝胶电泳
曲酸作为一种皮肤增白剂、食品添加剂、抗菌杀虫剂和皮肤病治疗剂,获得广泛应用。最近,有关曲酸可能引起肝脏、甲状腺损害,甚至导致肿瘤发生的实验研究结果,引起了人们的不安[1-4]。国外早期虽然比较详细研究了曲酸的毒性和机制,并认为其相对安全,但是有关最新的遗传毒性、致畸、致癌实验等结果和毒性机制,则动摇了原有的认识。人们对待曲酸的安全性仍然存在很多疑问、混淆和不解之处,有关曲酸毒性机制更深入、更本质的研究从来没有停止。本研究以曲酸为受试物,以昆明种小鼠为体内实验研究对象,CHO-K1细胞为体外实验研究对象,考察曲酸对上述不同生物体系的遗传毒性和可能作用机制,为系统研究曲酸的安全性、阐述其毒性机制提供新的参考。
1 材料与方法
1.1 材料、试剂与仪器
健康SPF昆明小鼠购自华中科技大学同济医学院医学实验动物中心。实验前1周购买并妥善喂养,观察小鼠健康状态;CHO-K1细胞 华中科技大学同济医学院免疫学教研室。
曲酸(kojic acid) 美国Sigma 公司;1640培养基 美国Gibco公司;环磷酰胺 美国Alfa公司。姬姆萨(Giemsa)染料、羧甲基纤维素钠 国药集团化学试剂有限公司;低熔点琼脂糖 美国Promega公司;其他化学试剂均为分析纯。
BX51TF荧光显微镜 日本Olympus公司;DYY6C双稳定时电泳仪 北京六一仪器厂。
1.2 方法
1.2.1 小鼠骨髓细胞微核实验
参照参考文献[5]。取7~12周龄,体质量25~30g小鼠,雌雄各25只。随机分组,每组用两种性别动物至少各5只。受试物设3个剂量组,最高剂量组取1/2 LD50(LD50=5100mg/kg,以体质量计),分别取1/4LD50和1/8LD50,作为中、低剂量组。实验共分为5组:阴性对照组(质量浓度5mg/mL羧甲基纤维素钠)、阳性对照组(6mg/mL 环磷酰胺)、高剂量组(1/2LD50,5mg/mL羧甲基纤维素钠配制127.5mg/mL曲酸溶液)、中剂量组(1/4 LD50,5mg/mL羧甲基纤维素钠配制63.75mg/mL曲酸)、低剂量组(1/8LD50,5mg/mL羧甲基纤维素钠配制31.875mg/mL曲酸)。
各组溶液均按0.2mL/10g灌胃。染毒途径和方式:经口灌胃,采用30h两次给药法,即两次给受试物间隔24h,第二次给受试物后6h取材。取胸骨骨髓涂片、染色、观察计数。
用双盲法阅片。每只小鼠计数1000个嗜多染红细胞,观察含有微核的嗜多染红细胞数,微核率以千分率表示。
观察嗜多染红细胞(PCE)与成熟红细胞(RBC)比值,可作为细胞毒性指标之一。一般计数200个红细胞。
1.2.2 碱性单细胞凝胶电泳
CHO-K1细胞复苏:从液氮罐中取出冻存的CHO-K1细胞,置40℃迅速融化,将细胞液转入离心管加无血清培养基,1000r/min离心2min。去上清液,加入适量10% 1640完全培养基,吹散细胞后计数,按适合密度转入细胞培养瓶,放入37℃细胞培养箱培养4h,然后弃去上清液加入新的完全培养基。
CHO-K1细胞培养:待CHO-K1细胞达到对数生长期时,收获细胞。倒去培养瓶中培养基,3mL D-Hank’s溶液润洗细胞1次,倒去溶液,1mL 0.25%胰酶消化细胞1.5min,倒去溶液,加入10mL 10%血清RPMI 1640完全培养基终止消化,用吸管轻轻将培养瓶壁上的细胞吹下,轻轻吹打混匀,于6孔细胞培养板中接种细胞,至少接种4板。
CHO-K1细胞染毒:细胞在6孔培养板培养24h后,按曲酸终质量浓度为0、500、1000、1500、2000、2500 μg/mL染毒,分别培养6、12、24、48h后投入后续实验。
碱性单细胞凝胶电泳:吸弃6孔细胞培养板原培养液后,用2mL D-Hank’s 润洗细胞,0.25%胰酶分散细胞,每孔加1mL 10%血清1640 培养液终止消化,转移细胞悬液至另一EP管,计数每孔细胞数,保证每管100000个细胞(1mL)。4℃、1400r/min低温离心5min,轻轻移去上清液,重复悬浮、离心一次,再定容为1mL细胞悬液。3层琼脂糖制片,其中取10μL细胞悬液与75μL(0.7%)低熔点琼脂糖混匀铺片,4℃裂解1.5h,4℃解旋20min,电泳25min(25V,300mA),溴乙啶(EB)荧光染色、观察、拍照和分析。每个样本随机选择100个细胞,图片保存后,用CASP彗星图像软件分析结果。
1.2.3 统计方法
使用SPSS统计软件包进行统计分析。微核统计学分析采用Dunnett t检验。
2 结果与分析
2.1 遗传毒性
2.1.1 曲酸诱导小鼠骨髓细胞微核效应
表1为不同剂量曲酸诱导小鼠骨髓细胞微核结果,将阳性对照组、曲酸各受试组与阴性对照组比较,Dunnett法t检验显示,阳性对照组与阴性对照组存在极显著性差异,而1/2LD50、1/4LD50和1/8LD50曲酸各受试组与阴性对照组无显著性差异,雄性1/2LD50组与其他两组曲酸结果比较稍有偏高,但没有明显剂量-反应关系。

表1 曲酸诱导小鼠骨髓细胞微核效果(x±s, n=10)Table 1 Induction of micronuclei in bone marrow of KM mice by kojic acid (x±s, n=10)
2.1.2 嗜多染红细胞与成熟红细胞比值(PCE/RBC)
将各组嗜多染红细胞与成熟红细胞比值(PCE/RBC)进行方差分析,观察其毒性。表2和表3显示各组之间差异无显著性,表明各组小鼠未表现出细胞毒性。

表2 雄性小鼠PCE/RBC比值方差分析Table 2 Variance analysis for the ratio between polychromatic erythrocytes and normochromatic erythrocytes in male mice
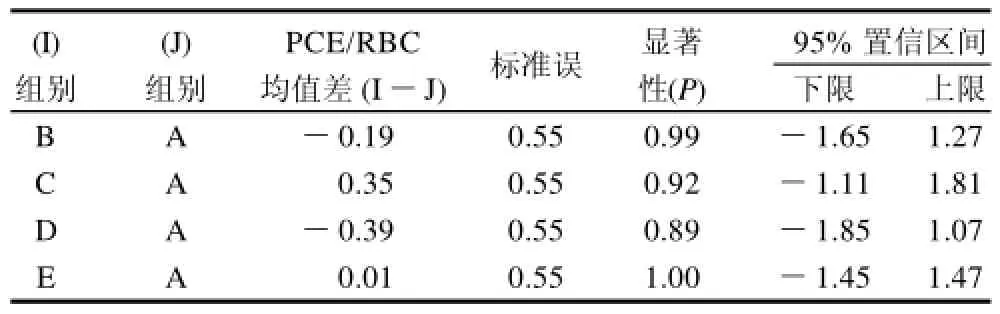
表3 雌性小鼠PCE/RBC比值方差分析Table 3 Variance analysis for the ratio between polychromatic erythrocytes and normochromatic erythrocytes in female mice
2.2 DNA损伤测定结果
不同质量浓度曲酸作用CHO-K1细胞6h后,对受试细胞DNA损伤程度见图1。曲酸质量浓度在1000μg/mL以上与对照组比较,DNA损伤程度逐渐缓慢增加,到2500μg/mL时出现剧烈增加。

图1 曲酸作用CHO-K1细胞6h后细胞DNA损伤情况Fig.1 DNA damage induced by kojic acid in CHO-K1 cells after 6 h incubation
不同质量浓度曲酸作用CHO-K1细胞12h后,对受试细胞DNA损伤程度见图2。曲酸质量浓度在1500μg/mL时与对照组比较,DNA损伤程度略有增加,到2500μg/mL时出现剧烈增加。
不同质量浓度曲酸作用CHO-K1细胞24h后,对受试细胞DNA损伤程度见图3、4。曲酸质量浓度在1500 μg/mL以上与对照组比较,DNA损伤程度开始增加,到2000μg/mL以上出现剧烈增加。
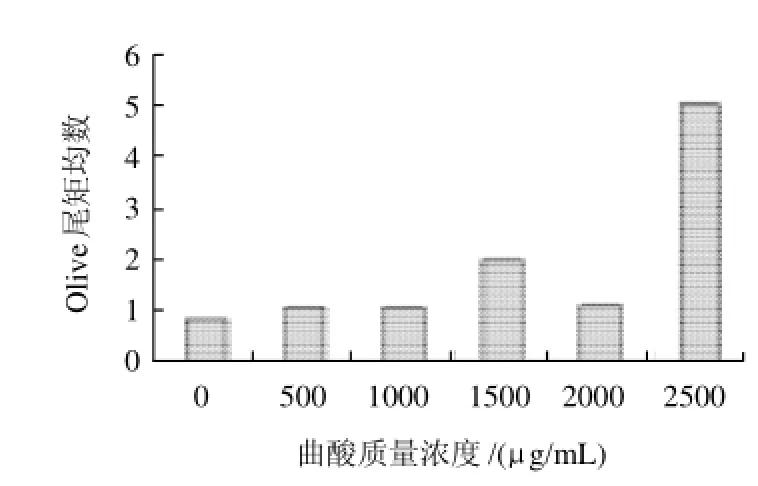
图2 曲酸作用CHO-K1 细胞12h后细胞DNA损伤情况Fig.2 DNA damage induced by kojic acid in CHO-K1 cells after 12 h incubation

图3 曲酸作用CHO-K1细胞24h后细胞DNA损伤情况Fig.3 DNA damage induced by kojic acid in CHO-K1 cells after 24 h incubation

图4 不同质量浓度曲酸作用CHO-K1细胞24h后的电泳图Fig.4 Electrophoretogram of CHO-K1 cells treated by kojic acid in various dosages for 24 h
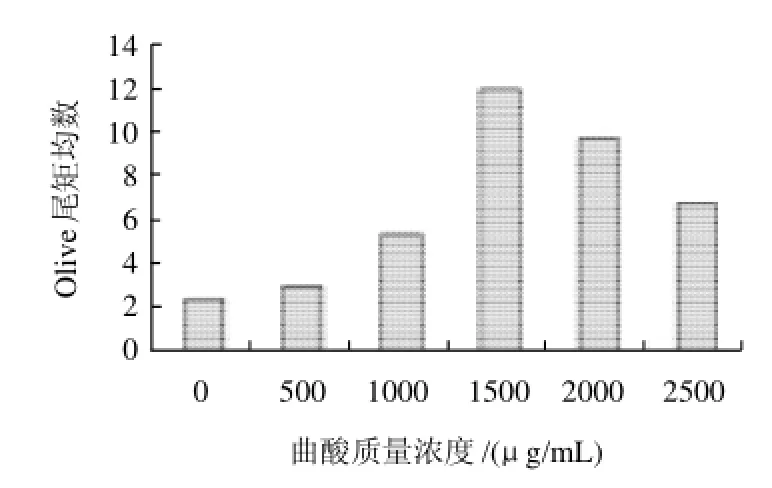
图5 曲酸作用CHO-K1细胞48h后细胞DNA损伤情况Fig.5 DNA damage induced by kojic acid in CHO-K1 cells after 48 h incubation
曲酸作用CHO-K1细胞48h后,对受试细胞DNA损伤程度在1000μg/mL以上与对照组比较,即开始明显增加,到1500μg/mL出现剧烈增加,2000μg/mL和2500μg/mL损伤程度减缓,见图5。
将各质量浓度曲酸作用下的Olive尾矩均数除以空白对照的Olive尾矩均数,得比值,综合反映其关系,结果见图6。曲酸质量浓度为2500μg/mL,作用6h时,DNA损伤变化最大。其他时间变化相对平和。

图6 不同剂量曲酸在不同作用时间导致CHO-K1细胞DNA损伤趋势Fig.6 Dynamic change rates of DNA damage induced by kojic acid in various treatment time and dosages in CHO-K1 cells
3 讨 论
不同剂量曲酸诱导昆明种小鼠微核实验结果显示,各受试质量浓度组与阴性对照组差别无显著性。雄性1/2LD50组与其他两组曲酸结果比较稍有偏高,但没有明显剂量-反应关系。雌性小鼠各剂量组完全没有剂量-反应关系,表明在本研究条件下,未观察到曲酸对小鼠染色体损害。各组嗜多染红细胞与成熟红细胞比值(PCE/ RBC)经方差分析,各组之间差异无显著性,表明各组小鼠未表现出细胞毒性。目前国内尚未见到与本研究相似报道,国外有报道[6-7]曲酸在两套染色体畸变测试中具有致畸变效应,在一次姊妹染色单体交换实验中为阳性。高质量浓度下,曲酸对体外测试系统Hep2G细胞微核致畸效应还不明了。曲酸单剂量或多剂量在一次体内骨髓微核实验中,无染色体致畸作用。在转基因小鼠基因突变测试中也未发现曲酸的致突变性。显性致死实验结果阴性表明曲酸不是生殖细胞致突变剂。唯一体内实验结果阳性的是给药后部分肝切除,用肝细胞进行的微核实验。然而相关阳性结果是非常有限的。以上结果与本研究结果基本吻合,可能曲酸不是一种遗传毒物。阳性组标准差偏高,原因系少数胸骨骨髓涂片微核数较高引起,根据经验判断,它对实验结果的影响不大,如果时间、人力和成本允许,重复考察该阳性物环磷酰胺的结果可能更好。PCE/RBC为评价细胞毒性的指标,受试物各组该比值与阴性对照组比较若有统计学意义表示受试化学物剂量过大,实验结果不可靠。如前所述,本研究各受试组和阳性组经检验与阴性组无统计学差别,也证明本实验结果可靠。本研究不仅考察了曲酸对体内(in vivo)实验对象的影响,还同时考察了曲酸对体外(in vitro)受试对象的作用过程。
彗星实验是目前最为常用的体外检验DNA受损的方法。本研究结果显示曲酸作用质量浓度为1000μg/mL,作用时间为6h时,即出现DNA损伤,但损伤较少,不明显。当曲酸作用质量浓度增大到2500μg/mL,作用时间为6h时,与阴性对照组比较,出现明显的DNA损伤。在24h内,各剂量组随着作用时间的增加,DNA损伤呈增加趋势。同一作用时间段,随着曲酸质量浓度增加,DNA损伤也呈增加趋势。曲酸作用48h,2000μg/mL及2500μg/mL剂量组与阴性对照组Olive尾矩(Olive Tail Moment)平均值之比出现下降趋势。本实验未发现有明显的时间-效应关系。很多研究也已发现,动物在较长时间的毒素体内暴露后,DNA损伤的指标并没有显著升高,甚至呈现降低的趋势。这可能是因为DNA损伤修复系统的激活和酶系统的反作用,或是由于随着暴露时间的延长,DNA断裂程度较高,以致在电泳时断片可能丢失[8]。当然,体内、体外染毒方式的不同,各种动物的细胞对某种毒素的敏感度不同,将引起细胞损伤时间段和修复时间段的不同。国内目前主要是在部分化妆品中发现含有曲酸增白剂,质量浓度低于100μg/mL[9-10],与本实验结果比较,该质量浓度不至于导致DNA断裂。而且曲酸通过皮肤转移到血液的可能性非常小,因此尚不构成明显危害。日本在各类食品中的添加量为0.05%~1%,国内尚未发现在食品中添加曲酸的报道。实验中发现未染毒的对照组的少量细胞也出现了彗星拖尾,这可能是因为离开活体的细胞不可避免地会受到某些非生理条件的不利影响,如光线的照射等,导致了微量DNA在电泳中迁移。彗星图像分析是单细胞凝胶电泳(SCGE)实验不容忽视的一部分,所选分析指标影响SCGE的灵敏性。人工指标易受主观因素干扰,而计算机图像分析如CASP软件[11],可进行精细的荧光强度、尾矩、尾惯量等指标的测定。Olive尾矩(Olive尾矩:从头光密度重心到尾光密度重心的距离与尾部 DNA含量的乘积)能更好地反映DNA损伤的程度。本研究采用Olive尾矩分析不同时间、不同质量浓度曲酸作用下单个细胞的DNA损伤程度,较传统方法优越。
综上所述,本研究体内实验未观察到曲酸明显的遗传毒性,但体外实验高质量浓度曲酸在一定时间可导致DNA损伤,这种差异或者说是矛盾,是否因为DNA损伤在体内获得修复而未表现出来?还是因为体内存在的代谢、转化和结合等代谢途径导致曲酸发生改变,使其不致产生遗传毒性?或其他原因所致?值得深入研究和探讨。
参考文献:
[1]TAKIZAWA T, IMAI T, ONOSE J, et al. Enhancement of hepatocarcinogenesis by kojic acid in rat two-stage models after initiation with N-bis(2-hydroxypropyl)nitrosamine or N-diethylnitrosamine [J]. Toxicological Sciences, 2004, 81: 43-49.
[2]ISHIKAWA S, SASAKI Y F, KAWAGUCHI S, et al. Characterization of genotoxicity of kojic acid by mutagenicity in salmonella and micronucleus induction in rodent liver[J]. Genes and Environment, 2006, 28 (1): 31-37.
[3]WATANABE T, MORI T, KITAMURA Y, et al. Lack of initiating activity of kojic acid on hepatocarcinogenesis in F 344 rats[J]. Toxicol Pathol, 2005, 18: 79-84.
[4]NOHYNEK G J, KIRKLAND D, MARZIN D, et al. An assessment of the genotoxicity and human health risk of topical use of kojic acid [5-hydroxy-2-(hydroxymethyl)-4H-pyran-4-one][J]. Food Chemical Toxicology, 2004, 42: 93-105.
[5]中华人民共和国卫生部. GB 15193.5—2003骨髓细胞微核试验[S].北京: 国家标准化管理委员会, 2003.
[6]LEE Y S, WEI C. Chromosomal aberrations in chinese hamster ovary cells induced by kojic acid[J]. Korean Soc Food Nutr, 1992, 21(4): 454-459.
[7]WEI C I, HUANG T S, FERNANDO S Y, et al. Mutagenicity studies of kojic acid[J]. Toxicol Letters, 1990, 59: 213-220.
[8]VANZELLA T P, MARTINEZ C B R, COLUS I M S. Genotoxic and mutagenic effects of diesel oil water soluble fraction on a neotropical fish species[J]. Mutation Research, 2007, 631: 36-43.
[9]CHENG S L, HUANG L R, SHEU J N, et al. Toxicogenomics of kojic acid on gene expression profiling of a375 human malignant melanoma cells[J]. Biol Pharm Bull, 2006, 29(4): 655-669.
[10]魏芳, 杨明, 郭德华, 等. 进口化妆品曲酸添加情况的调查[J]. 中国国境卫生检疫杂志, 2007, 30(4): 106-108.
[11]KONCA K, LANKOFF A, BANASIK A, et al. A cross-platform public domain PC image-analysis program for the comet assay[J]. Mutat Res, 2003, 534: 15-20.
Genetic Toxicity of Kojic Acid: Its Effects on Mice Mironucleus and DNA Damage in CHO-K1 Cells
CHEN Yong-hong1,HUANG Xia-ning2,ZOU Zhi-fei1,GU Kang-ding2,WANG Lan1,LIU Hui-zhi1
(1. Guangdong Inspection and Quarantine Technology Center, Guangzhou 510623, China;2. School of Public Health, Tongji Medical College, Huazhong University of Science and Technology, Wuhan 430030, China)
Objective: To investigate the genetic toxicity and its mechanisms of kojic acid. Methods: Bone marrow micronucleus test in mice and comet assay in CHO-K1 cells were used to examine DNA damage. KM mice were randomly divided into 5 groups for 5 males and 5 females in each group. The KM mice were administered with kojic acid at doses of 1/2, 1/4, and 1/8 fold LD50 for examining DNA damage. CHO-K1 cells were treated with kojic acid at the concentrations of 0, 500, 1000, 1500, 2000 μ g/mL and 2500μ g/mL for comet assay at 6, 12, 24 h and 48 h, respectively. Results: After treatment with kojic acid, the ratio of micronucleus in mice did not exhibit a significant increase, compared with the negative control. The slight DNA damage in CHO-K1 cells was observed in kojic acid group at the concentration of at 1000μ g/mL after 6 h incubation. Severely DNA damage was also observed when kojic acid concentration was increased to 2500μg/mL. However, no response-time relationship was observed. Conclusion: Kojic acid at the experimental conditions did not result in genetic toxicity in bone marrow cells of treated mice, but could induce DNA damage in vitro at high concentration level.
kojic acid;cell line;micronucleus test;comet assay
R114
A
1002-6630(2011)03-0228-05
2010-06-02
广州市科技计划项目(2007Z3-E0381);广东出入境检验检疫局科技计划项目(2005GDK56)
陈永红(1966—),女,副主任技师,博士,主要从事进出口食品和化妆品的毒理学检验研究。E-mail:chenyh@iqtc.cn

