结合珠蛋白在阿萨希毛孢子菌小鼠皮肤感染中的表达与调控
敖俊红,郝震锋,祝 贺,樊 昕,王文岭,夏志宽,杨蓉娅
• 论 著 •
结合珠蛋白在阿萨希毛孢子菌小鼠皮肤感染中的表达与调控
敖俊红,郝震锋,祝 贺,樊 昕,王文岭,夏志宽,杨蓉娅
目的 探讨结合珠蛋白(haptoglobin,Hp)在阿萨希毛孢子菌皮肤感染过程中的免疫调节作用。方法 80只BALB/c小鼠分为免疫抑制组和非免疫抑制组,两组小鼠皮下均接种3.2× 107cfu/ml的阿萨希毛孢子菌菌悬液,分别于接种后0.5d、1d、3d、5d处死小鼠,取皮损组织,提取总RNA,RT-PCR检测Hp mRNA表达,基因芯片技术研究免疫相关基因差异表达。结果 两组小鼠在第0.5d、1d、3d、5d后皮损组织均扩增出Hp mRNA,其中免疫抑制组皮损组织 Hp mRNA表达水平明显高于非免疫抑制对照组,差异有显著统计学意义(P<0.01)。免疫抑制组感染1d后皮损组织 Hp mRNA表达明显高于0.5d、3d、5d,组间比较均有显著性差异(P<0.01)。筛选出的11条免疫相关差异表达基因中编码结合珠蛋白基因表达上调。结论 结合珠蛋白参与了皮肤阿萨希毛孢子菌感染的过程。
阿萨希毛孢子菌;结合珠蛋白;皮肤;感染
[J Pract Dermatol, 2011, 4(1):5-8]
阿萨希毛孢子菌(Trichosporon asahii, T. asahii)是引起毛孢子菌病的主要病原菌,我们在2000年报道了国内首例播散性毛孢子菌病[1]。近年来,随着细胞毒性化疗、皮质类固醇激素的广泛应用、脏器移植的开展、恶性肿瘤的不断上升,播散性毛孢子菌病的发病率也逐年上升[2]。结合珠蛋白(haptoglobin,Hp)是一种活跃的急性期蛋白,具有结合血红蛋白、抗感染、促进血管生成等作用。此外,结合珠蛋白还具有重要的免疫调节功能[3]。研究发现结合珠蛋白可抑制郎格汉斯细胞(langerhans cells,LC)免疫功能的成熟,可能通过影响LC的功能而参与免疫反应的调节[4,5]。本研究探讨结合珠蛋白在阿萨希毛孢子菌皮肤感染中的作用,了解结合珠蛋白在感染局部的免疫功能。
1 材料和方法
1.1 材料
阿萨希毛孢子菌为笔者所在科室临床分离菌株(AS2.2174)[1],- 80℃保存。雄性BALB/c小鼠80只(军事医学科学院动物实验中心提供),体重20~28g。Trizol总RNA提取试剂盒和Access RT-PCR System试剂盒购自Promega公司;DEPC购自Sigma公司;Hp和β-actin引物由大连TaKaRa公司合成,Hp引物序列如下[6]:上游5′-ACCTTAAAC GAC GAG AAG CAATGG-3′,下游5′-AGC CAG ACA CGT AGC CCA CAC G-3′(482bp)。β-actin引物序列如下:上游5'-GTGGGCCGCTCTAGGCACCAA-3',下游5'-CTC TTTGATGTCACGCACGATTTC-3'(540bp)。芯片杂交试剂盒和探针标记试剂盒购自上海联合基因公司。
1.2 实验方法
1.2.1 免疫抑制和菌悬液制备 80只小鼠随机分为两组,免疫抑制组和非免疫抑制组各40只。免疫抑制组小鼠接种前3天腹腔注射环磷酰胺(CTX)200mg/kg。T.asahii 在沙氏培养基上37℃培养2周,无菌生理盐水冲洗培养基斜面,无菌纱布过滤,调整孢子悬液浓度为3.2×107cfu/ml。
1.2.2 接种和取材 每只小鼠背部两侧备皮,刮除直径2.0cm区域内皮毛,皮下接种0.2ml菌悬液。接种后分别于0.5d、1d、3d、5d,两组分别随机抽取10只小鼠处死,取接种处皮损组织,快速置于液氮预冷的无核酸酶冻存管中,迅速置液氮中保存。
1.2.3 总RNA提取 皮损组织标本在预置液氮的研钵中研碎后,移入离心管中,按Trizol一步法分别提取总RNA,-80℃保存。
1.2.4 RT-PCR 按Access RT-PCR System试剂盒说明进行。反应体积为50μl,包括dNTP 1μl,上游引物及下游引物各1μl,25mM MgSO42μl,AMV反转录酶1μl,Tf1聚合酶1μl,RNA模板1μl,5×PCR缓冲液 10μl,无核酸酶ddH2O 32μl。反应条件为48℃反转录45min;94℃变性30s,60℃退火1min,68℃延伸2min,30个循环;最后68℃延伸7min。RT-PCR产物经1%琼脂糖凝胶电泳,BioRad凝胶成像系统扫描,照像。应用Quantity One软件对目的条带进行密度扫描,以β-actin为内参照,计算各组Hp与β-actin的相对灰度值,即目的基因的面积和密度的乘积与内参照β-actin面积和密度的乘积之比,以此代表Hp mRNA的相对表达值。
1.2.5 基因芯片检测
1.2.5.1 预杂交 芯片和杂交试剂I、II各6μl,分别在95℃双蒸水中水浴2min,将杂交试剂滴加于芯片上,盖上盖玻片后42℃水平放置5h。
1.2.5.2 探针标记 取1.5ml EP 管,加入双蒸水25μl、逆转录引物3μl;免疫抑制组和非免疫抑制组各取总RNA100μg,70℃条件下放置10min,取出后置于冰上。分别加入逆转录缓冲液10μl、DDT10μl、dNTP3μl;在暗室中加入逆转录酶2μl,免疫抑制组标本加荧光标记试剂Cy5-dCTP 3μl,非免疫抑制组标本加荧光标记试剂Cy3-dCTP 3μl,42℃反应2h;加入标记试剂I 4μl,65℃ 放置10min,加入标记试剂II 4μl混匀,避光,真空抽干至50μl;使用DNA纯化柱纯化DNA,加入标记试剂III 8μl,真空抽干。
1.2.5.3 杂交及洗片 将标记探针、杂交试剂和芯片分别于95℃水浴2min后混合,置于42℃杂交15~20h。洗片晾干备扫描。质量控制:在芯片4096条基因中有87条管家基因,并以空白点样液(3个点)、植物基因(8个点)作为阴性对照。非免疫抑制组、免疫抑制组扫描图的平均信号强度与平均背景的比值均不低于3。
1.2.5.4 荧光扫描和数据分析采用Scan array 4000扫描仪扫描,用GenePix Pro3.0图像处理软件分析Cy3、Cy5荧光的强度,对原始数据进行均一化处理后分析。
1.3 统计学处理
应用SPSSl1.0软件对免疫抑制组与非免疫抑制组Hp mRNA相对表达水平进行两样本均数t检验;对免疫抑制组与非免疫抑制组感染后0.5d、1d、3d、5d组间的Hp mRNA相对表达水平进行最小显著差(LSD)t检验,显著性检验水准为α=0.01。
2 结果
2.1 提取总RNA PCR扩增结果
所有标本所得总RNA经甲酰胺变性凝胶电泳分析可见清晰的28S和16S 两条完整的条带,28S的亮度大约是16S的2倍(图1),测定A260/A280值介于1.8~2.0之间,表明RNA完整性及纯度均较好,可以满足下游实验需要。
2.2 Hp mRNA表达水平及其与感染时间的关系
经PCR扩增后,免疫抑制组和非免疫抑制组皮损均于482bp处扩增出一条有意义条带(图2)。用Quantity One软件对凝胶上的目的条带进行密度扫描,并求得Hp与β-actin的相对灰度值。免疫抑制组和非免疫抑制组Hp mRNA相对表达水平经两样本均数t检验,差异具有统计学意义(t =8.97,P<0.01),表明免疫抑制组Hp mRNA表达水平高于非免疫抑制组。对免疫抑制组不同感染时间Hp mRNA相对表达水平进行最小显著差(LSD)t检验分析,感染1d后Hp mRNA相对表达水平明显感染第0.5d、3d、5d,组间差异均具有统计学意义(P<0.05),而感染第0.5d、3d、5d 的Hp mRNA表达水平无明显差异(P>0.05),非免疫抑制组不同感染时间Hp mRNA相对表达水平无明显差异(P>0.05)(表1)。
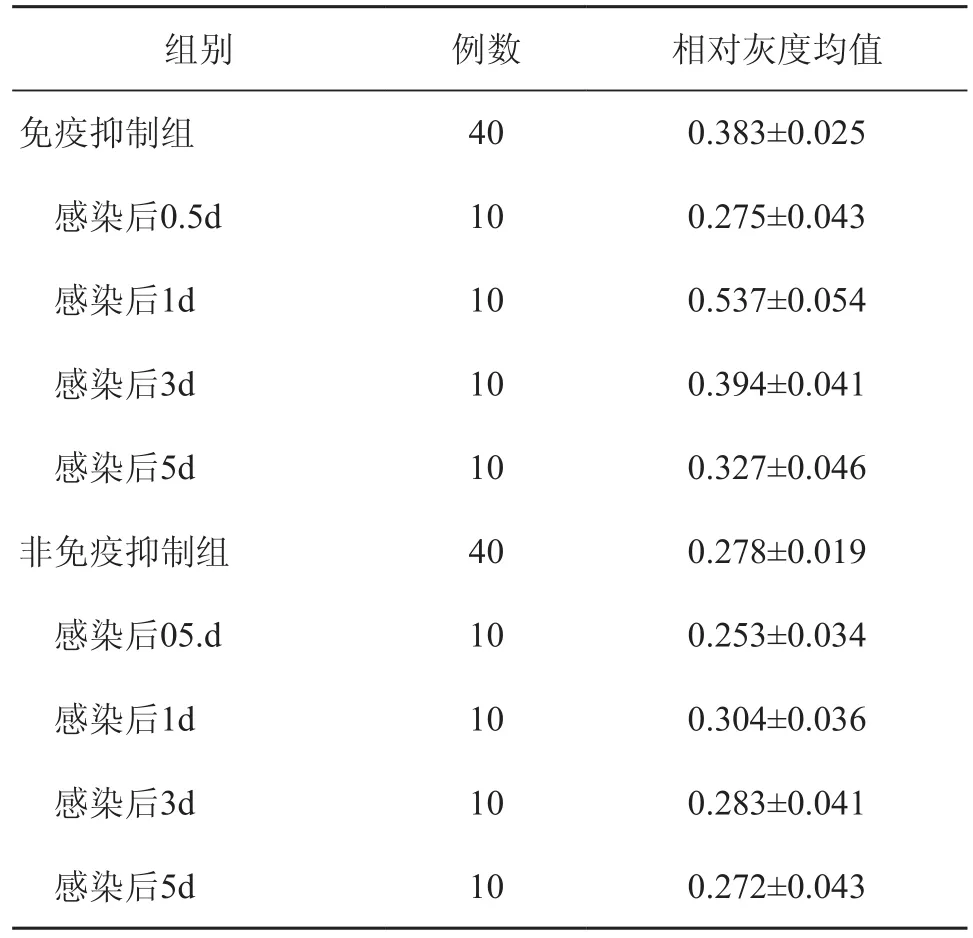
表1 免疫抑制组与非免疫抑制组小鼠皮肤T. asahi感染后Hp mRNA相对灰度值
2.3 基因芯片
免疫抑制组和非免疫抑制组80个标本均筛选出11条免疫相关差异表达基因,与非免疫抑制组比较,免疫抑制组皮损标本中编码结合珠蛋白基因表达上调,编码补体C2基因、TNF诱导蛋白基因、干扰素诱导蛋白基因、CD53、CD22、CD209a抗原及CD79A结合蛋白1b基因、淋巴细胞抗原116及淋巴细胞抗原6复合物基因、前列腺素E受体4基因等表达下调(图3)。

图1 总RNA甲酰胺变性凝胶电泳

图2 免疫抑制组和非免疫抑制组Hp mRNA表达电泳结果

图3 基因芯片扫描图
3 讨论
毛孢子菌病(Trichosprosis)是由毛孢子菌感染引起的一种局部或系统播散性真菌病。国内外有关皮肤、毛发、指甲等局部感染及系统性感染的报道不断增多,毛孢子菌感染已成为除念珠菌外致人类播散性感染的第二大酵母菌感染[7]。T.asahii是播散性毛孢子菌病的主要致病菌,国外报道的毛孢子菌病,尤其是播散性毛孢子菌病,多发生于血液病、肿瘤、艾滋病等患者[8],而健康人很少发病,说明宿主免疫功能状态在致病真菌感染中起重要作用,而宿主感染T.asahii后免疫系统不能及时清除入侵的致病真菌的原因目前尚不清楚。
结合珠蛋白又称触珠蛋白,是血清α2球蛋白组分中的一种酸性糖蛋白,作为一种急性期蛋白,在参与宿主抗感染、损伤组织的修复以及内环境稳定的过程中起着重要作用,其血清含量在感染、创伤、炎症、肿瘤、心肌梗死等病理状态时显著升高。结合珠蛋白主要在肝脏合成,但D'Anniento等[6]对小鼠的皮肤研究发现,正常小鼠皮肤组织中也有Hp mRNA表达,且经LPS刺激后表达增强。Xie等[4]发现表皮朗格汉斯细胞(LC)胞浆中有结合珠蛋白,且可以调节培养状态下朗格汉斯细胞的功能转化。本实验采用RT-PCR和基因芯片技术对阿萨希毛孢子菌皮肤感染局部后Hp mRNA及Hp 基因表达进行研究,结果发现免疫抑制组和非免疫抑制组小鼠皮下接种阿萨希毛孢子菌后皮损组织均扩增出Hp mRNA,免疫抑制组皮损组织 Hp mRNA表达水平明显高于非免疫抑制组。基因芯片技术共筛选出11条免疫相关差异表达基因,其中编码结合珠蛋白基因表达上调,说明Hp参与了皮肤感染T.asahii过程中宿主的免疫应答。T.asahii感染所致局部炎症反应,可诱导局部皮肤结合珠蛋白的产生,具有一定的抗炎活性,以防止机体因过度炎症反应所造成的损伤,这种抗炎作用由结合珠蛋白基因的表达水平和持续时间所决定[9]。本实验结果亦发现免疫抑制组小鼠感染1天后皮损组织 Hp mRNA表达水平明显高于0.5天、3天、5天,随着感染时间延长,Hp mRNA表达水平逐渐降低。免疫抑制组局部Hp mRNA和编码结合珠蛋白的基因表达上调,宿主炎症反应将在一定程度上被削弱,这可能为真菌存活、建群、播散创造了一定的有利条件。另有研究表明结合珠蛋白有着多种免疫调节作用,其中一部分作用是通过其与CD11b结合来介导实现的,Arredouani 等[10]研究了结合珠蛋白对于辅助性T 细胞生成细胞因子的影响,体外试验结果表明结合珠蛋白对Th2细胞因子(IL-4, IL-5,IL-10 and IL-13)的产生具有剂量依赖性抑制作用,而对于Th1细胞因子(IL-2 and IFN-gamma)等的释放无明显的作用,故认为结合珠蛋白具有调节免疫系统中Th1/Th2平衡的作用,免疫抑制组感染局部Hp mRNA和编码Hp基因表达上调,将抑制Th2细胞因子的生成,可能会一定程度上削弱机体针对T.asahii的体液免疫,一方面可以防止过度急性炎症反应的产生,而另一方面也可能为阿萨希毛孢子菌的存活、感染发生及播散提供了有利的条件。
[1] 杨蓉娅, 敖俊红, 王文岭, 等. 阿萨希丝孢酵母引起播散性毛孢子菌病国内首例报告 [J]. 中华皮肤科杂志, 2001, 34 (5):329-332.
[2] Pini G, Faggi E, Donato R, et al . Isolation of Trichosporon in a hematology ward [J]. Mycoses, 2005, 48 (1): 45-49.
[3] Langlois MR, DelaJlghe JR. Biological and clinical significance of haptoglobin polymorphism in huIllans [J]. Clin Chem,1996, 42(10):1589-1600.
[4] Xie Y, Li Y, Zhang Q, et a1. Haptoglobin is a natural regulator of langerhans cell function in the skin [J]. J Dennatol Sci, 2000, 24(1):25-37.
[5] Li P, Gao XH, chen HD, et a1. Localization of haptoglobin in normal human skin and some skin diseases [J]. Intern J Dermatol, 2005, 44(4):280-284.
[6] D'Anniento J, Dalai SS, Chada K. Tissue, tempordl and inducible expmsaion patlem of haptoglobinin mice [J]. Gene, 1997, 195(1):19-27.
[7] Corrado Girmenia, Livio Pagano, Bruno Martino. Invasive infections caused by Trichosporon species and geotrichum capitatum in patients with hematological malignancies:a retrospective multicenter study from Italy and review of the literature [J]. J Clin Microbiol, 2005, 43(4):1818-1828.
[8] YANG Rong-ya, AO Jun-hong, WANG Wen-lin, et al. Disseminated trichosporonosis in China [J]. Mycoses, 2003, 46(11-12):519-523.
[9] Wang Y, Kinzie E, Berger FG, et al. Haptoglobin, an inflammation-inducible plasma protein [J]. Redox Rep, 2001, 6(6):379-385.
[10] Arreddouani M, Matthys P, Kasran A, et al. Haptoglobin and the Th1/Th2 balance: hints from in vitro and in vivo studies [J]. Redox Rep, 2001, 6(6):369-371.
Expression and regulation of haptoglobin in cutaneous Trichosporon asahii infection in mice
AO Jun-hong,HAO Zhen-feng,ZHU He,et al
Department of Dermatology, PLA. The Military General Hospital of Beijing, Beijing 100700, China
Objective To investigate the expression of haptoglobin (Hp) in the lesions and to explore its role in the regulation in cutaneous Trichosporon asahii infection. Methods Eighty BALB/c mice were divided into the immunosuppresive and nonimmunosuppressed group and injected with 3.2×107cfu/ml Trichosporon asahii on the skin. The cutaneous specimens were obtained on the 0.5, 1, 3, 5 days after inoculation. Total RNA of local cutaneous tissue were isolated. The expression of haptoglobin and the genes related to immunity after cutaneous infection of Trichosporon asahii were investigated by RT-PCR and gene expression chips. Results The Hp products from all of the skin specimens of inoculated sites were amplified with RT-PCR on 0.5, 1, 3, 5 days after inoculated. The expression of Hp mRNA in the immunosuppressive group was higher than that of in the nonimmunosuppressed group. There was a significant difference in the positive expression of HpmRNA between the immunosuppressive group and the nonimmunosuppressed group (P<0.05). The expression of Hp mRNA on 1d after inoculated in the immunosuppressive group was higher than that of on 0.5, 3, 5 days after inoculated (P<0.01). Eleven genes were screened out and the gene encoding Hp was up-regulated. Conclusion The results suggested that Hp take part in the course of Trichosporon asahii infection.
Trichosporon asahi;Haptoglobin;Skin;Infection
R756.6
A
1674-1293(2011)01-0005-04

敖俊红
2010-09-11
2010-12-25)
(本文编辑 祝贺)
国家自然科学基金资助课题(30771939)
100070,北京军区总医院全军皮肤病诊治中心(敖俊红,郝震锋,祝贺,樊昕,王文岭,夏志宽,杨蓉娅)
敖俊红,女,副主任医师,研究方向:真菌感染临床和实验研究,E-mail: aojunhong@sina.com
杨蓉娅,E-mail: yangrya@sina.com

