动物源性骨软骨支架修复兔膝关节复合缺损
谭文成,林宏生,张嘉晴,郑立恒,梁耀中,夏吉生,黄馨霈,吴 昊,陈 舒,查振刚
基础研究
动物源性骨软骨支架修复兔膝关节复合缺损
谭文成,林宏生,张嘉晴,郑立恒,梁耀中,夏吉生,黄馨霈,吴 昊,陈 舒,查振刚
目的探讨软骨细胞-动物源性骨软骨支架复合体修复兔膝关节骨软骨复合缺损的可行性和影响因素。方法将改良贴壁离心法获取的骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)/诱导分化的软骨细胞共培养后与经深低温冷冻、脱脂、脱钙、真空冷冻干燥和辐照消毒的动物源性骨软骨支架复合,构建共培养细胞+软骨-骨一体化复合支架。27只新西兰大白兔随机分为实验组(A组)、对照组(B组)和空白组(C组),每组9只。于兔股骨髁间窝处钻一深6 mm的骨软骨复合缺损,A组植入共培养细胞+骨软骨复合支架,B组植入骨软骨复合支架,C组不植入任何支架材料和细胞,分别于术后4周、8周和12周取材,行大体观察、苏木精—伊红染色和甲苯胺蓝染色,并对各标本的软骨切片进行组织学评分。结果随着时间的延长,A组大体观察见复合缺损区已完全修复,局部无凹陷,新生组织和周围组织融合;B组新生组织仍不能完全填充缺损;C组缺损区仍明显。苏木精—伊红染色和甲苯胺蓝染色见A组软骨缺损区由新生的透明软骨样组织修复,细胞呈柱状排列,极性好,软骨陷窝明显,骨缺损区由骨样组织修复,新生软骨和软骨下骨以及宿主骨界面耦合良好;B组新生软骨细胞无软骨陷窝,排列混乱,各界面藕合欠理想;C组可见陈旧性肉芽组织生长并突出于缺损区表面。甲苯胺蓝染色阳性率和组织学评分结果表明,A组与B、C两组之间的差异具有统计学意义(P<
软骨细胞;骨髓细胞;干细胞;细胞,培养的;支架;膝损伤;软骨,关节;兔
膝关节损伤十分常见,直径大于4 mm的缺损一般不能自行修复,软骨表面刨削、钻孔等治疗方法远期效果不佳,传统的组织工程骨软骨复合支架存在机械强度不高、修复组织和宿主界面耦合欠佳等问题。本研究应用骨、软骨组织工程原理,建立骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)/诱导分化的软骨细胞-动物源性骨软骨复合支架,并将其植入兔膝关节骨软骨复合缺损处,以期达到较好修复骨软骨复合缺损、解决传统修复方法耦合界面欠佳的目的。
1 材料和方法
1.1 主要实验试剂和仪器(见表1)
1.2 实验动物
普通级健康新西兰大白兔32只,体重2.5 kg左右,雌雄不限,由广东省医学实验动物中心提供,动物合格证:SCXK(粤)2008-0002,粤监证字2008A001。实验过程中对动物的处置参照国家科学技术部2006年发布的《关于善待实验动物的指导性意见》[1]。
1.3 实验方法
1.3.1 动物源性骨软骨复合支架的制备 随机取5只新西兰兔,空气注射法处死,用直径4 mm空心钻头在双侧股骨髁间窝分别钻取2条长约8 mm的骨软骨柱,置入-80℃深低温冰箱中冻存7 d,然后置入体积比为1∶l的三氯甲烷/丙酮溶液中脱脂24 h,再置入Von Ebener’s脱钙液7 d,无菌蒸馏水反复冲洗、浸泡至中性,真空冷冻干燥24 h,修剪支架为直径4 mm、高6 mm的圆柱体,最后用钴-60γ射线按15 KGY的剂量辐照灭菌5 d后无菌包装,制得动物源性骨软骨复合支架并置入4℃冰箱保存备用。
1.3.2 共培养细胞与动物源性骨软骨支架的复合改良贴壁离心法获取BMSCs并采用流式细胞术进行细胞表面抗原测定[2];取P3代BMSCs在软骨诱导液(胎牛血清100 mL/L、DMEM 10 g/L、地塞米松10-7mol/L、TGF-β1 10 μg/L、IGF-1 10 μg/L)中进行软骨向诱导,之后行甲苯胺蓝染色和Ⅱ型胶原染色检测[3];取P3代BMSCs和由BMSCs诱导21 d分化的软骨细胞用胰蛋白酶消化为细胞悬液后,调整细胞浓度为3×105/mL,按2∶1的体积比(4 mL∶2 mL)用DMEM和1640完全培养基混匀共培养6 d,胰酶消化为细胞悬液后,调整细胞浓度为3×105/mL,滴加入有支架的18孔培养板中,每孔1 mL,将培养板置入37℃、体积分数为5%的CO2培养箱内,用1640和DMEM完全培养液混合培养4 d,制备成细胞-支架复合体。
1.3.3 实验动物分组、手术及术后取材 将27只大白兔随机分为3组,每组9只。浓度为10 mg/mL的戊巴比妥钠溶液按3 mL/kg体重行兔耳缘静脉注射麻醉,切开膝关节,显露股骨髁关节面,用直径4 mm实心钻头在兔单侧股骨髁间窝处钻一深6 mm的骨软骨复合缺损。实验组(A组)于缺损处植入共培养细胞+骨软骨复合支架(图1),对照组(B组)单纯植入骨软骨复合支架,空白组(C组)不植入任何支架材料和细胞。缝合切口,术后用标准兔饮料单笼饲养,连续3 d肌注青霉素80万单位,不固定术肢,不限制饮水和进食。实验动物于手术1周后逐渐恢复,饮食、运动正常,无感染迹象,伤口Ⅰ期愈合,皮肤缝线自行脱落。分别于术后4周、8周和12周随机选取3组动物各3只行空气注射法处死,切除实验侧股骨远端,取材时关节腔无感染,无关节腔黏连,髌骨无脱位。行大体观察、苏木精—伊红染色和甲苯胺蓝染色,计算甲苯胺蓝染色阳性率,参考O’Driscoll组织形态学评分标准[4-6]对各标本的软骨切片进行组织学评分。

表1 主要实验材料、试剂和仪器

图1 在股骨髁间窝复合缺损处植入共培养细胞+骨软骨复合支架
1.4 统计学分析
采用SPSS 13.0软件进行数据处理,所得数据以均数±标准差表示,应用单因素方差分析对取材各时间点的甲苯胺蓝染色阳性率和组织学评分结果进行统计学分析,组内两两比较采用LSD-t检验,P<0.05认为差异有统计学意义。
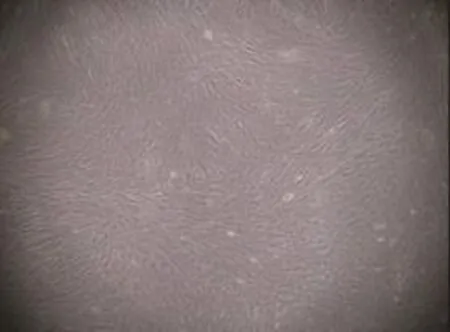
图2 BMSCs培养12 d(P0)空白组图片 细胞多为梭形,核圆形或椭圆形,聚集呈漩涡状生长,形态较均一(×40)
2 结果
2.1 骨髓间充质干细胞
原代BMSCs多为梭形,部分为多角形,团簇状,胞核呈卵圆形或圆形,胞质丰富、胞浆清晰,培养12 d左右细胞聚集呈漩涡状生长(图2)。流式细胞表面抗原标志:CD29表达为91.05%,CD44表达为91.02%,CD34表达为0.64%,CD45表达为0.55%(图3)。
2.2 诱导分化的软骨细胞
BMSCs经成软骨诱导后体积增大,细胞由成纤维样变为椭圆形及三角形,有的呈肾形(图4~5),经甲苯胺蓝染色后胞内出现大量的异染性基质,甲苯胺蓝染色阳性(图6),经Ⅱ型胶原免疫组化染色后胞核周围呈现黄褐色的染色阳性反应(图7),均表现为软骨细胞分化的特点。
2.3 大体观察
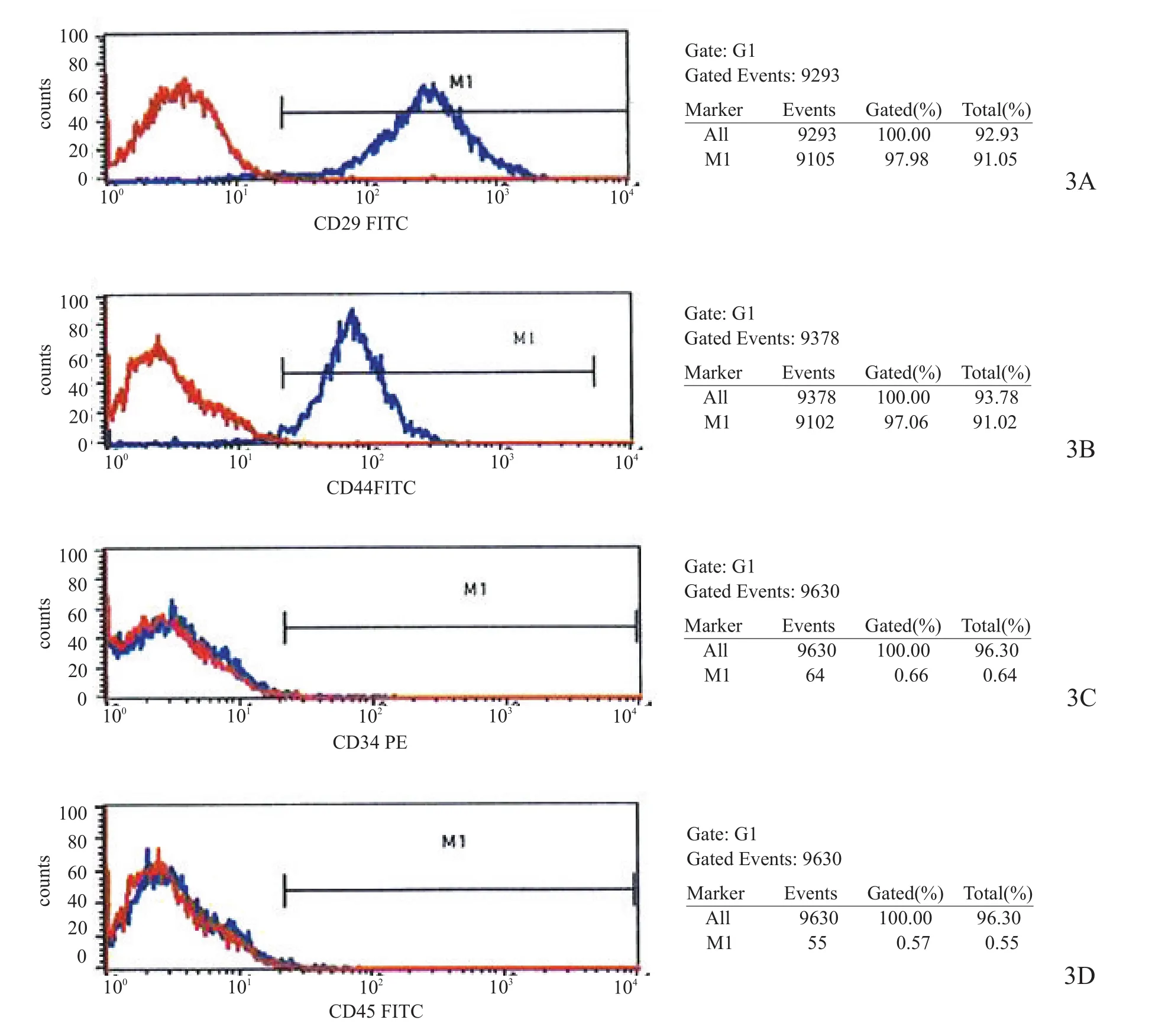
图3 BMSCs流式细胞表面抗原标志检测(高表达CD29、CD44,低表达CD34、CD45)
图4 BMSCs诱导培养后7 d(×100)

图5 BMSCs诱导培养后14 d(×40)
图6 BMSCs诱导21 d甲苯胺蓝染色阳性(×100)

图7 BMSCs诱导21 dⅡ型胶原免疫组化染色阳性(×100)
术后4周,A组缺损区稍凹陷,大部分缺损区被质软、有光泽及阻抗感的灰白色组织覆盖,并与邻近软骨组织逐渐融合(图8);B组缺损区凹陷更加明显,新生灰白色组织质软、量少、无阻抗感,与邻近软骨组织不融合(图9);C组无新生组织生成(图10)。术后8周,A组缺损区已无明显凹陷,大量新生质韧、有光泽、阻抗感更明显的乳白色组织覆盖绝大部分缺损区,并与邻近软骨组织融合(图11);B组缺损区新生灰白色组织较4周时量增多,质稍韧,有光泽和阻抗感,但与宿主组织界面融合欠佳(图12);C组则有少许新生组织生成(图13)。术后12周,A组原缺损区平坦,新生质韧有光泽的乳白色组织与宿主软骨组织已完全融合(图14);B组新生质韧有光泽的灰白色组织仍不能完全填充缺损(图15);C组缺损区明显(图16),内有少许质软无光泽的灰白色和灰黄色新生组织生成。
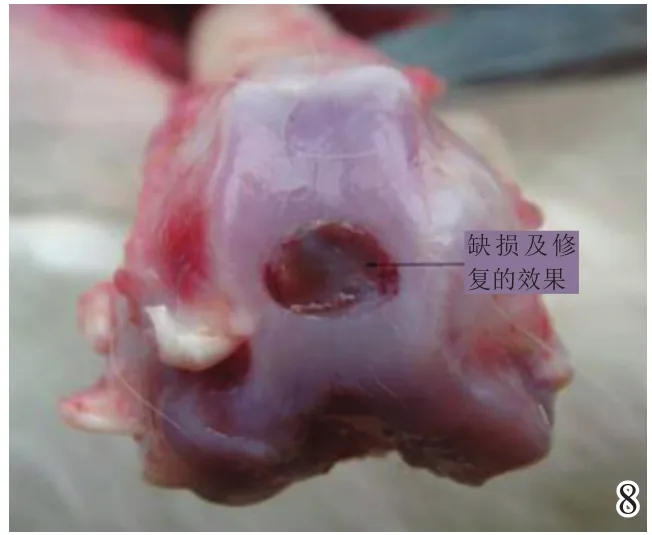
图8 术后4周实验组大体观察
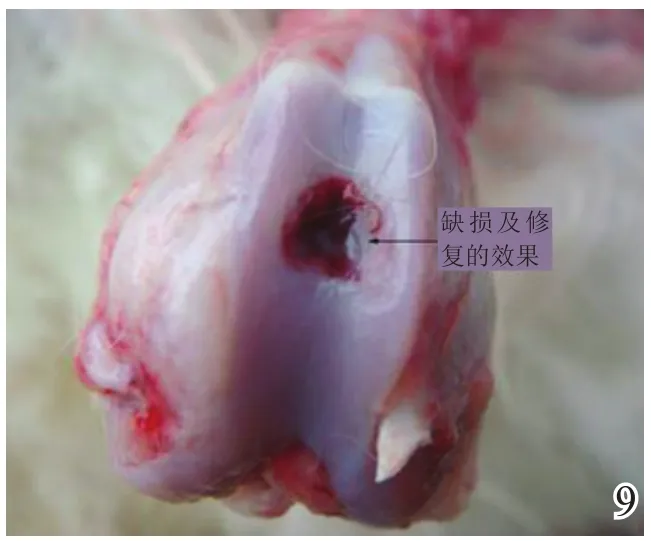
图9 术后4周对照组大体观察
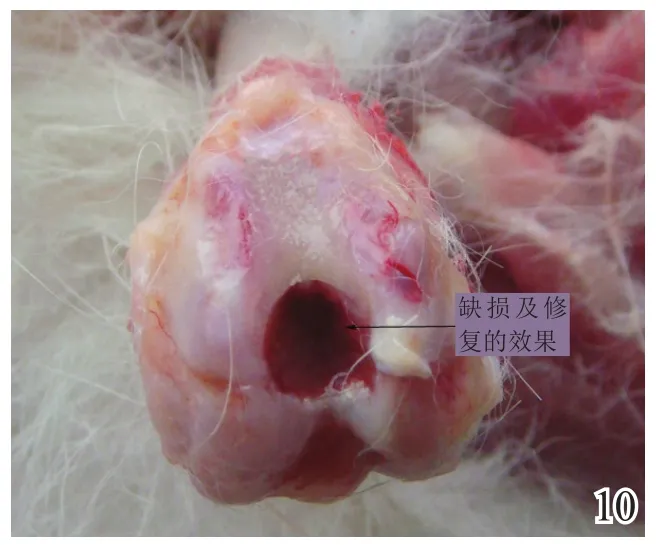
图10 术后4周空白组大体观察
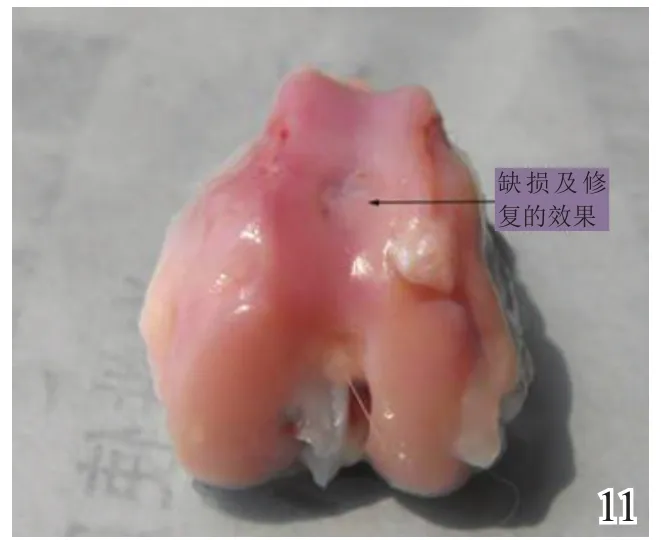
图11 术后8周实验组大体观察
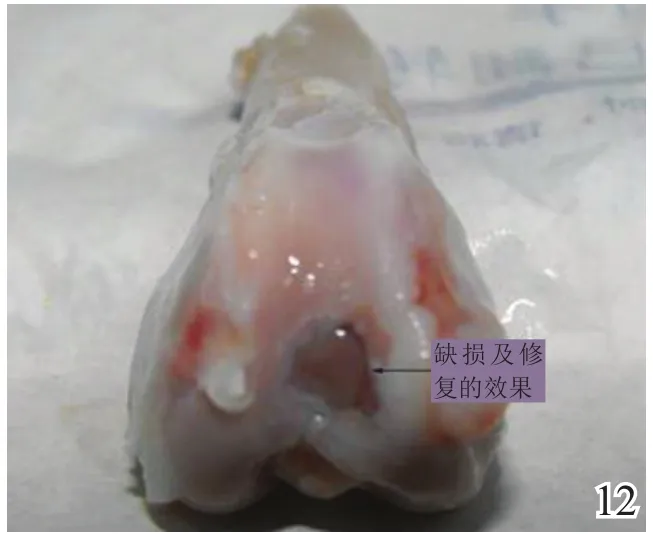
图12 术后8周对照组大体观察
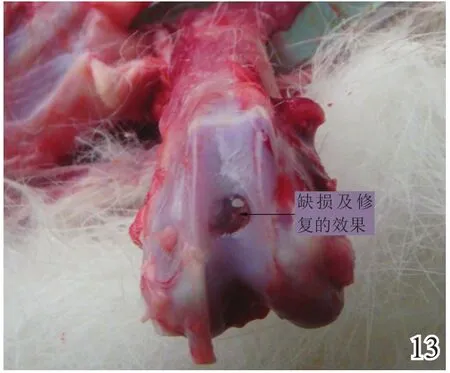
图13 术后8周空白组大体观察
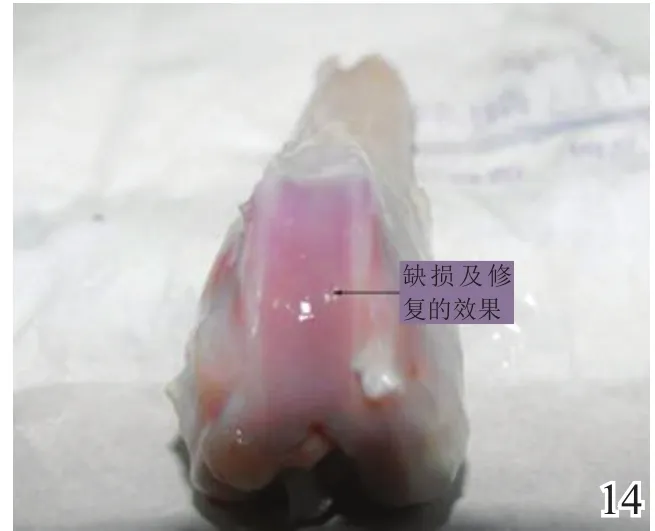
图14 术后12周实验组大体观察
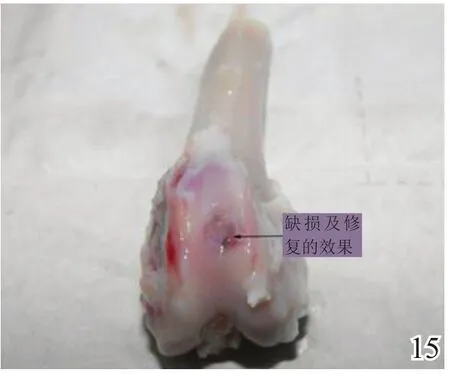
图15 术后12周对照组大体观察
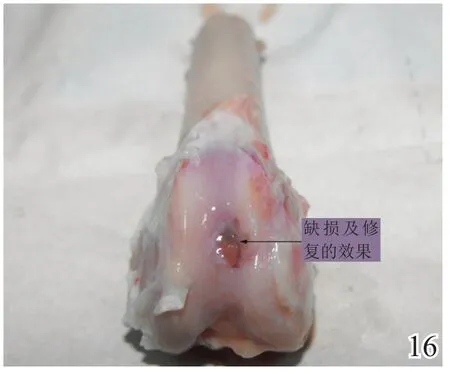
图16 术后12周空白组大体观察
2.4 苏木精—伊红染色观察
术后4周,A组缺损区可见炎症反应,内有较多量新生的类软骨样和成骨样细胞(图17);B组缺损较明显,亦可见炎症反应和少许类软骨样细胞生成,成软骨区与成骨区两者界线不明显(图18);C组缺损区被新生肉芽组织填充,炎症反应明显(图19)。术后8周,A组炎症反应减轻,新生细胞以圆形透明软骨样细胞为主,局部可见软骨陷窝,基底有新生骨生成,新生组织与宿主组织界面耦合良好(图20);B组新生的软骨样细胞量较少,局部无软骨陷窝,新生组织与宿主组织界面耦合欠佳(图21);C组仅见少量类软骨样组织生成(图22)。术后12周,A组软骨缺损由圆形柱状排列、软骨陷窝明显的透明软骨细胞形成的透明软骨组织修复,成骨缺损由成骨细胞形成的骨样组织修复,两区界面耦合及与宿主界面耦合均良好(图23);B组新生软骨细胞无软骨陷窝,排列混乱,软骨下骨组织生成少,各界面耦合欠理想(图24);C组可见陈旧性肉芽组织的生长并突出缺损区表面(图25)。
2.5 甲苯胺蓝染色观察
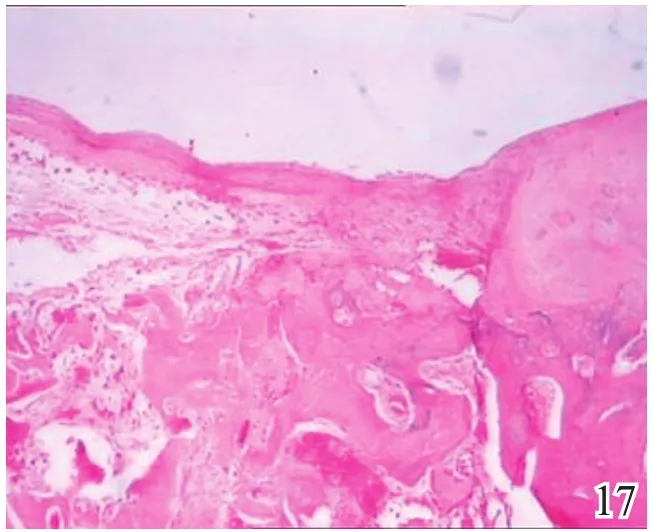
图17 术后4周实验组
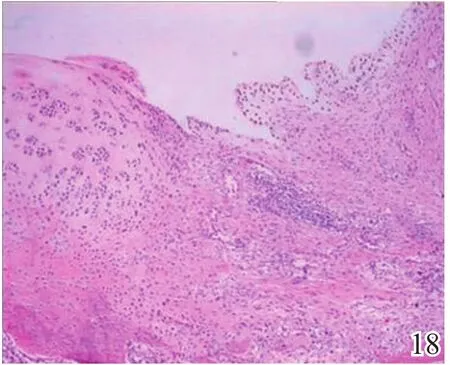
图18 术后4周对照组

图19 术后4周空白组
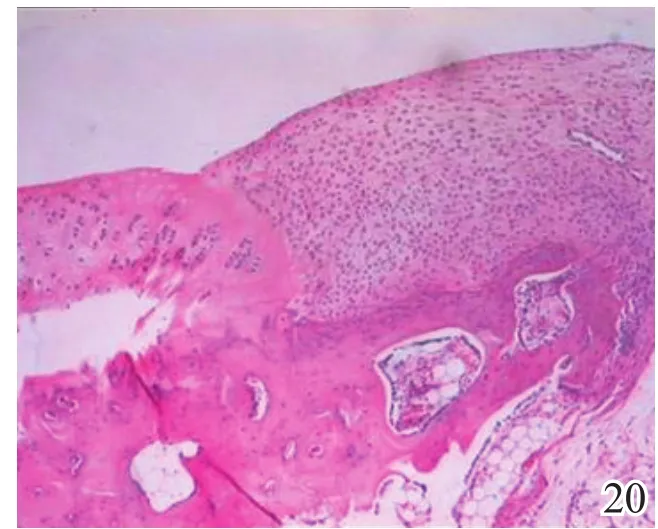
图20 术后8周实验组
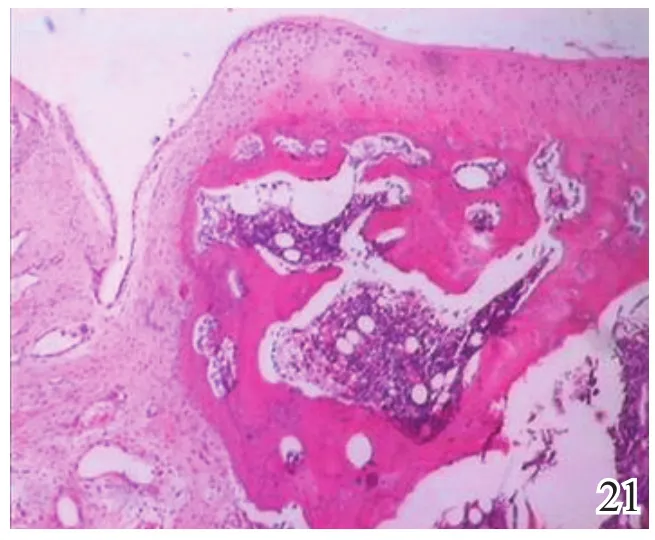
图21 术后8周对照组
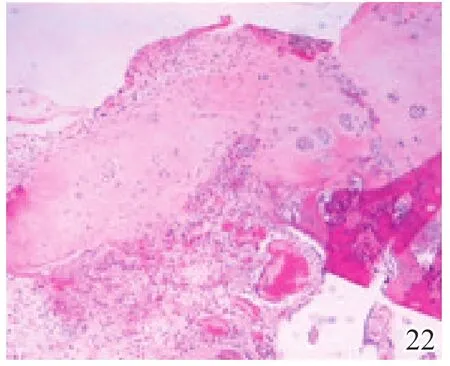
图22 术后8周空白组
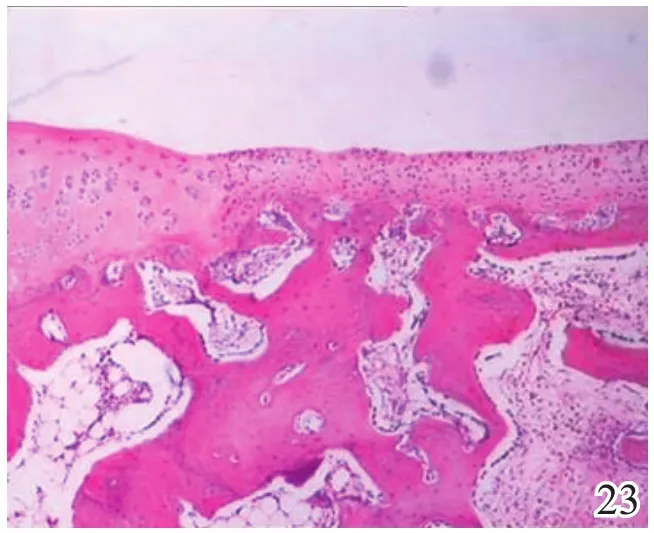
图23 术后12周实验组
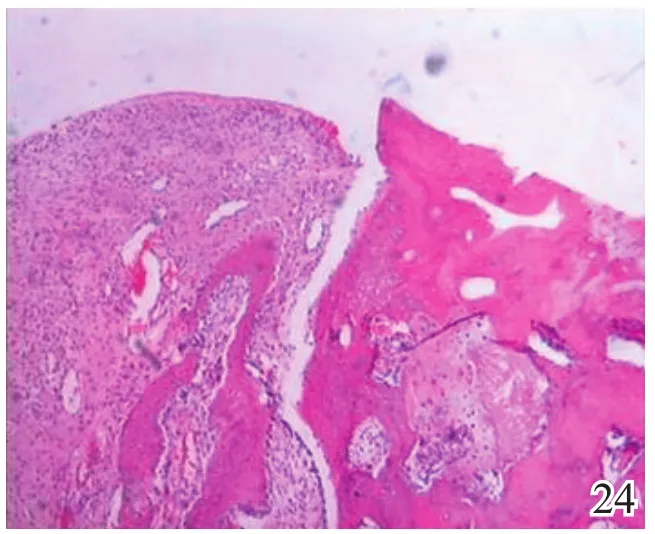
图24 术后12周对照组

图25 术后12周空白组(苏木精—伊红染色×40)
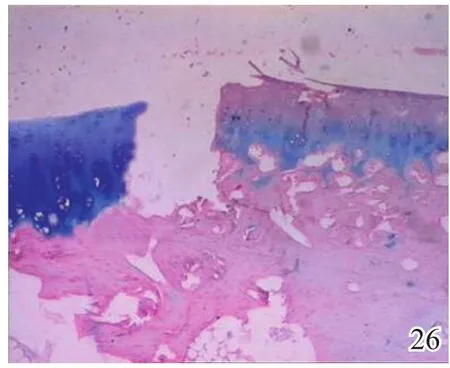
图26 术后4周实验组
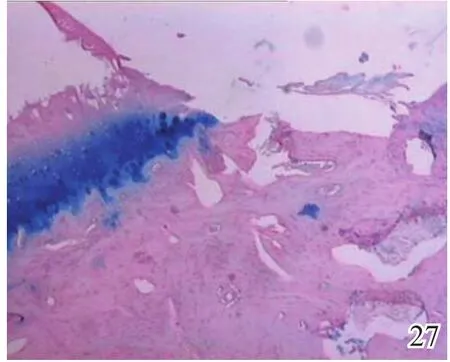
图27 术后4周对照组
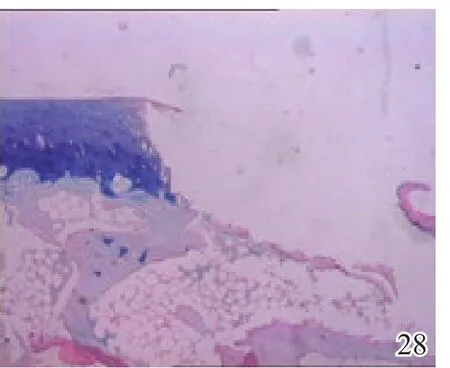
图28 术后4周空白组
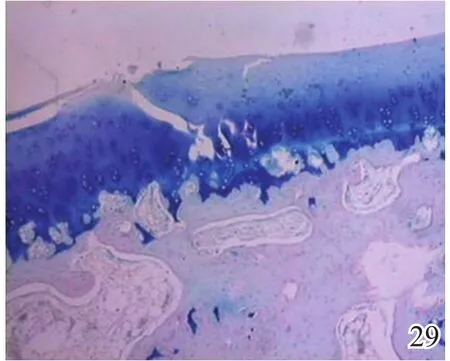
图29 术后8周实验组
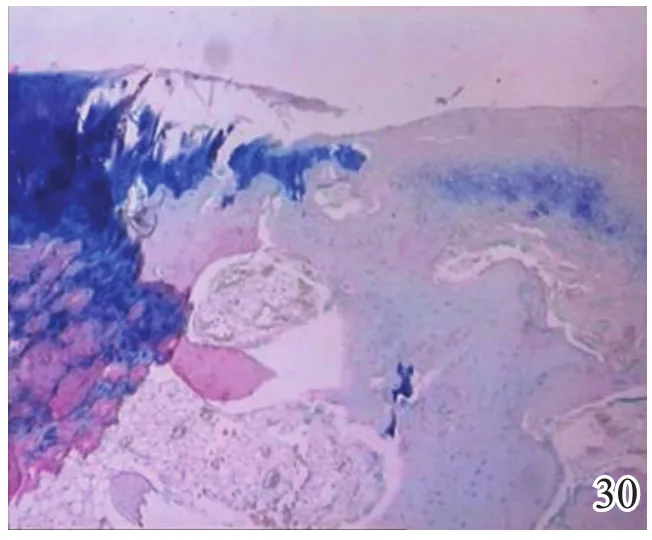
图30 术后8周对照组
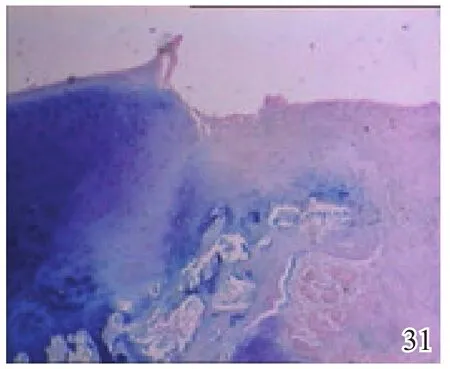
图31 术后8周空白组
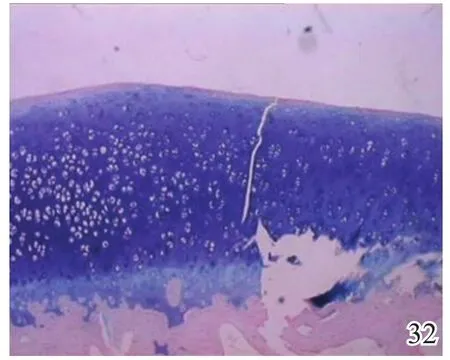
图32 术后12周实验组
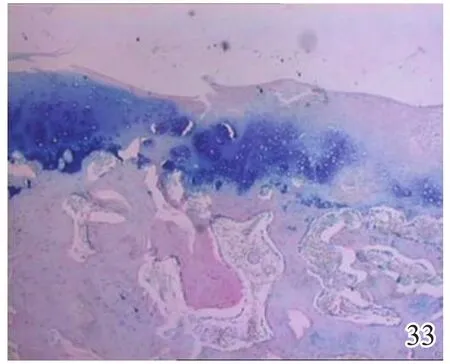
图33 术后12周对照组

图34 术后12周空白组(甲苯胺蓝染色 ×40)
术后4周,A组见少量圆形或椭圆形的形状规则的细胞着淡蓝色,细胞排列较整齐,极性较好,可见软骨陷窝,甲苯胺蓝染色弱阳性(图26);B组及C组甲苯胺蓝染色均阴性(图27~28)。术后8周,A组蓝染的圆形或椭圆形透明软骨样细胞增多,着色更深,软骨陷窝更加明显,部分细胞可见两个胞核,软骨下有较多新生骨生成并与宿主骨的骨小梁融合,新生组织与宿主组织界面耦合较好,甲苯胺蓝染色阳性(图29);B组少量蓝染的软骨样细胞排列不整齐,极性差,软骨陷窝不明显,新生组织与宿主组织界面耦合较差,甲苯胺蓝染色弱阳性(图30);C组甲苯胺蓝染色阴性(图31)。术后12周,A组大量圆形或椭圆形的形状规则的蓝染细胞排列整齐,极性一致,软骨陷窝数量更多更明显,软骨下多量的新生骨与宿主骨的骨小梁融合整合良好,缺损区新生软骨与宿主软骨、新生软骨下骨界面耦合亦良好,甲苯胺蓝染色强阳性(图32);B组蓝染细胞排列仍较紊乱,数量较A组少,甲苯胺蓝染色阳性(图33);C组可见陈旧性肉芽组织生长并突出于缺损区表面,甲苯胺蓝染色阴性(图34)。
3组术后各时间点甲苯胺蓝染色阳性率的比较如表2所示,A组与B组间、A组与C组间的差异有统计学意义(P<0.05)。
2.6 软骨组织学评分
术后4周、8周和12周A、B、C三组各时间点组织学评分结果的比较如表3所示,A组与B组之间、A组与C组之间的差异有统计学意义(P<0.05)。
3 讨论
关节软骨自我修复能力有限[7]。Redman等[8]认为直径小于3 mm的缺损可部分或全部修复,但修复产生的纤维软骨会逐渐退化甚至坏死,也有学者[9]提出直径大于2 mm的软骨缺损无法自行正常修复。在参考部分相关文献[10-13]后,我们建立的骨软骨复合缺损模型软骨缺损直径达4 mm,深至软骨下骨的潮线以下,以确保缺损需采用骨软骨组织工程的方法才能得以修复。
表2 3组术后各时间点甲苯胺蓝染色阳性率的比较(±s,%)

表2 3组术后各时间点甲苯胺蓝染色阳性率的比较(±s,%)
注:*与A组比较,P<0.05
组别8周A组B组C组F值P值甲苯胺蓝染色阳性率4周35.2±6.3 5.8±3.9* 0.5±1.2* 11.363 0.037 63.4±5.4 17.7±3.6* 5.6±3.1* 15.849 0.012 12周84.1±6.3 43.6±3.7* 6.8±3.8* 18.832 0.009
表3 3组术后各时间点组织学评分的比较(±s,分)
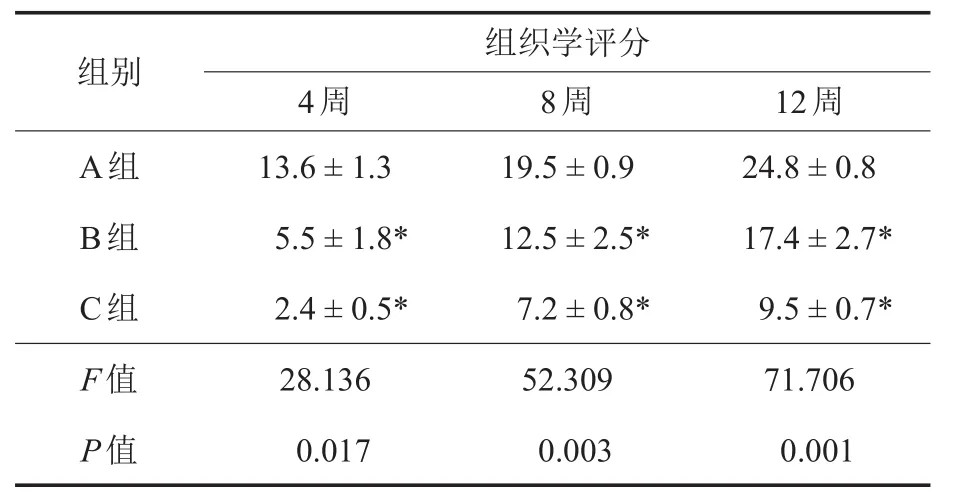
表3 3组术后各时间点组织学评分的比较(±s,分)
注:*与A组比较,P<0.05
组织学评分12周24.8±0.8 17.4±2.7* 9.5±0.7* 71.706 0.001组别8周A组B组C组F值P值4周13.6±1.3 5.5±1.8* 2.4±0.5* 28.136 0.017 19.5±0.9 12.5±2.5* 7.2±0.8* 52.309 0.003
选择合适的种子细胞在骨和软骨组织工程的构建中尤为重要。目前可供选择的种子细胞种类繁多,但迄今为止尚无一种能完全满足组织工程要求,种子细胞来源不足也严重限制骨软骨组织工程技术的应用[14]。在种子细胞的选择上,本研究联合应用TGF-β1、IGF-1和地塞米松将少量BMSCs诱导成为软骨细胞后与BMSCs以1∶2的比例共培养,这样既避免为获取足量的软骨细胞而进行大量的软骨取材,减少损伤,同时也避开软骨细胞反复传代培养4代以上即产生衰老和去分化的风险,为扩大和优化软骨组织工程的种子细胞来源提供实验依据。本研究的实验结果证实,共培养细胞中的BMSCs能促进软骨细胞的增殖,同时软骨细胞也为BMSCs的分化提供软骨微环境,从而为细胞复合到支架材料上、植入复合缺损区并进一步形成软骨和成骨提供重要前提。实验结果还表明,空白组骨软骨复合缺损在8周、12周只能由少量的纤维软骨和陈旧性肉芽组织填充,没有形成正常的透明软骨,而对照组和实验组复合缺损处都能形成软骨和成骨。对照组的成软骨、成骨速度较为缓慢,且与宿主软骨、骨的界面耦合欠佳,软骨细胞排列紊乱,细胞极性较差,软骨陷窝少,推测可能与植入单纯支架材料的对照组没有复合外源性种子细胞有关。实验组从4周起即有较为明显的软骨生成,至12周时,苏木精—伊红染色和甲苯胺蓝染色均提示缺损区修复的软骨主要为透明软骨,其与宿主的软骨、骨界面耦合良好,软骨细胞出现柱状排列的趋势,细胞极性好,软骨陷窝明显,软骨下骨的骨小梁和宿主骨的骨小梁整合良好,提示实验组缺损处软骨和软骨下骨都得到有效修复。三组术后各时间点甲苯胺蓝染色阳性率以及组织学评分的比较结果亦说明,不植入支架和细胞的空白组很难形成软骨组织修复缺损,而实验组的复合缺损处植入共培养细胞-骨软骨复合支架后可生成软骨组织修复缺损,修复效果明显优于空白组,且在12周内随着时间的延长修复效果越来越好。推测主要是由于共培养细胞复合到骨软骨支架材料上后,支架成软骨区原有的活性生长因子TGF-β1和胶原促进诱导分化的软骨细胞和BMSCs的黏附和增殖并进一步构建软骨组织;而成骨区原有的活性生长因子骨形态发生蛋白(bone morphogenetic protein,BMP)和胶原一方面促进共培养细胞中BMSCs以及宿主髓腔或松质骨中BMSCs的黏附和增殖[15]并构建骨组织,另一方面也使得异位黏附的共培养细胞中的软骨细胞发生凋亡,从而使骨软骨复合结构性缺损获得有效修复。
在界面的整合上,本研究的复合缺损除了软骨-软骨界面的整合,尚有软骨-软骨下骨和软骨下骨-骨界面的整合。由于载体为复合支架,外源性BMSCs和宿主BMSCs能迅速黏附到支架的成骨区并分化为成骨细胞来构建骨组织,因此软骨下骨-骨界面整合较快;同时,由于本研究使用的是同种异体的软骨-骨一体化复合支架,支架的软骨和软骨下骨的耦合十分完好,界面更加接近生理结构,细胞-支架复合体植入体内后能很好地构建出软骨和软骨下骨组织,从而达到软骨-软骨下骨界面的牢固整合。
本研究设计的动物源性骨软骨复合支架与传统的组织工程骨软骨支架如纳米羟基磷灰石/壳聚糖支架[3]相比,具有机械强度大,外观可塑性强,生物相容性好,细胞黏附率高、黏附速度快,修复效果佳等优点,因此我们认为,BMSCs与诱导分化的软骨细胞的共培养细胞复合动物源性骨软骨支架有望成为一种较理想的修复骨软骨复合缺损的方法。
参考文献
[1]中华人民共和国科学技术部.关于善待实验动物的指导性意见.2006-09-30.
[2]梁耀中,査振刚,郑力恒,等.BMSCs与PLGA支架构建组织工程化骨软骨复合组织[J].暨南大学学报:自然科学与医学,2010,31(2):168-173.
[3]李劼若,査振刚,姚平,等.纳米羟基磷灰石/壳聚糖支架与诱导骨髓间充质干细胞体外构建软骨支架复合体[J].中国组织工程研究与临床康复,2009,13(3):411-416.
[4]O'Driscoll SW,Recklies AD,Poole AR.Chondrogenesis in periosteal explants:an organ culture model for in vitro study [J].J Bone Joint Surg Am,1994,76(7):1042-1051.
[5]Fortier LA,Mohammed HO,Lust G,et al.Insulin-like growth factor-Ⅰ enhances cell-based repair of articular cartilage[J]. J Bone Joint Surg Br,2002,84(2):276-288.
[6] O'Driscoll SW, Keeley FW, Salter RB.Durability of regenerated articular cartilage produced by free autogenous periostealgraftsin majorfull-thicknessdefectsin joint surfaces under the influence of continuous passive motion:a follow-up report at one year[J].J Bone Joint Surg Am,1988, 70(4):595-606.
[7]Agung M,Ochi M,Adachi N,et al.Osteochondritis dissecans of the talus treated by the transplantation of tissue-engineered cartilage[J].Arthroscopy,2004,12(10):1075-1080.
[8]Redman SN,Oldfield SF,Archer CW,et al.Current strategies for articular cartilage repair[J].Eur Cell Mater,2005,14(9): 23-32.
[9]胡炯,杜宁,代岭辉,等.建立膝骨性关节炎关节软骨缺损的动物模型的研究[J].中国中医骨伤科杂志,2009,17(11): 13-16.
[10]Shapiro F,Kiode S,Glimcher MJ.Cell origin and differentiation in the repair of fullthickness defect of articular cartilage [J].J Bone Joint Surg Am,1993,75(4):532-553.
[11]杨瑞甫,胡蕴玉,吴银松,等.兔骨关节炎软骨缺损动物模型的建立[J].中华骨科杂志,2007,27(10):779-782.
[12]翟吉良,翁习生,邱贵兴.骨关节炎动物模型的建立及选择[J].中国矫形外科杂志,2007,15(11):843-845.
[13]段小军,左镇华,杨柳.细胞移植技术修复关节软骨缺损的临床应用进展[J].中华关节外科杂志:电子版,2010,4(1): 124-128.
[14]Vats A,Tolley NS,Buttery LD,et al.The stem cell in orthopaedics surgery[J].J Bone Joint Surg Br,2004,86(2): 159-164.
[15]Im GL,Kim DY,Shin JH,et al.Repair of cartilage defect in the rabbit with cultured mesenchymal stem cells from bone marrow[J].J Bone Joint Surg Br,2001,83(2):289-294.
Repair of composite defect in rabbit knee joint using animal-derived osteochondral scaffold
TAN Wencheng*,LIN Hongsheng,ZHANG Jiaqing,ZHENG Liheng,LIANG Yaozhong,XIA Jisheng,HUANG Xinpei, Wu Hao,CHEN Shu,ZHA Zhengang.*Macau Medical Science&Technology Research Association,Macau 999078,China
ZHA Zhengang,E-mail:woohaoo@163.com
Objective To investigate the feasibility of chondrocytes-animal derived osteochondral scaffold composite for repairing osteochondral composite defects in rabbit knee.Methods The co-cultured cells,consisted of adherence separated bone marrow mesenchymal stem cells(BMSCs)/induced and differentiated chondrocytes, were cultured on the animal osteochondral scaffold which was processed with deep frozen,degreased, decalcified,vacuum freezely dried and radiation sterilized procedures to construct the co-cultured cellular osteochondral scaffold composite.Twenty-seven newzealand rabbits were randomly divided into experimental group(group A),control group(group B)and blank group(group C),and there were 9 rabbits in every group. After a 6 mm-depth osteochondral composite defect was made by drilling in the intercondylar fossa of femur, co-cultured cellular osteochondral scaffold composite were planted in group A,only osteochondral scaffolds were planted in group B,while neitherscaffolds nor cellular composite were planted in group C.At 4,8,and 12weeks postoperatively,the restoration for osteochondral composite defects were evaluated by gross observation, hematoxylin-eosin staining,toluidine blue staining and histological score.Results With time go on,gross observation showed that the defects in group A were recovered completely,the regeneration and surrounding tissues were integrated and there was no hollow,while the new connective tissue in group B could not completely coverthe defects,and the defects in group C were not recovered at all.Hematoxylin-eosin and toluidine blue staining revealed that there were a lot of new hyaline cartilage at cartilage defect area in group A. In the new growth tissue columnar cells and cartilage lacuna were well arranged and polarized,also,there were many osteoid tissues in the bone defects,the interface of the regenerative cartilage,the subchondral bone and host bone coupled well.In group B,there were no cartilage lacuna in the regeneration cartilage,the arrangement of the cells were confusion and all interface coupled insufficiently.In group C,there were growing granulation tissue protruding from the surface of the defects.The positive rate of toluidine blue staining and histology score manifested that the differences between group A and B,and group A and C were statistical significance(P< 0.05).Conclusion Animal-derived osteochondral scaffold cultured with the co-culture cells consisted of BMSCs/ induction differentiation chondrocytes could successfully repair the composite defects of the cartilage and the subchondral bone in rabbit knee joint.
Chondrocyte;Bone marrow cells;Stem cells;Cells,cultured;Scaffold;Knee injuries;Cartilage, articular;Rabbits
R329.2,R684
A
1674-666X(2011)01-0051-09
2011-01-30;
2011-02-24)
(本文编辑 白朝晖)
10.3969/j.issn.1674-666X.2011.01.010
澳门医学科技研究基金项目(031/2009/A),广州市科技计划(2008Z1-E411)
999078澳门医学科技研究协会(谭文成,黄馨霈);510630广州,暨南大学附属第一医院暨南大学骨科疾病研究所(林宏生,吴昊,查振刚);510632广州,暨南大学医学院(张嘉晴);999087澳门仁伯爵医院(郑立恒,夏吉生);510630广州,暨南大学附属第一医院急诊科(梁耀中);510800广州,南方医科大学附属花都人民医院(陈舒)
査振刚,E-mail:woohaoo@163.com
0.05 )。结论BMSCs/诱导分化的软骨细胞共培养细胞复合动物源性骨软骨支架对兔膝关节软骨和软骨下骨的复合缺损具有修复作用。

