顶空固相微萃取和同时蒸馏萃取应用于GC-MS分析野生刺梨汁挥发性成分的比较研究
周 志,徐永霞,胡 昊,程 超,潘思轶,*
(1.华中农业大学食品科学技术学院,湖北 武汉 430070;2.湖北民族学院 生物资源保护与利用湖北省重点实验室,湖北 恩施 445000)
顶空固相微萃取和同时蒸馏萃取应用于GC-MS分析野生刺梨汁挥发性成分的比较研究
周 志1,2,徐永霞1,胡 昊1,程 超1,2,潘思轶1,*
(1.华中农业大学食品科学技术学院,湖北 武汉 430070;2.湖北民族学院 生物资源保护与利用湖北省重点实验室,湖北 恩施 445000)
采用顶空固相微萃取法(head-space solid phase micro-extraction,HS-SPME)和同时蒸馏萃取法(simultaneous distillation extraction,SDE)提取野生刺梨汁中挥发性成分,经气相色谱-质谱联用仪分析,结果共检测出52种挥发性化合物,其中烃类最多,有17种,其次是酯类12种和醇类7种,另外酸类、酚类、酮类、醛类和杂环类分别有5、3、3、3、2种。HS-SPME法和SDE法分别鉴定出37种和19种挥发性组分。两种提取方法相比较,HS-SPME具有快速简便、不使用溶剂、检测组分丰富和样品检测非破坏性等优点,更适宜于野生刺梨汁挥发性成分的分析。
野生刺梨;挥发性成分;顶空固相微萃取;同时蒸馏萃取
刺梨(Rosa roχburghii Tratt.)系蔷薇科落叶灌木植物,别名山刺梨、赛哇(西藏)、野石榴(陕西)、刺果儿和蜂糖果(鄂西)等,多分布于海拔1000~1600m的山区和丘陵地带[1]。刺梨富含VC、SOD、VP等生物活性物质[2],其营养价值和药用价值极高,具有抗氧化、增强免疫、延缓衰老、抗肿瘤等多种生理作用[2-4]。
当前,国内外饮品的需求正向天然型、保健型、愉悦型方向发展,已进入“新时代饮料”(n e w a g e beverage,NAB)时期,明确果汁香气成分是加工高品质饮品的基础。常用的水果香气物质的分离提取方法主要有同时蒸馏萃取法(simultaneous distillation extraction,SDE)、溶剂提取法(solvent extraction,SE)、顶空固相微萃取法(head-space solid phase micro-extraction,HSSPME)和超临界流体萃取(supercritical fluid extraction,SFE)等[5]。Takeoka等[6]采用SDE法对亚洲梨果实风味的组成进行测定;Gil等[7]研究认为SE法操作简单、成本低,可通过选择不同的萃取溶剂有针对性地提取特征香气成分;朱虹等[8]采用HS-SPME法提取不同成熟度香蕉的香气成分,结果发现,不同成熟度香蕉香气成分的种类和相对含量有明显差异;Chen等[9]采用HS-SPME法提取分析了鸭梨中的挥发性组分;马林等[10]采用超临界流体萃取刺梨挥发油,经气相色谱分析出21种化学成分;吕健等[11]比较研究了SDE法和SPME法对香精成分的提取效果。
目前,国内外有关于刺梨干酒香[12]、刺梨黑糯米酒香[13]及采用普通方法提取和分析刺梨香气成分[14]的报道,但刺梨作为一种野生资源,其特征性香气方面的系统研究较少。刺梨汁通过SDE法和HS-SPME法提取挥发性化合物,经气相色谱-质谱联用仪(gas chrom atography-mass spectrometry,GC-MS)分析鉴定,比较研究HS-SPME法和SDE法对分析刺梨挥发性化合物组成的区别,优选出分析刺梨挥发性化合物较合适的提取方法,为加工高品质的刺梨产品打下一定的理论基础。
1 材料与方法
1.1 材料、试剂与仪器
野生鲜刺梨采于湖北省恩施市高山地带,采摘时间为9月中下旬。正戊烷、N aC l、乙醚均为分析纯。
6890N/5975MSD气质联用仪 美国Agilent公司;固相微萃取装置[手动固相微萃取进样器、二乙烯基苯/碳分子筛/聚二甲基硅氧烷(DVB/CAR/PDMS)50/30μm、15mL顶空钳口样品瓶] 美国Supelco公司;同时蒸馏萃取装置为自行定制;SL280A型榨汁机 浙江苏泊尔炊具股份有限公司;TDL-5-A型离心机 上海安亭科学仪器厂;DW-86L626型超低温冰箱 青岛海尔特种电器有限公司。
1.2 方法
1.2.1 刺梨汁的制备
新鲜刺梨果经挑选、洗净和切碎后用榨汁机压榨取汁。汁液经过滤,4500r/min离心15min后于-76℃超低温条件下冻藏,备用。
1.2.2 固相微萃取法
冻藏刺梨原汁在30℃水浴条件下解冻,取8mL刺梨汁液放于15mL钳口瓶中,加入2.2g NaCl(以减少挥发物的损失和避免褐变),用聚四氟乙烯隔垫密封,于磁力搅拌器上加热平衡15min后,通过隔垫插入已活化好的SPME萃取头(270℃活化30min),推出纤维头,保持40℃恒温顶空吸附30min后,插入GC进样口解析5min。
1.2.3 同时蒸馏萃取法
冻藏刺梨原汁在30℃水浴条件下解冻,取150mL刺梨汁倒入500mL平底烧瓶中,接于SDE装置一端,用电炉加热烧瓶,保持溶液沸腾。S D E装置另一端接500mL圆底烧瓶,内装100mL正戊烷-乙醚混合液(1∶2,V/V),40℃恒温水浴提取2h。将萃取液置于冰箱冷冻室24h,取出除冰块,然后加入干燥无水硫酸钠脱水,最后用氮气吹扫浓缩至1mL。所得浓缩液供GC-MS分析。
1.2.4 GC-MS联用仪分析条件
气相色谱条件:HP-5毛细管柱(30m×320μm,0.25μm);载气为氦气;进样口温度250℃;升温程序为起始温度40℃,保持3min,以4℃/min升温至220℃,再以10℃/min升温至250℃,保持5min。固相微萃取头进样采用不分流进样;微量进样器进样时进样量分流比为1∶20,溶剂延迟时间为6min。
质谱条件:色谱-质谱接口温度280℃,离子源温度230℃,四极杆温度150℃;离子化方式:EI,电子能量70eV,质量扫描范围45~550u/s。
1.2.5 化合物鉴定及定量
样品挥发性化合物经气相色谱分离,不同组分形成其各自的色谱峰,用气相色谱-质谱-计算机联用仪进行分析鉴定。分析结果运用计算机谱库(Nist/Wiley)进行初步检索及资料分析,再结合文献进行人工谱图解析,确认挥发性化合物的化学成分。化合物相对含量采用面积归一法确定。
2 结果与分析
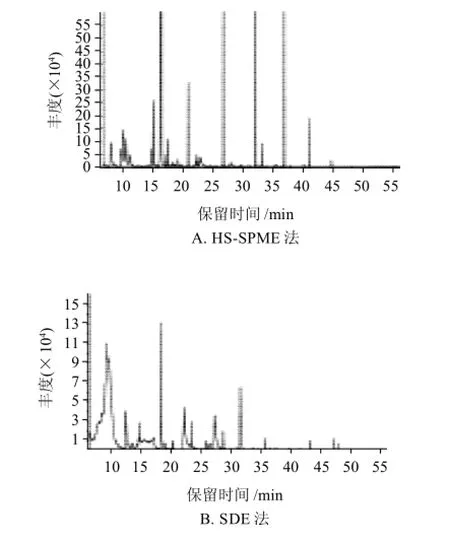
图1 两种方法提取的刺梨汁挥发性成分总离子图Fig.1 Total ion current chromatogram of volatiles from chestnut rose juice extracted by HS-SPME and SDE

表1 HS-SPME法和SDE法提取分析野生刺梨汁挥发性组分Table 1 GC-MS identification of volatiles from chestnut rose juice extracted by HS-SPME and SDE
刺梨汁通过HS-SPME法和SDE法分析之后,所检测的挥发性成分差异比较明显(图1)。GC-MS鉴定出的刺梨汁中挥发性成分及其相对质量分数见表1。
由表1可知,HS-SPME和SDE法提取相同的鲜刺梨汁样品挥发物,经GC-MS分析后共检测出8类52种挥发性化合物,其中HS-SPME法检出37种,SDE法检出19种,共同检测4种,采用HS-SPME法检测出的刺梨汁挥发性化合物的数量明显多于SDE法。
HS-SPME法中检出烃类16种、醛类1种、醇类7种、酸类1种、酯类9种、酚类2种和杂环类1种。SDE法中检出烃类1种、醛类2种、醇类1种、酸类5种、酯类5种、酮类3种、酚类1种和杂环类1种。采用HS-SPME法提取的刺梨汁挥发性化合物中烃类、醇类和酯类的种类明显多于SDE法,而酸类和酮类的种类明显少于SDE法。
HS-SPME法提取的刺梨汁挥发性化合物中相对含量较高的是苯乙烯(1.69%)、月桂烯(1.38%)、d-柠檬烯(48.05%)、双戊烯(0.26%)、罗勒烯(0.47%)、松油烯(1.00%)、戊基环丙烷(0.23%)、(Z)-3-己烯醇(4.43%)、正己醇(2.91%)、正辛醇(0.37%)、芳樟醇(0.32%)、辛酸(1.43%)、丁酸乙酯(3.06%)、异戊酸乙酯(1.63%)、顺-3-己烯基丁酯(0.41%)、丁酸-反-3-己烯酯(0.33%)、辛酸乙酯(0.39%)、氨茴酸甲酯(0.64%)、2,4-二叔丁基苯酚(1.14%)。SDE法提取的刺梨汁挥发性化合物中相对质量分数较高的有2-呋喃甲醛(19.45%)、3-呋喃甲醛(1.11%)、(Z)-3-己烯醇(15.31%)、庚酸(1.11%)、辛酸(7.67%)、氨茴酸甲酯(5.42%)、棕榈酸甲酯(0.32%)、油酸甲酯(0.38%)、16-甲基十七烷酸甲酯(0.20%)、2-甲基-3,5-二羟基-4H-吡喃-4-酮(0.79%)、4-甲氧基-2,5-二甲基-3(2H)-呋喃酮(2.72%)、2,4-二甲基呋喃(3.75%)。
3 结论与讨论
HS-SPME和SDE法提取相同的鲜刺梨汁样品挥发物,经GC-MS分析,HS-SPME法检出37种,SDE法检出19种,采用HS-SPME法检测出的刺梨汁挥发性化合物的数量明显多于SDE法。HS-SPME法和SDE法共同检出野生刺梨汁中烃类17种、醛类3种、醇类7种、酸类5种、酯类12种、酮类3种、酚类3种和杂环类2种;HS-SPME法提取的刺梨汁挥发性化合物中烃类、醇类和酯类的种类明显多于SDE法,而酸类和酮类的种类明显少于SDE法。将两种方法结合起来,可能会得到刺梨汁挥发性物质较客观的综合评价,这与陈清婵等[15]研究的结果相类似。
从两种方法检测出的相同鲜刺梨汁样品挥发物数量上看,HS-SPME法较SDE法检测出的物质丰富,这可能主要是SDE法提取出的挥发性物质经氮气吹扫浓缩时易损失所致。但哪种方法更能体现野生刺梨汁原有挥发性化合物信息,还需借助香气嗅探装置有待进一步鉴定。
[1]刘孟军. 中国野生果树[M]. 北京∶ 中国农业出版社, 1998∶ 217-222.
[2]方修贵, 李嗣彪, 郑益清. 刺梨的营养价值及其开发利用[J]. 食品工业科技, 2004, 25(1)∶ 137-138.
[3]Van RENSBURG C J, ERASMUS E, TOIT D, et al. Rosa roχburghii supplementation in a controlled feeding study increases plasma antioxidant capacity and glutathione redox state[J]. Eur J Nutr, 2005, 44(7)∶452-457.
[4]ZHANG Chunni, LIU Xiaozhuan, QIANG Hongjuan, et al. Inhibitory effects of Rosa roχburghii Tratt juice on in vitro oxidative modification of low density lipoprotein and on the macrophage growth and cellular cholesteryl ester accumulation induced by oxidized low density lipoprotein [J]. Clin Chim Acta, 2001, 313(2)∶ 37-43.
[5]谢建春. 现代香味分析技术及应用[M]. 北京∶ 中国标准出版社, 2009.
[6]TAKEOKA G R, BUTTERY R G, FLATH R A. Volatile constituents of Asian pear (Pyrus serotina)[J]. J Agric Food Chem, 1992, 40(10)∶1925-1929.
[7]GIL M, CABELLOS J M, ARROYO T, et al. Characterization of the volatile fraction of young wines from denomination of origin“Vinous de Madrid”(Spain)[J]. Anal Chem Acta, 2006, 563(1/2)∶ 145-153.
[8]朱虹, 陈玉芬, 李雪萍, 等. 顶空固相微萃取气质联用分析香蕉的香气成分[J]. 园艺学报, 2007, 34(2)∶ 485-488.
[9]CHEN JiLuan, YAN Shijie, FENG Zuoshan, et al. Changes in the volatile compounds and chemical and physical properties of Yali pear (Pyrus bertschneideri Reld) during storage[J]. Food Chem, 2006, 97(2)∶248-255.
[10]马林, 李光照, 黄鸿勋, 等. 刺梨挥发油香味成份毛细管气相色谱法定量分析[J]. 中国农学通报, 2007, 23(6)∶ 203-206.
[11]吕健, 阮晓明, 盛志艺, 等. 固相微萃取与同时蒸馏萃取法分析香精成分比较[J]. 烟草科技, 2003(2)∶ 25-28.
[12]马立志, 王瑞, 蔡竹, 等. 刺梨干酒香气成分的GC/MS分析[J]. 酿酒科技, 2008(2)∶ 114-115.
[13]马立志, 王瑞. 刺梨黑糯米酒香气成分的GC/MS分析[J]. 酿酒科技, 2009(2)∶ 103-104; 109.
[14]韩琳, 陈雪. 刺梨鲜果挥发性香味物质的提取方法研究[J]. 食品工业科技, 2007, 28(4)∶ 100-102; 105.
[15]陈清婵, 徐永霞, 吴鹏, 等. 同时蒸馏萃取与顶空固相微萃取法分析豆豉挥发性成分[J]. 食品科学, 2009, 30(20)∶ 327-330.
Comparative Application of Head Space-Solid Phase Micro-extraction and Simultaneous Distillation Extraction for GC-MS Analysis of Volatile Components in Chestnut Rose (Rosa roχburghii Tratt) Juice
ZHOU Zhi1,2,XU Yong-xia1,HU Hao1,CHENG Chao1,2,PAN Si-yi1,*
(1. College of Food Science and Technology, Huazhong Agricultural University, Wuhan 430070, China;2. Key Laboratory of Biologic Resources Protection and Utilization of Hubei Province, Hubei Institute for Nationalities, Enshi 445000, China)
Head-space solid phase micro-extraction method (HS-SPME) and simultaneous distillation extraction method (SDE) were compared for their sampling effectiveness in GS-MS analysis of volatile components in chestnut rose juice. Totally 52 compounds were identified, including 17 hydrocarbons, 12 esters, 7 alcohols, 5 acids, 3 phenols, 3 ketones, 3 aldehydes and 2 heterocycles. Thirty-seven volatile components were identified by HS-SPME method and 19 by SDE method. Compared to SDE method, HS-SPME method has the advantages of rapidity, simplicity, avoidance of organic solvents, more kinds of identified components, non-destructive sampling and is therefore more suitable for the analysis of volatile components in chestnut rose juice.
chestnut rose;volatile components;head-space solid phase micro-extraction (HS-SPME);simultaneous distillation extraction (SDE)
TS214.2
A
1002-6630(2011)16-0279-04
2011-04-25
周志(1974—),男,副教授,博士研究生,研究方向为食品风味化学。E-mail:zhouzhi77716@163.com
*通信作者:潘思轶(1964—),男,教授,博士,研究方向为食品科学。E-mail:pansiyi@mail.hzau.edu.cn

