木瓜蛋白酶水解大豆浓缩蛋白及糖基化修饰对水解产物溶解性的影响
张琳静,于国萍*
(东北农业大学食品学院,黑龙江 哈尔滨 150030)
木瓜蛋白酶水解大豆浓缩蛋白及糖基化修饰对水解产物溶解性的影响
张琳静,于国萍*
(东北农业大学食品学院,黑龙江 哈尔滨 150030)
为提高大豆浓缩蛋白(soy protein concentrate,SPC)在等电点处的溶解性,采用木瓜蛋白酶对大豆浓缩蛋白进行酶解,形成可溶性大豆蛋白,然后将其与葡聚糖进行糖基化反应,形成亲水的蛋白质-多糖复合物。结果表明:大豆浓缩蛋白酶解最佳条件为大豆蛋白与水质量配比5∶100、酶添加量10000U/g、反应温度55~60℃;糖基化最佳条件为葡聚糖与蛋白配比1∶1、反应时间3.5h;大豆浓缩蛋白在等电点附近(pH4)的氮溶指数由原来的9.53%提高到39.12%。本实验制备的等电点可溶大豆蛋白,可增加其在中等酸度食品中的应用。
大豆浓缩蛋白;木瓜蛋白酶;糖基化;溶解性
大豆蛋白制品主要有3种——脱脂大豆粉、大豆浓缩蛋白(soy protein concentrate,SPC)、大豆分离蛋白。大豆蛋白在其等电点两侧溶解度较高,但是等电点附近溶解度最低,这一定程度上影响了大豆蛋白的凝胶性、乳化性、持水性等功能性质。特别是大豆浓缩蛋白在制备过程中受热变性或醇变性,导致其溶解性更差。通常采用物理、化学和生物学方法,使大豆蛋白氨基酸残基和多肽链发生变化,以提高其溶解性[1]。Jambrak等[2]利用超声波处理大豆蛋白,经20kHz处理后,大豆分离蛋白和大豆浓缩蛋白的溶解性都有显著提高。Tang等[3]发现超高压尤其是400、600MPa处理大豆分离蛋白,可以使不溶的聚集物转化成可溶的聚集物。酶解是大豆蛋白增溶改性常用的生物学方法,经蛋白酶水解后的大豆蛋白溶解性显著改善:Lamsal等[4]发现大豆浓缩蛋白经限制性酶解后溶解性提高,在等电点附近溶解度提高了接近20%;使用Alcalase作为改性大豆蛋白的酶制剂,可以使醇法大豆浓缩蛋白的溶解度增大[5];也有研究发现大豆浓缩蛋白经胰蛋白酶修饰至水解度为1%,可以显著提高修饰产品的溶解性和保水性[6]。将大豆蛋白与多羟基的化合物进行复合,即糖基化反应可以提高大豆蛋白的溶解性,等电点附近也呈现较好的溶解性:陈中等[7]将蛋白质充分糖基化后制备了一种高稳定性的酸性蛋白饮料;将葡聚糖10万和乳清蛋白进行美拉德反应,发现蛋白在酸性条件下的溶解度提高、热稳定性增强[8];而通过干热接枝反应制备的糖苷化芸豆蛋白,也能显著改善芸豆蛋白的溶解度[9];酪蛋白-葡聚糖接枝物在酸性范围内,随着接枝度的增大,溶解度不断增大,在等电点附近,湿法和干法接枝物的溶解度分别提高至40%和30%左右[10]。本实验结合生物学方法(酶水解)和化学方法(糖基化)对大豆浓缩蛋白进行修饰,确定大豆浓缩蛋白酶解及糖基化条件,为提高大豆浓缩蛋白在食品领域的应用,尤其是等电点附近高溶解性产品开发提供参考。
1 材料与方法
1.1 材料
大豆浓缩蛋白(蛋白质含量为51.41%) 大庆日月星公司;木瓜蛋白酶 北京奥博星生物技术有限责任公司;葡聚糖(分子质量2×104u) 国药集团化学试剂有限公司。
1.2 仪器与设备
HYP-1014消化炉 上海纤检仪器有限公司;LNK-871凯氏定氮仪 江苏省宜兴市科教仪器研究所;FE20 pH计 梅特勒-托利多(上海)仪器有限公司;BIO-RAD垂直电泳槽 伯乐生命科学研究发展有限公司。
1.3 方法
1.3.1 氮溶指数测定
称取大豆浓缩蛋白0.20g,放入消化管中,按照GB/T 5009.5—2003《食品中蛋白质的测定》中的微量凯氏定氮法测定其蛋白含量,为总氮含量。称取大豆浓缩蛋白15.00g,常温溶解于300mL蒸馏水中,电动搅拌30min,然后转移至离心管中,3000r/min离心10min,取上清液10mL,放入消化管中,按照GB/T 5009.5—2003中的微量凯氏定氮法测定其蛋白含量,为可溶性氮含量。氮溶指数定义如下:

1.3.2 木瓜蛋白酶比活力的测定
目前国内通用的蛋白酶的活力单位定义为1min水解出1μg酪氨酸的酶量称为1U。参照参考文献[11],测得木瓜蛋白酶的比活力为320U/mg。
1.3.3 木瓜蛋白酶水解最佳条件的优化
配制一定大豆蛋白与水质量配比的大豆浓缩蛋白溶液,用1mol/L NaOH溶液将蛋白溶液pH值调至7.0,于不同温度下加入木瓜蛋白酶水解30min。反应过程中使用pH计,通过滴加NaOH溶液,保持酶解反应体系的pH值稳定在7.0。水解完成后,将水解液煮沸10min使酶失活。
通过单因素试验,确定大豆蛋白与水质量配比、酶添加量、温度等因素对氮溶指数的影响,确定最佳酶解反应条件。
1.3.4 大豆蛋白糖基化条件的优化
在确定的最佳条件下进行水解,然后向酶解后的大豆浓缩蛋白体系中添加合适比例的葡聚糖,置于95℃水浴中搅拌反应,一定时间后置于凉水浴冷却,停止反应。将溶液pH值调至4,离心取上清液。以氮溶指数为指标,确定最佳糖基化条件。
1.3.5 十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDSPAGE)
选择5%的浓缩胶和15%的分离胶,蛋白进样量为4μL。电泳开始时电压为80mV左右,蛋白进入分离胶后,改为120mV。观察酶解及糖基化修饰前后大豆浓缩蛋白分子质量分布情况及结构变化。
2 结果与分析
2.1 酶水解条件的优化
2.1.1 大豆蛋白与水质量配比对SPC氮溶指数的影响

图1 大豆蛋白与水质量配比对SPC氮溶指数的影响Fig.1 Effect of SPC concentration on NSI
如图1所示,未处理的SPC在低大豆蛋白与水质量配比(1∶100、2∶100)时氮溶指数较低,但变化不显著(P<0.05);随着大豆蛋白与水质量配比升高,氮溶指数升高;当大豆蛋白与水质量配比过高(5∶100、6∶100)时,过量的蛋白发生聚沉,氮溶指数下降。酶水解后的SPC氮溶指数有大幅提高,大豆蛋白与水质量配比较低(1∶100、2∶100)时,大豆蛋白分散体系较开阔,有利于酶充分作用于底物,因此氮溶指数提高较大,但是水解过程中底物浓度太低,不利于进一步利用,因此大豆蛋白与水质量配比确定为5∶100比较适宜。
2.1.2 酶添加量对SPC氮溶指数的影响
如图2所示,随着酶添加量逐渐增大,SPC氮溶指数逐渐提高,这是由于酶将大分子的不溶性蛋白水解成了小分子的可溶性肽段和氨基酸,底物充足时,酶添加量越大,水解后生成的可溶性肽比例越高,氮溶指数就越高。当酶添加量为10000U/g时,氮溶指数由水解前的76.56%提高到96.66%,当酶添加量为12000U/g时,氮溶指数提高到96.69%,二者差异并不显著(P<0.05)。说明当酶添加量达到一定水平后,底物已被酶所饱和,反应速度达到最大,再增大酶添加量,水解度增加将不明显[12]。因此选择酶添加量为10000U/g。

图2 酶添加量对SPC氮溶指数的影响Fig.2 Effect of papain amount on NSI of SPC
2.1.3 酶解反应温度对SPC氮溶指数的影响
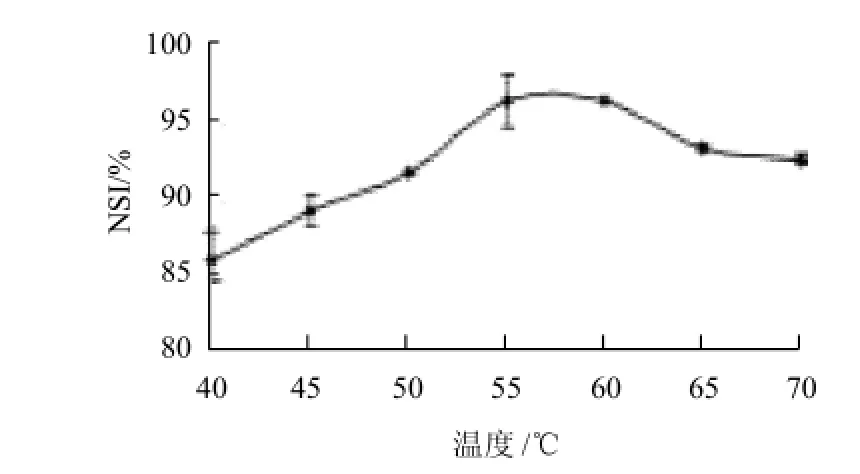
图3 反应温度对SPC氮溶指数的影响Fig.3 Effect of temperature on NSI of SPC
随着反应温度升高,氮溶指数逐渐提高。当酶水解温度保持在55~60℃时,SPC氮溶指数最高。温度继续上升,氮溶指数缓慢下降。温度偏低或偏高都不利于酶发挥最高活力[11],因此反应温度选择在55~60℃。
选择大豆蛋白与水质量配比5∶1 0 0、酶添加量10000U/g、反应温度55~60℃进行酶水解反应,产物用于进一步糖基化反应。
2.2 优化酶解条件下SPC的氮溶指数
在优化条件下对SPC进行处理,检测酶解前后SPC氮溶指数随pH值的变化情况。如图4所示,酶解后SPC氮溶指数普遍提高,一些pH值条件下氮溶指数接近100%。但是在pH4~6附近氮溶指数仍旧较低,与其他pH值条件下相差较大,这影响了其在中等酸度食品中的应用。为提高大豆浓缩蛋白等电点附近的溶解性,试验对酶解大豆蛋白继续进行改性,即糖基化修饰。
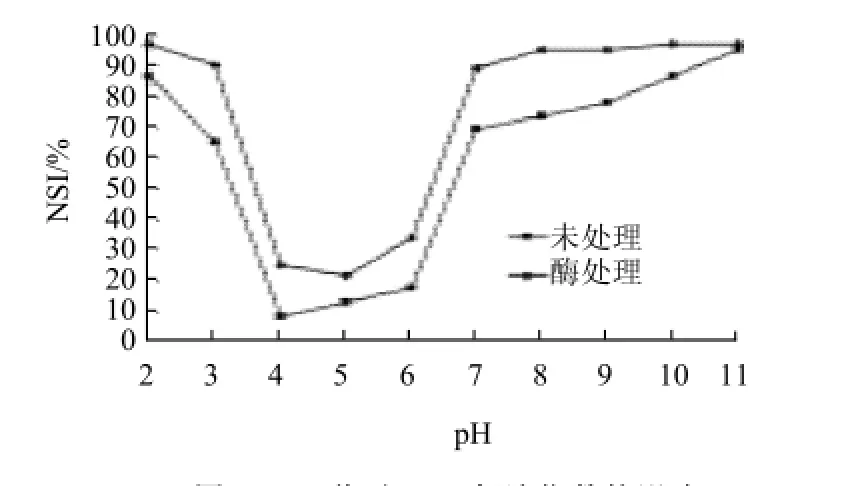
图4 pH值对SPC氮溶指数的影响Fig.4 Effect of pH value on NSI of SPC
2.3 大豆蛋白糖基化条件的优化
2.3.1 葡聚糖与蛋白配比对糖基化大豆蛋白氮溶指数的影响

图5 葡聚糖与蛋白配比对糖基化大豆蛋白氮溶指数的影响Fig.5 Effect of dextran amount on NSI of SPC
如图5所示,随着葡聚糖与蛋白配比的提高,它与肽分子之间碰撞的几率大大增加,有利于反应的进行。葡聚糖与蛋白配比0.5∶1~1∶1时,氮溶指数较高。但是,葡聚糖与蛋白配比增加到一定程度,由于肽分子和多糖分子的空间位阻,分子之间的碰撞几率会减少,不利于反应的进行[9]。由于多糖链的引入,多羟基的亲水性使蛋白质在pH4(等电点附近)溶解性得到提高,由25.90%提高到39.12%。葡聚糖量少时,形成的蛋白质-多糖复合物亲水基不足以保证蛋白质在其等电点的稳定性;葡聚糖量大时,由于大分子多糖形成的空间位阻也降低了蛋白质的稳定性。
2.3.2 糖基化时间对糖基化大豆蛋白氮溶指数的影响

图6 糖基化时间对糖基化大豆蛋白氮溶指数的影响Fig.6 Effect of glycosylation time on NSI of SPC
随着反应时间的延长,蛋白质分子的侧链氨基与多糖分子的末端不饱和羰基反应逐渐形成稳定的共价键,形成以多羟基多糖部分为亲水基,蛋白质部分为疏水基的大分子,多糖与蛋白质受热逐步结合,反应程度逐渐提高。但是反应时间过长会导致蛋白质结构过度伸展,增加蛋白质间的相互作用增加,以及多糖的空间阻碍,导致凝聚和沉淀,蛋白质氮溶指数下降。
2.4 SDS-PAGE

图7 大豆浓缩蛋白酶解及糖基化修饰产物电泳图Fig.7 SDS-PAGE of SPC, SPC hydrolysate and glycosylated SPC hydrolysate
由图7可以看出,酶解后蛋白质分子质量下降,形成了可溶性低分子质量多肽;糖基化后,上部较大分子质量条带减少,而分离胶顶端出现一条明显的大分子条带,说明多肽与葡聚糖产生了聚合,可溶部分蛋白分子质量增大。
3 结 论
木瓜蛋白酶水解大豆浓缩蛋白的最佳条件是大豆蛋白与水质量配比5∶100、酶添加量10000U/g、反应温度55~60℃。经此处理在各pH值条件下,酶解后SPC氮溶指数普遍提高。大豆蛋白糖基化的最佳条件是葡聚糖与蛋白配比1∶1、反应时间3.5h。经木瓜蛋白酶水解及糖基化修饰后大豆浓缩蛋白在pH4的氮溶指数由9.53%提高至39.12%。
本实验对大豆浓缩蛋白溶解性的提高进行了尝试,尤其是其在pH4时的溶解度得到了显著改善。但是对大豆浓缩蛋白增溶的分子机理研究还不透彻,需要在今后的研究中进一步探讨。
[1]田其英, 华欲飞. 大豆蛋白溶解性研究[J]. 粮食与油脂, 2006(6)∶ 6-8.
[2]JAMBRAK A R, LELAS V, MASON T J, et al. Physical properties of ultrasound treated soy proteins[J]. Food Engineering, 2009, 93(4)∶ 386-393.
[3]TANG Chuanhe, MA C Y. Effect of high pressure treatment on aggregation and structural properties of soy protein isolate[J]. LWT-Food Science and Technology, 2009, 42(2)∶ 606-611.
[4]LAMSAL B P, JUNG S, JOHNSON L A. Rheological properties of soy protein hydrolysates obtained from limited enzymatic hydrolysis[J]. LWT, 2007, 40(7)∶ 1215-1223.
[5]张艳. 醇法大豆浓缩蛋白的酶改性研究[D]. 无锡∶ 江南大学, 2008.
[6]刘宏芳, 侯瑶, 赵新淮. 大豆蛋白限制性酶解修饰与产品的溶解性和保水性变化[J]. 东北农业大学学报, 2009, 40(1)∶ 97-103.
[7]陈中, 林伟峰, 蔡蕾, 等. 高稳定性的酸性蛋白饮料的制备方法∶ 中国, 200710027964.5[P]. 2007-10-17.
[8]LAURA J C, VILLAMIEL M, ROSINA L F. Glycosylation of individual whey proteins by Maillard reaction using dextran of different molecular mass[J]. Food Hydrocolloids, 2007, 21(3)∶ 433-443.
[9]李家燕, 唐传核, 曹劲松, 等. 糖苷化对芸豆分离蛋白功能性质的影响[J]. 现代食品科技, 2009, 25(6)∶ 594-587.
[10]刘娟, 华欲飞. 酪蛋白-葡聚糖接枝改性研究[D]. 无锡∶ 江南大学, 2008.
[11]李卫民. 木瓜蛋白酶活力的快速测定[J]. 检测与分析, 2009, 12(10)∶30-33.
[12]王岩. Alcalase碱性蛋白酶水解大豆蛋白的工艺过程及动力学研究[J].食品科技, 2008, 33(3)∶ 40-41.
Effect of Papain Hydrolysis and Glycosylation on Solubility of Soybean Protein Concentrate
ZHANG Lin-jing,YU Guo-ping*
(School of Food, Northeast Agricultural University, Harbin 150030, China)
In order to increase the solubility of soybean protein concentrate (SPC) at the isoelectric point, SPC was hydrolyzed by papain to form soluble protein and then glycosylated with dextran to form a hydrophilic protein-polysaccharide complex. The best hydrolysis conditions of SPC were determined as follows∶ SPC concentration 5%, papain concentration 10000 U/g, and temperature 55-60 ℃. The best glycosylation was achieved after 3.5 h of reaction at a dextran/SPC ratio 1∶1. As a result, the nitrogen solubility index of SPC near the isoelectric point increased from 9.53% to 39.12%. The obtained soybean protein soluble at the isoelectric point can have more applications in moderately acidic foods.
soy protein concentrate;papain;glycosylation;solubility
TS201.2
A
1002-6630(2011)16-0001-04
2010-09-28
国家“863”计划项目(2006AA10Z322);哈尔滨科技创新人才研究专项(2006RFQXN014)
张琳静(1986—),女,硕士,研究方向为食品化学。E-mail:zlj1986112@126.com
*通信作者:于国萍(1963—),女,教授,博士,研究方向为食品化学。E-mail:yuguopingneau@hotmail.com

