糖基化亚硝基血红蛋白制备工艺优化
刘成国,陈 瑶,王冬冬,罗 扬
(1.湖南农业大学食品科学技术学院,湖南 长沙 410128;2.食品科学与生物技术湖南省重点实验室,湖南 长沙 410128)
糖基化亚硝基血红蛋白制备工艺优化
刘成国1,2,陈 瑶1,王冬冬1,罗 扬1
(1.湖南农业大学食品科学技术学院,湖南 长沙 410128;2.食品科学与生物技术湖南省重点实验室,湖南 长沙 410128)
以猪血红蛋白为原料制备亚硝基血红蛋白,根据热稳定性选择用壳聚糖对亚硝基血红蛋白进行糖基化。对糖基化反应过程中亚硝基血红蛋白与壳聚糖的质量分数比例、pH值、加热温度和时间对反应产物浓度(吸光度)的影响进行研究。单因素试验及响应面试验结果表明,糖基化亚硝基血红蛋白制备的最佳工艺条件为亚硝基血红蛋白与壳聚糖的质量分数比例为4.16∶1、pH5.6、加热温度50.5℃、时间15.7min。
血红蛋白;亚硝基血红蛋白;壳聚糖;糖基化反应
亚硝酸盐在肉制品加工中作为腌制剂的主要成分发色剂被广泛使用,由于其毒性和生成的亚硝胺的强烈致癌性,人们一直致力于寻找替代亚硝酸盐的方法[1]。在亚硝酸盐的替代方法研究中,以血红蛋白为原料生产腌制色素是充分利用畜禽血资源和降低肉制品中亚硝酸盐残留量的有效途径[2]。但国内外现在的亚硝基血红蛋白类色素的稳定性、分散性等加工性质尚不理想,提高亚硝基血红蛋白的稳定性和分散性是血红蛋白类腌制色素在生产中的应用关键。因此,对亚硝酸盐替代物的研究具有重要的实际应用意义和学术价值。
蛋白质与多糖在一定温度及相对湿度等条件下进行美拉德反应能制取糖基化蛋白,蛋白质的糖基化反应能使其赋予一些新的功能特性,如热稳定性、溶解性、乳化性、分散性、抗氧化性等[3]。Kato等[4]发现,在蛋白质变性温度下加热含蛋白质和多糖的溶液,可发生美拉德反应,所形成的聚合物具有良好稳定性。Matsudomi等[5]研究猪的血浆蛋白与半乳甘聚糖发生美拉德反应,其共价复合产物具有良好的乳化性质。糖基化蛋白作为添加剂应用于食品工业是一个新的研究领域,由于其稳定性、分散性好等特点,可以解决亚硝基血红蛋白类色素在实际应用中的缺点。目前国内外对于糖基化血红蛋白制取工艺系统性优化研究鲜有报道,因此,对糖基化亚硝基血红蛋白工艺进行优化研究是糖基化亚硝基血红蛋白后续利用的基础。
本实验以从猪血中提取的血红蛋白为材料,研究亚硝基血红蛋白糖基化的最佳反应条件,并利用响应面确定其最佳工艺条件,从而为猪血的充分利用和新型色素的开发提供一定参考。
1 材料与方法
1.1 材料与试剂
猪血 湖南农业大学滨湖市场;柠檬酸钠、氯化钠、氢氧化钠、醋酸、柠檬酸、亚硝酸钠均为分析纯;壳聚糖(水分10%,灰分1%,脱乙酰度≥99.0%)上海顺强化学试剂有限公司。
1.2 仪器与设备
电子天平 赛多利斯科学仪器有限公司;LD5-2A型低速离心机 北京医用离心机厂;pH计 上海宇隆仪器有限公司;数显恒温水浴锅 北京市永光明医疗仪器厂;722可见光分光光度计 上海精密科学仪器有限公司;78-2型双向磁力搅拌器 常州华普达教学仪器有限公司。
1.3 方法
1.3.1 血红蛋白的制备[6]
1.3.1.1 猪血的采集和血细胞分离
向新鲜猪血中加入0.5%柠檬酸钠溶液抗凝,与猪血充分混匀,低温下迅速运回实验室,过滤除去杂物。将抗凝血以3000r/min离心15min,收集下部的红细胞。用0.9%生理盐水洗涤红血球,然后在同样的转速下离心5min,重复洗涤两次,立即装入塑料瓶中于低温冰柜中冷冻贮藏(-20℃)。
1.3.1.2 血细胞的破壁
红血球使用前于4℃冰箱中存放化冻,同时起到冷冻破胞的作用。再采用溶胀法,血细胞与蒸馏水以1∶4比例混合后,磁力搅拌30min,当溶液由暗红转为鲜红时,将溶液以3000r/min离心15min,弃去下部沉淀,得血红蛋白粗提液。
1.3.1.3 血红蛋白的纯化
将破壁的血红蛋白溶液在避光条件下,于60℃水浴30min,取出后4000r/min离心15min,去除下部变性的杂蛋白,得到纯的血红蛋白溶液。
1.3.2 亚硝基血红蛋白的制备[7]
取制备的血红蛋白溶液(质量分数约为5%)100mL,加入0.26g NaNO2、0.1g异抗坏血酸钠和0.05g尼克酰胺,搅拌均匀后以碳酸氢钠调整pH6.0,在恒温60℃条件反应20min,取出在3000r/min离心5min,除去沉淀,得到亚硝基血红蛋白溶液。
1.3.3 糖基化亚硝基血红蛋白制备中的影响因素
1.3.3.1 壳聚糖和血红蛋白的相互质量分数比例[8]
分别向不同体积2%的壳聚糖溶液中加入10mL10%亚硝基血红蛋白溶液,通过计算得混合反应溶液质量分数及相互比例。设计10组两种溶液质量分数不同比例的试验,见表1。反应液调pH5.5,于50℃水浴条件加热20min,反应过程中时常振摇,使其受热均匀,定容至100mL,产物稀释相同倍数于A540下比色,以吸光度为评价指标,对比反应产物的合成效果。
1.3.3.2 pH值的影响
研究表明[9],蛋白与糖类的一般比例为4∶1。将亚硝基血红蛋白溶液和壳聚糖溶液的混合液质量分数比确定为4∶1,调整反应液pH4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5,后操作同1.3.3.1节,以吸光度为评价指标,确定最佳p H值。
1.3.3.3 温度的影响
将亚硝基血红蛋白溶液和壳聚糖溶液的混合液质量分数比确定为4∶1,反应液调pH5.5,分别于30、40、45、50、60℃条件下加热后操作同1.3.3.1节,以吸光度为评价指标,确定最佳反应温度。
1.3.3.4 反应时间的影响
将亚硝基血红蛋白溶液和壳聚糖溶液的混合液质量分数比确定为4∶1,反应液调pH5.5,在50℃水浴条件下分别加热5、10、15、20、25、30min,后操作同1.3.3.1节,以吸光度为评价指标,确定最佳反应时间。
1.3.3.5 Box-Benhnken设计优化糖基化反应条件
根据单因素试验结果,设计3因素3水平的响应面分析方法,选择温度、反应时间和pH值3个对糖基化反应影响显著的因素为自变量,共15个试验点,12个为析因点,3个为零点,以吸光度(A540)为响应值,Box-Benhnken试验因素与水平如表2。
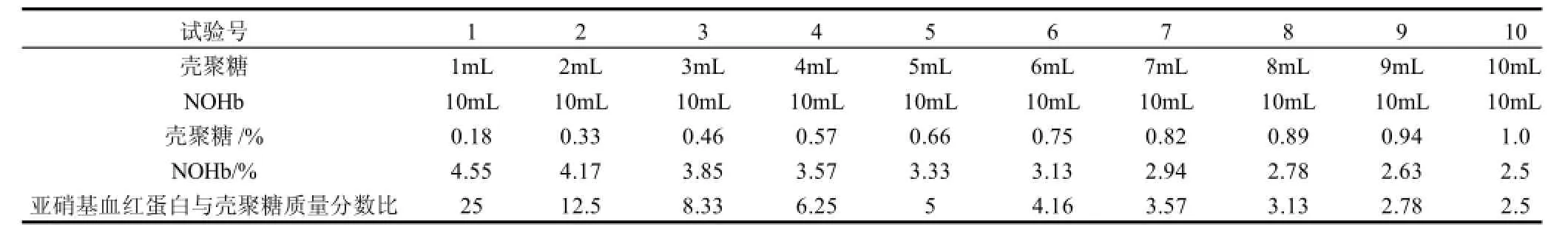
表1 亚硝基血红蛋白与壳聚糖质量分数比例对糖基反应的影响Table 1 Amounts of 2% chitosan added to 10 mL of 10% nitrosohemoglobin for different ratios of nitrosohemoglobin to chitosan

表2 Box-Benhnken试验设计因素与水平Table 2 Factors and their coded levels in Box-Behnken experimental design
2 结果与分析
2.1 壳聚糖和亚硝基血红蛋白质量分数的影响
壳聚糖-亚硝基血红蛋白混合液中亚硝基血红蛋白与壳聚糖的质量分数比例对糖基化反应有着重要的影响,A540为反应产物稀释后的吸光度,结果见图1。
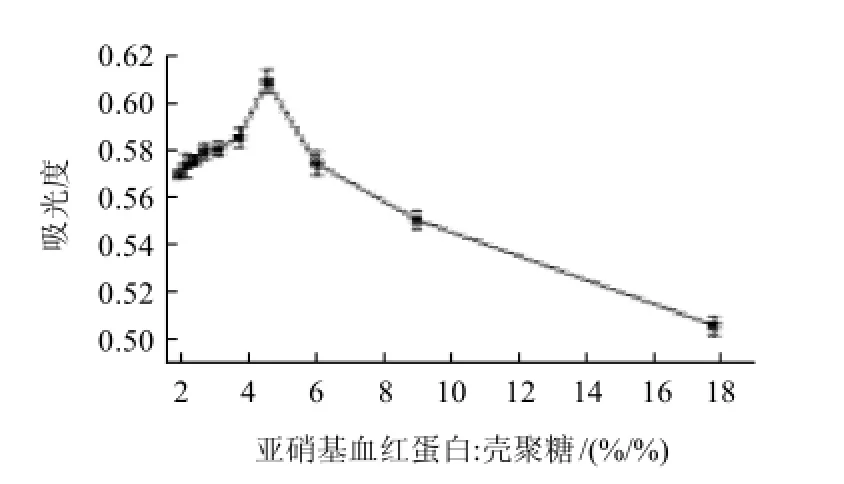
图1 不同反应物质量分数比例对糖基化反应产物吸光度的影响Fig.1 Effect of nitrosohemoglobin-to-chitosan ratio on absorbance at 450 nm of reaction products
由图1可见,亚硝基血红蛋白与壳聚糖质量分数比例在2.5~4.16之间时,随着底物质量分数比例的提高,吸光度增加,表示产物的质量分数增加;当底物质量分数比例大于4.16后,随着底物质量分数比例的提高,产物质量分数会降低,底物质量分数比对糖基化反应具有显著影响。此试验最佳底物质量分数比为4.16∶1,与Kato等[4]的研究结论蛋白与糖类的最适比例一般为4∶1相一致。
2.2 pH值的影响
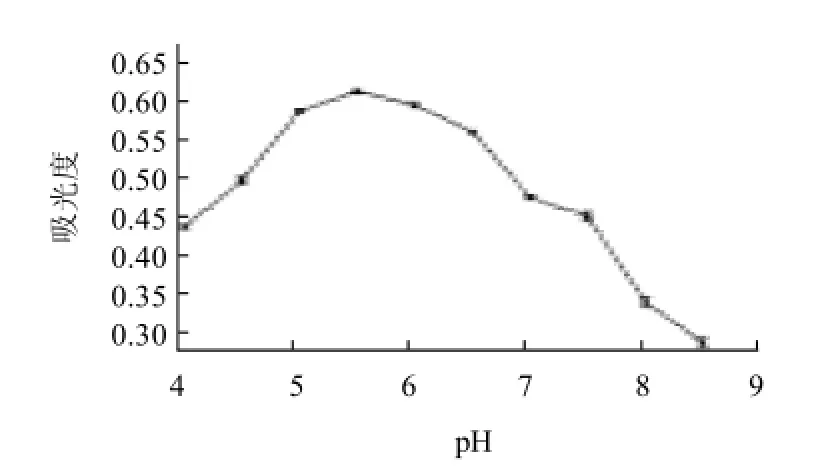
图2 pH值对产物吸光度的影响Fig.2 Effect of pH value on absorbance at 450 nm of reaction products
从图2可见,当pH5.5时产物浓度最大,当pH>7.5时,反应液开始大量产生沉淀,产物浓度急剧下降。pH值的改变会影响蛋白质分子的解离和带电性,从而改变蛋白质的水合特性[10]。蛋白质的稳定性与pH值有关,溶液pH值高于或低于等电点pH值时,由于净电荷和排斥力的增加使蛋白质结合较多的水,从而有利于防止蛋白质变性;从蛋白质与多糖之间的静电作用来看,当蛋白质和多糖都带净负电荷时,一般趋于生成可溶性蛋白质-多糖复合物,此时,两者之间相互作用是由蛋白质分子上正电荷区域与阴离子多糖相互吸引所引起[11]。多糖与蛋白质上所带不同电荷的密度越大,越容易发生静电作用。本试验最佳pH值在5.5左右,可能正是pH值对蛋白质稳定性影响和对大分子间相互作用力影响综合作用的结果。
2.3 温度的影响

图3 反应温度对产物吸光度的影响Fig.3 Effect of temperature on absorbance at 450 nm of reaction products
由图3可见,随着反应温度的提高,吸光度呈现先上升再下降的趋势,反应温度为50℃时吸光度最大。在试验的温度范围内,当温度提高,有利于糖基化反应的进行,一定时间内产生的糖基化亚硝基血红蛋白浓度就会提高,在50℃时其反应速度最快,但随着温度的进一步提高,蛋白质变性发生聚沉现象,降低了溶液中可溶性产物的浓度,从而使得吸光度偏低。有资料报道,低温下糖基化反应制备的多糖-蛋白共价复合物的稳定性更优[4]。
2.4 反应时间的影响
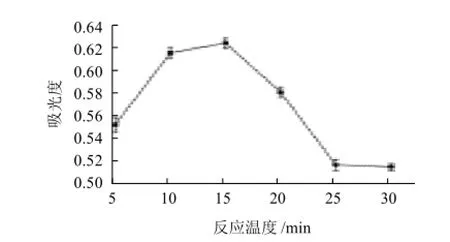
图4 反应时间对产物吸光度的影响Fig.4 Effect of reaction time on absorbance at 450 nm of reaction products
由图4可见,在50℃加热温度下,15min反应时间的效果最好。加热时间5min时,其糖基化反应还未完全;反应时间15min时,其糖基化反应达到平衡,吸光度最大;随着加热时间的不断延长,吸光度越小,可能是因为长时间的加热使得未参与反应的热稳定性较差的亚硝基血红蛋白发生了热变性,出现聚沉现象,降低了溶液中产物的浓度,使得吸光度偏低。
2.5 响应面优化糖基化反应条件结果[12]
根据表2试验因素与水平设计,按照反应温度、反应时间、pH值的具体水平进行试验,结果见表3。
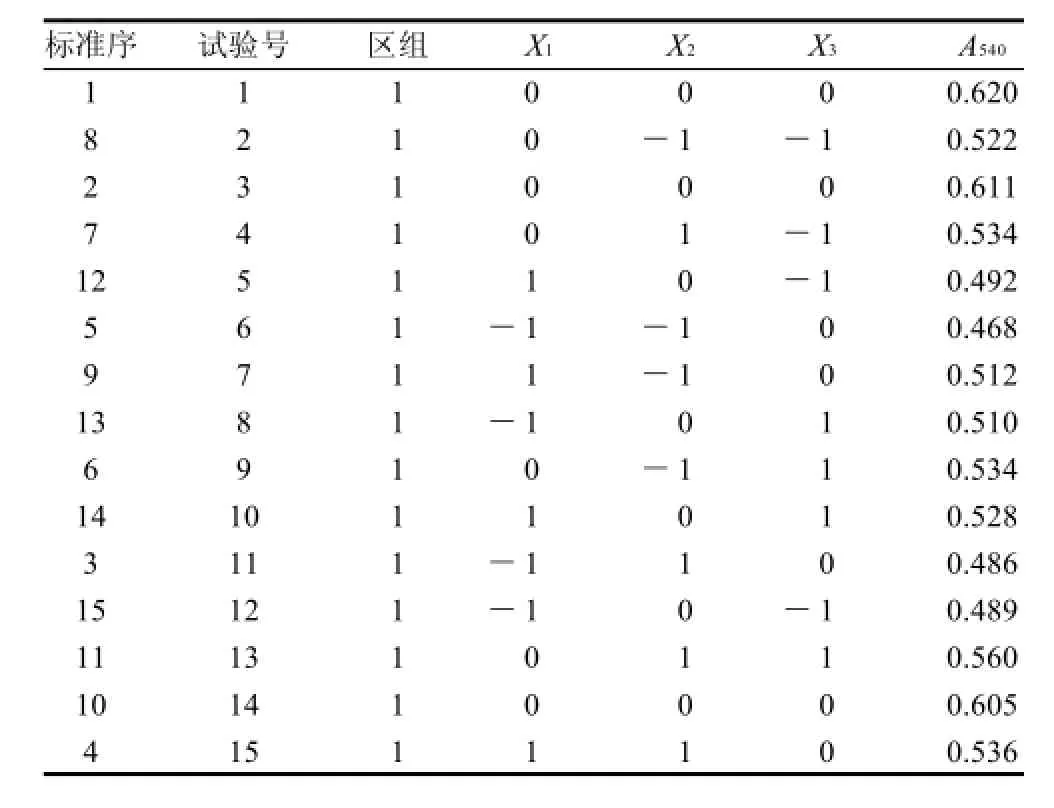
表3 Box-Benhnken试验设计结果Table 3 Box-Behnken experimental design and corresponding experimental results
由表3可知,中心试验的最佳吸光度(0.620)较单因素试验的最佳吸光度高,分析原因可能是反应的亚硝基血红蛋白溶液见光、遇氧易氧化,4~6h后即开始分解,浓度降低,色素吸光度下降[13],导致随着时间的增加,糖基化反应响应面条件优化试验的最佳吸光度比单因素试验的吸光度稍低。
对反应温度、反应时间、pH值作如下变换:X1=(Z1-50)/5,X2=(Z2-15)/5,X3=(Z3-5.5)/0.5,以吸光度A540为响应值(Y)。试验设计与结果见表3。试验顺序即试验号,是Minitab软件自动随机化分布的标准序,这样做最大程度避免了系统误差,尽可能的保证了试验随机化的原则。
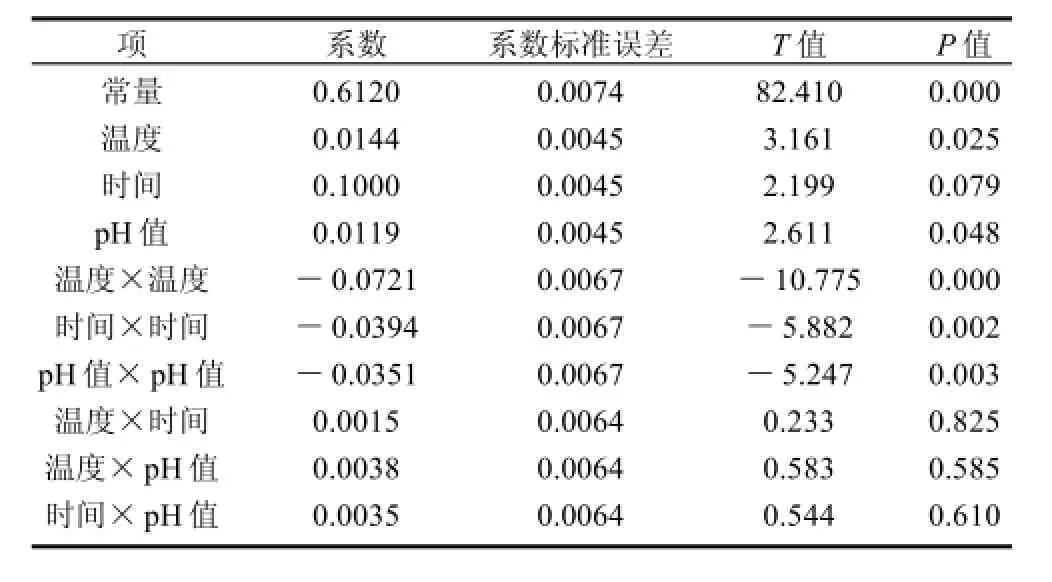
表4 方程模型估计回归系数Table 4 Coefficient estimates of the predictive regression for absorbance at 450 nm of reaction products
为使模型更好的反映优化条件,模型中仍然保留各项系数的存在,模型方程如下:
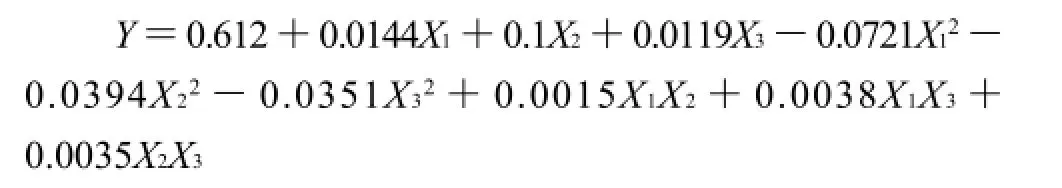
回归方程中各变量吸光度影响的显著性,由F检验来判定,概率P的值愈小,则相应变量的显著程度愈高。温度和pH值的P值都小于0.05,表明其对色素吸光度的影响较显著,时间的P值大于0.05,表明其影响不显著。整体的回归方程的P值小于0.01,回归方程是极显著的。相关系数R2=0.0299/0.0307=97.31%,说明吸光度的变化有97.31%来源于所选变量,即时间、温度和pH值。因此,回归方程可以较好地描述各因素与响应值之间的真实关系,可以利用回归方程确定最佳条件。对回归方程取一阶偏导数等于零,整理可得如下3式:
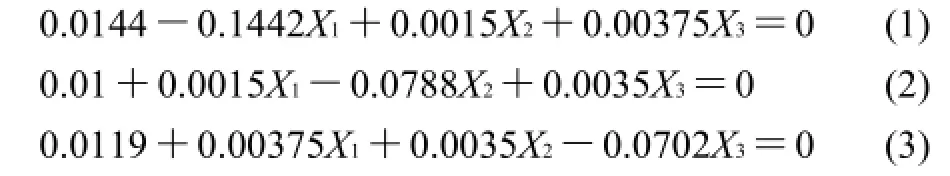
将式(1)、(2)、(3)联立方程组,解得X1=0.106、X2=0.137、X3=0.182,代入变换公式,得到反应温度Z1=50.5℃,反应时间Z2=15.7min,pH值Z3=5.6。为了验证二次回归方程的可靠性,对方程进行方差分析,结果见表5。
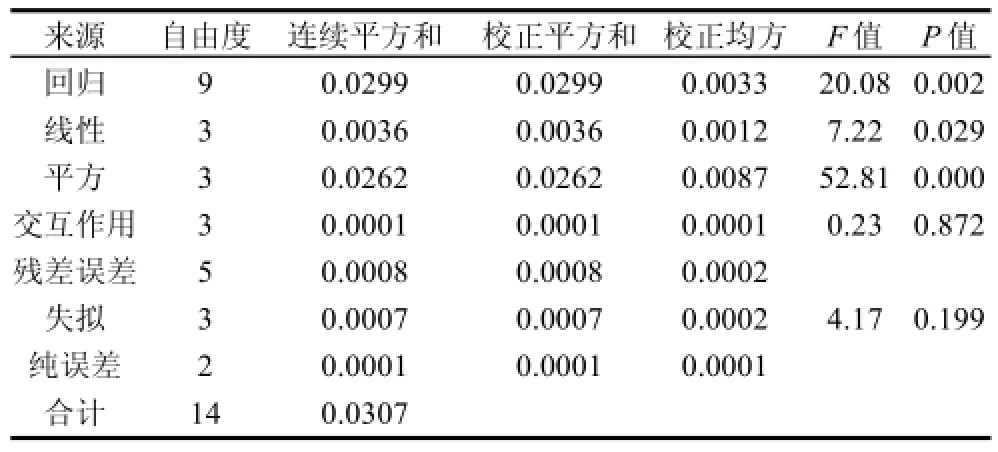
表5 二次回归方程方差分析(ANOVA)Table 5 Analysis of variance of the predictive regression for absorbance at 450 nm of reaction products
由表5可知,在本试验体系中,对应回归项的P值0.002,表明应拒绝原假设,即可以判断本模型总体来说是有效的;失拟项中P值为0.199,大于临界值0.05,表明无法拒绝原假设,可以判定本模型并没有失拟现象。
根据拟合函数,每两个因素对吸光度作出响应面,图5~7直观地反映了各因素对响应值的影响。
由图5可以看出,随着反应时间的延长和加热温度的增加,色素吸光度不断的增大,当反应时间和加热温度升高到一定程度时,吸光度(Y)达到最大;反应时间和加热温度继续升高时,吸光度Y值又会随之下降。说明反应时间过长或过短和加热温度过高或过低都不能使Y值达到最大值,只有它们取到某个适中值时,才可使吸光度达到最大值。
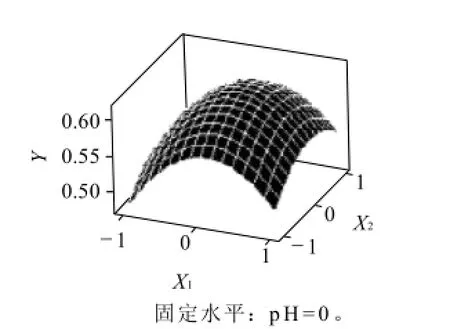
图5 反应温度(X1)和反应时间(X2)对吸光度(Y)的影响Fig.5 Response surface plot showing the effects of temperature and reaction time on absorbance at 450 nm of reaction products
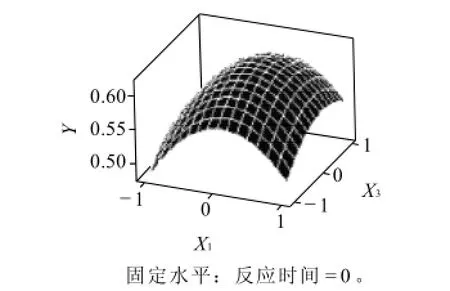
图6 反应温度(X1)和pH值(X3)对吸光度(Y)的影响Fig.6 Response surface plot showing the effects of temperature and pH value on absorbance at 450 nm of reaction products
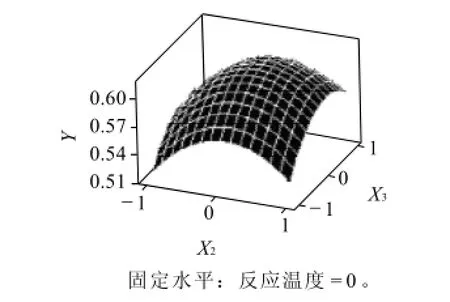
图7 反应时间(X2)和pH值(X3)对吸光度(Y)的影响Fig.7 Response surface plot showing the effects of reaction time and pH value on absorbance at 450 nm of reaction products
由图6可知,当反应温度较低时,pH值的增加对色素的吸光度影响不大。随着反应温度的升高、pH值的增加,色素的吸光度呈先增大后减少的趋势。这可能是因为,在温度较低的时候,亚硝基血红蛋白跟壳聚糖溶液未充分反应,p H值的增加对其反应没有作用,反而增加到一定的程度发生了蛋白质变性,使得其吸光度下降。随着反应温度的升高,两者发生糖基化反应,分子之间形成了稳定的复合物,使其吸光度达到了最大值。温度的持续升高,使反应液的蛋白质发生了变性,使得一部分成为沉淀,从而溶液的吸光度降低,即浓度下降。
由图7可知,当pH值较低时,随着反应时间的增加,吸光度先增大后减小。当pH值较高时,随着反应时间的增加,吸光度先增大后缓慢减小,但是幅度不大。分析原因可能是反应生成的糖基化亚硝基血红蛋白结构较稳定,在最适温度下随着时间的增加其结构不宜破坏,所以吸光度变化的幅度很小。
3 结 论
本实验利用亚硝基血红蛋白与壳聚糖溶液混合后在一定反应温度、反应时间和pH值下反应,由于分子间的相互作用形成了稳定的复合物,通过响应面法优化糖基化亚硝基血红蛋白的制备工艺。糖基化反应亚硝基血红蛋白与壳聚糖质量分数的最适比例为4.16∶1。响应面试验结果表明,回归方程能较好的预测各试验因素与反应产物浓度(吸光度)之间的关系,糖基化亚硝基血红蛋白制备的最佳工艺条件为亚硝基血红蛋白与壳聚糖的质量分数比例4.16∶1、pH5.6、反应温度50.5℃、反应时间15.7min。
[1]NOLLET L M L, TOLDRA F. Advanced technologies for meat processing [M]. CRC Press, 2006∶ 311.
[2]孔保华, 陶菲, 郑冬梅. 腌肉着色剂制备工艺的研究[J]. 食品科学, 2002, 23(8)∶ 197-200.
[3]陈留记, 陈宗道, 金明凤. 蛋白质的糖基化改性研究进展[J]. 食品科学, 1999, 19(4)∶ 14-16.
[4]KATO Y, WATANABE K, SATO Y. Effect of maillard reaction on some physical propertoes of ovalbumin[J]. Food Sci, 1981, 46(6)∶ 1835-1839.
[5]MATSUDOMI N, INOUE Y, NAKASHIMA H, et al. Emulsion stabilization by maillard-type covalent complex of plasma with galactomannan [J]. Journal of Food Science, 1995, 60(2)∶ 265-268.
[6]杨锡洪. 以血红蛋白制备腌制色素替代亚硝酸钠发色的研究[D]. 无锡∶ 江南大学, 2005.
[7]马美湖, 唐进民, 陈长龙, 等. 亚硝基血红蛋白(HbNO)的合成制取及其应用于香肠中降低NO2-残留量的研究[J]. 食品科学, 2001, 22(8)∶67-70.
[8]何平. 糖基化亚硝基血红蛋白的合成及应用研究[D]. 重庆∶ 西南大学, 2008.
[9]齐军茹, 杨晓泉, 彭志英. 蛋白∶ 多糖共价复合作用研究进展[J]. 食品科技, 2003, 24(11)∶ 81-84.
[10]夏延斌. 食品化学[M]. 北京∶ 中国农业出版社, 2004∶ 132-133.
[11]熊拯, 郭兴凤, 谈天. 蛋白质-阴离子多糖相互作用研究进展[J]. 粮食与油脂, 2006(10)∶ 15-17.
[12]秦娇, 姚永红, 侯智霞, 等. 响应面分析法优化毛竹叶挥发油提取工艺[J]. 食品科学, 2010, 31(6)∶ 1-5.
[13]PEGG R.B, SHAHIDI F. A novel titration methodology for elucidation of the structure of performed cooked cured-meat pigment by visible spectroscopy[J]. Food Chemistry, 2002, 56(2)∶ 105-110.
Optimization of Preparation Process for Glycosylated Nitrosohemoglobin
LIU Cheng-guo1,2,CHEN Yao1,WANG Dong-dong1,LUO Yang1
(1. College of Food Science and Technology, Hunan Agricultural University, Changsha 410128, China;2. Hunan Provineial Key Laboratory of Food Science and Biotechnology, Changsha 410128, China)
Nitrosohemoglobin was prepared from porcine hemoglobin and glycosylated with chitosan, which was selected in consideration of thermal stability. The effects of mass ratio of nitrosohemoglobin to chitosan, pH, temperature and reaction time on the glycosylation of nitrosohemoglobin were probed by one-factor-at-a-time method. Subsequently, response surface methodology, based on Box-Benhnken experimental design, was used to optimize pH, temperature and reaction time for achieving maximum absorbance at 450 nm of reaction products. The optimal glycosylation conditions of nitrosohemoglobin were determined as follows∶ mass ratio of nitrosohemoglobin to chitosan, 4.16∶1, pH 5.6, temperature 50.5 ℃ and 15.7 min.
hemoglobin;nitrosohemoglobin;chitosan;glycosylation
TS201.21
A
1002-6630(2011)16-0093-05
2010-10-27
刘成国(1964—),男,副教授,硕士,研究方向为畜产品加工及食品质量控制。E-mail:lcgwei@126.com

