急性热应激对肉仔鸡生长性能及脂肪代谢的影响
刘 梅
热应激是目前影响家禽生产的主要环境因素之一,尤其在发展中国家,热应激带来的损失相当严重。过高的温度会导致肉仔鸡热应激,使其生理机能发生变化和紊乱,表现为采食量下降,轻者生长减慢、抵抗力降低,重者死亡率增加,造成较大的经济损失。商品肉仔鸡对热应激特别敏感,是由于代谢产热随着生长率增加而增加,而散热能力却没有提高[1-2]。热应激可促进肉仔鸡脂肪合成,显著提高其腹脂率,而且高温环境本身直接影响肉仔鸡的生长[3]。热应激影响肉仔鸡的体组成,而在机体的主要组成成分中,体脂是最易变动的,尤其是脂肪组织储存的脂肪[4]。但热应激对各部位脂肪重量的影响还存在很大的争议,本文旨在通过研究热应激对肉仔鸡生长性能、血清生化指标以及脂肪代谢的影响,探讨急性热应激给动物带来的规律性变化,为防止和缓解热应激提供理论基础。
1 材料与方法
1.1 试验动物与试验设计
将 28日龄经过常规免疫、健康、体重相近的爱拔益加(AA)肉仔鸡 120只,随机分成 3组:急性热应激组、对照组和饲粮配对组,每组 4个重复,每个重复 10只鸡。急性热应激组:自由采食,室温(35±1)℃;对照组:自由采食,室温(22±1)℃;饲粮配对组按高温组前 1天的采食量饲喂,室温(22±1)℃。鸡舍用排气扇进行纵向通风,用加热器和空调控制温度,相对湿度控制在(50±5)%,试验期 7 d(28~34日龄)。基础饲粮参照美国 NRC(1998)肉仔鸡营养需要配制,基础饲粮组成及营养水平见表 1。
1.2 饲养管理
各组饲养管理方式一致。试验期间 24 h光照,自由采食,自由饮水。免疫和消毒按常规程序进行。
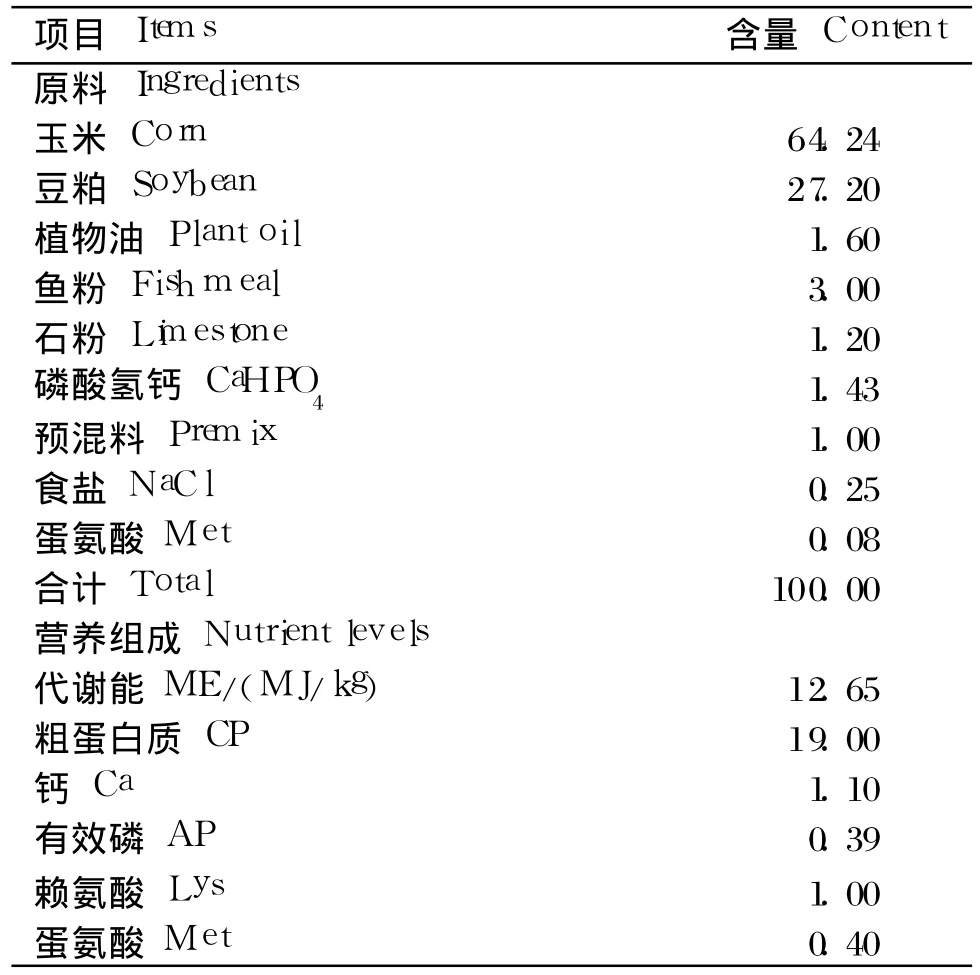
表1 基础饲粮组成及营养水平(风干基础)Table 1 Composition and nutrient levels of basal diet(air-dry basis) %
1.3 测定指标
1.3.1 生长性能的测定
每天记录各重复的耗料量,并于 35日龄时对试验肉仔鸡进行空腹称重,计算各组的平均日增重(ADG)、平均日采食量(ADFI)和料重比(F/G)。
1.3.2 样品采集
在 35日龄 08:00于每组的每个重复中选取1只接近平均体重的鸡,翅静脉采血 5 mL,3 000 r/min离心 15 min(800型离心机,上海)制备血清,装于1.5 mL的 eppendorf管中,置 -20℃冰箱中保存备用。血清甘油三酯(TG)和总胆固醇(TC)含量均采用终点法[5-6]测定,游离脂肪酸(FFA)含量采用比色法测定(具体操作参照南京建成生物工程研究所生产的试剂盒说明书),高密度脂蛋白胆固醇(HDL-C)含量采用磷钨酸 -Mg2+法测定,低密度脂蛋白胆固醇(LDL-C)含量采用肝素 -柠檬酸钠沉淀法测定(具体操作参照南京建成生物工程研究所生产的试剂盒说明书进行)。屠宰取肝脏、腹脂(腹部与肌胃及肠系膜周围的脂肪)、颈皮下脂肪(颈部皮下及嗉囊周围的脂肪)、腿皮下脂肪(臀股二头肌周围及腹股沟内的脂肪)、胸肉、腿肉称重,取腹脂、颈皮下脂肪和腿皮下脂肪样品再投入液氮中至分析。
1.3.3 腹脂、颈皮下脂肪和腿皮下脂肪的测定
鸡屠宰后,剥离腹部脂肪和肌胃周围脂肪(肠脂不易剥离,故不计算在内),称重。计算脂肪的相对重量。腹脂相对重量(%)=(腹脂重/活体重)×100;颈皮下脂肪相对重量(%)=(颈皮下脂肪重/活体重)×100;腿皮下脂肪相对重量(%)=(腿皮下脂肪重 /活体重)×100。
1.3.4 脂肪酸合成酶(FAS)活性的测定
将肝脏和脂肪组织在冰冷的匀浆缓冲液中匀浆(组织和匀浆缓冲液的比例是 1∶2),然后在冷冻超速离心机中 100 000×g 4℃离心 1 h,取上清液用于分析 FAS和苹果酸酶的活性。FAS活性测定参照Halestrap等[7]的方法 。
用 0.1mol/L磷酸缓冲液(pH 6.5)配制反应液,其中含有 NADPH 0.1mmol/L、乙酰辅酶 A 25μmol/L。
取 1 000μL的上述反应液,在 37℃水浴中预温 4 min,加入上清酶液 100μL,最后迅速加入1.38 mmol/L的丙二酰辅酶 A 50μL。在 0.5 cm光径的石英比色皿中,340 nm波长下,测定 1 min内吸光度的变化。
FAS活性 =[(测定管吸光度的变化 -空白管吸光度的变化)/(6.2×0.5)]×(反应液总体积/取样量)×1 000/样本蛋白含量。
式中,6.2:底物的微摩尔消光系数;0.5:比色皿的比色光径;反应液总体积:1 150μL;取样量:100μL;样本蛋白含量(mg/mL):考马斯亮蓝法。
FAS的 1个酶活力单位:每 mg组织蛋白在该反应体系中 1 min内催化 1 nmol底物(NADPH)转变成产物 (NADP+)的量定义为 1个酶活力单位。
1.3.5 苹果酸酶活性的测定
参照 Hsu等[8]方法。用 50 mmol/L的 HEPES缓冲液(pH 7.5)配制反应液,其中含有 1 mmol/L NADP和 10 mmol/L MgSO4。
取 1 000μL的上述反应液,在 37℃水浴中预温 4 min,加入上清酶液 50μL,最后迅速加入 L-苹果酸盐(44 mmol/L)50μL。在 0.5 cm光径的石英比色皿中,340 nm波长下,测定 1 min内吸光度的变化。
苹果酸酶活性 =[(测定管吸光度的变化 -空白管吸光度的变化)/(6.2×0.5)]×(反应液总体积/取样量)×1 000/样本蛋白含量。
式中,6.2:底物的微摩尔消光系数;0.5:比色皿的比色光径;反应液总体积:1 100μL;取样量:50μL;样本蛋白含量(mg/mL):考马斯亮蓝法。
苹果酸酶的 1个酶活力单位:每 mg组织蛋白在该反应体系中 1 min内催化 1 nmol底物(NADP)转变成产物(NADPH)的量定义为 1个酶活力单位。
1.3.6 FAS、乙酰辅酶 A羧化酶(ACC)和脂蛋白脂酶(LPL)基因 mRNA表达的测定
TRIZOL法提取总 RNA后,用 Oligo(dT)引物和 AMV反转录酶进行反转录,RT-PCR反应体系为 SYBR Premix Ex Taq,上、下游引物和 cDNA模板,以 18S rRNA为内参,反应程序为:95℃变性 10 s,95℃退火 5 s,60℃延伸 34 s。脂肪代谢相关酶基因的引物序列见表 2。

表2 脂肪代谢相关酶基因的引物序列Table 2 Gene-specific primer of the lipid metabolism related enzyme
1.4 统计分析
采用 SPSS 11.5统计处理软件进行数据方差分析,试验结果采用平均值 ±标准差表示。
2 结果与分析
2.1 急性热应激对肉仔鸡生长性能的影响
急性热应激对肉仔鸡生长性能的影响见表 3。与对照组相比,急性热应激组 AA肉仔鸡的平均日采食量和平均日增重分别显著下降 33.84%、65.01%(P<0.05),料重比增加 89.14%(P<0.05)。同时,与饲粮配对组相比,急性热应激组的平均日增重降低 28.29%(P>0.05),料重比增加 42.27%(P>0.05)。

表3 急性热应激对肉仔鸡生长性能的影响Table 3 Effects of acute heat stress on growth performance of broilers
2.2 急性热应激对肉仔鸡脂肪沉积的影响
由表 4可知,与对照组比较,急性热应激组肝脏的相对重量(肝脏重/体重)显著增加 (P<0.05),腹脂、颈皮下脂肪的相对重量显著增加(P<0.05),同时腿皮下脂肪相对重量有增加的趋 势(P>0.05)。

表4 急性热应激对肉仔鸡肝脏和脂肪组织相对重量的影响Table 4 Effects of acute heat stress on the relative weight of liver and fat of broilers
2.3 急性热应激对肉仔鸡血清生化指标的影响
由表 5可知,急性热应激对血清中 FFA和 TC的含量均无显著影响(P>0.05),但显著增加了TG、HDL-C和 LDL-C的含量 (P<0.05);对照组与饲粮配对组相比均无显著差异(P>0.05)。
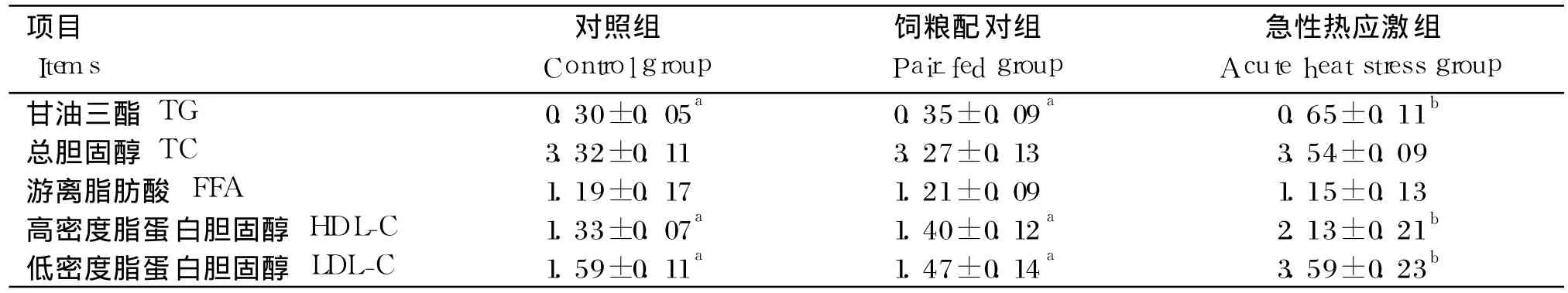
表5 急性热应激对肉仔鸡血清生化指标的影响Table 5 Effects of acute heat stress on serum biochemical indices of broilers mmol/L
2.4 急性热应激对肉仔鸡肝脏和脂肪组织脂肪酸从头合成酶活性的影响
如图 1和图 2所示,急性热应激对肝脏 FAS和苹果酸酶的活性具有显著影响(P<0.05),但对腹脂中的 FAS和苹果酸酶的活性均无显著影响(P>0.05)。
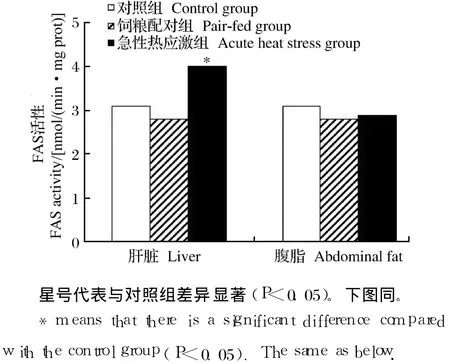
图1 急性热应激对肉仔鸡 FAS活性的影响Fig.1 Effects of acute heat stress on FASactivity of broilers
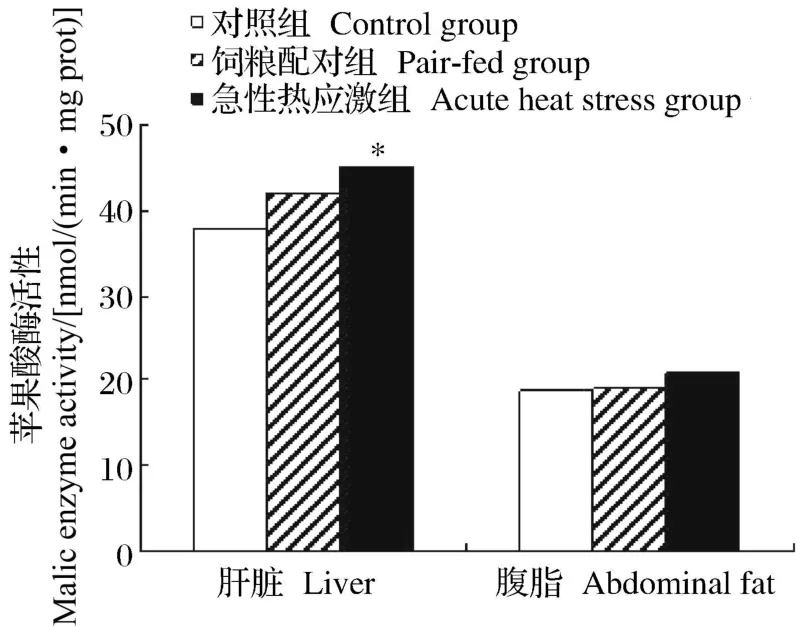
图2 急性热应激对肉仔鸡苹果酸酶活性的影响Fig.2 Effects of heat stress on malic enzyme activity of broilers
2.5 急性热应激对肉仔鸡肝脏和脂肪组织脂肪代谢有关酶基因 mRNA相对表达水平的影响
如图 3所示,急性热应激显著增加了肝脏 ACC和 FAS基因的 mRNA相对表达水平(P<0.05),同时显著降低了 LPL基因的 mRNA相对表达水平(P<0.05)。如图 4所示,急性热应激只显著增加了腹脂中 FAS基因的 mRNA相对表达水平(P<0.05),而腹脂中的 ACC基因的 mRNA相对表达水平并未受到热应激的显著影响(P>0.05)。
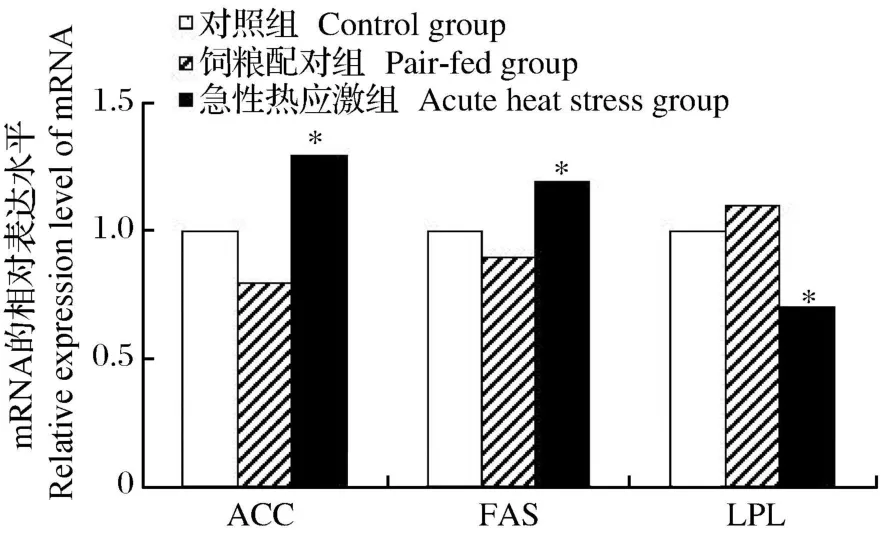
图3 急性热应激对肉仔鸡肝脏脂肪代谢基因表达的影响Fig.3 Effects of acute heat stress on lipid metabolism gene expression in the liver of broilers
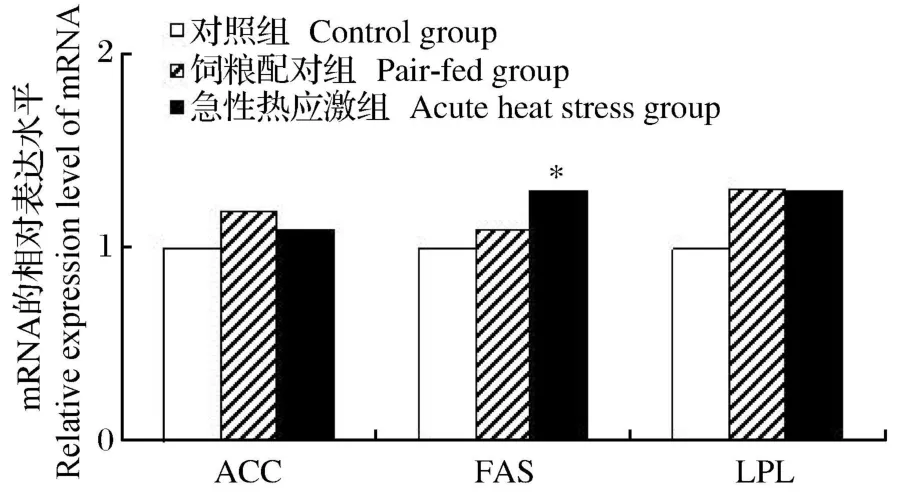
图4 急性热应激对肉仔鸡腹脂中脂肪代谢基因表达的影响Fig.4 Effects of acute heat stress on lipid metabolism gene expression in the abdominal fat of broilers
3 讨 论
3.1 急性热应激对肉仔鸡生长性能的影响
家禽采食量的调控有温热恒定机制和化学恒定机制 2种。当高热条件下,温热恒定机制对采食量的控制主要表现为采食量与环境温度呈负相关,高温可直接作用于下丘脑的摄食中枢,降低其兴奋性;另外,消化道交感神经的兴奋使消化道活动减弱,导致消化道食物的充盈,同时为减轻热负荷,鸡的饮水量增加,这 2种因素会压迫消化道机械感受器而抑制食欲。化学恒定机制是养分在消化道吸收和养分在血液中出现可构成一系列原始信号,这些信号作用于下丘脑的饱觉中枢,增强其兴奋性[2,9]。
热应激降低肉仔鸡采食量已为大家所承认,但对饲料利用效率的影响尚有争议。多数学者认为高温环境降低饲料利用效率,但也有相反的结论,这可能与肉仔鸡的品种、年龄、性别及环境温度有关。在本研究中,热暴露 1周后 AA肉仔鸡的平均日采食量下降了 33.84%,进一步说明了在高温环境下家禽采食中枢的兴奋性受到部分抑制,导致采食量下降。王启军等[10]的研究表明,热暴露 3周后北京油鸡的平均日采食量下降了 22.28%,高温环境下北京油鸡的平均日增重没有显著变化,但饲料转化率显著升高。本研究高温环境显著降低了 AA肉仔鸡的平均日增重和料重比,这说明热应激对不同基因型肉仔鸡的影响不同。可能是慢速生长型肉仔鸡比快速生长型肉仔鸡更耐高温。
3.2 急性热应激对肉仔鸡脂肪代谢的影响
多数研究表明,热应激在降低生长的同时还有增加脂肪沉积的趋势[10-11]。Ain Baziz[12]研究了环境温度为 32℃时对 4~7周龄艾维茵肉仔鸡腹脂、皮下脂肪和肌间脂肪沉积的影响,发现此温度下这3部分脂肪的沉积率分别增加 15%、21%、22%(以活体重计)。本研究发现,AA肉仔鸡在高温环境条件下脂肪沉积增加主要表现在腹部和肝脏比重增加。
血清 FFA主要来源于体内脂肪组织中甘油三酯的分解[11]。肉仔鸡体脂的沉积绝大多数来源于肝脏,而脂肪组织的发育取决于血清中能利用的甘油三酯的水平。本研究表明,急性热应激对血清中FFA含量没有显著影响,但显著增加了 TG、HDL-C和 LDL-C的含量,对照组与饲粮配对组相比没有显著差异。
从乙酰辅酶 A和丙二酰辅酶 A合成长链脂肪酸实际上是一个重复加成的过程,每次延长 2个碳原子。FAS就是催化该加成反应的酶,它是由 7种酶蛋白聚合在一起构成的多酶体系,在高等动物,这7种酶活性都在 1条多肽链上,属多功能酶,由 1个基因所编码[13]。FAS在动物体脂生成、沉积中发挥重要作用。有关研究表明高温对 FAS的活性有直接影响[14]。本试验中,急性热应激显著增加了肝脏FAS和苹果酸酶的活性及 FAS基因的 mRNA相对表达水平,从而促进了肝脏的脂肪酸合成。急性热应激对腹脂 FAS和苹果酸酶的活性没有显著影响。
血液中的甘油三酯要被其他组织重新利用,首先必须水解为 FFA,而催化这一反应的酶就是 LPL。LPL对脂肪沉积具有反作用。LPL脂解进入血液中的乳糜微粒和极低密度脂蛋白(VLDL)中的 TG,TG在 LPL作用下分解为甘油和脂肪酸,LPL进一步引导脂肪酸进入脂肪组织,重新酯化成脂肪并贮存起来,LPL活性是在最后阶段控制鸡脂肪组织增长的[15-16]。本试验结果表明,急性热应激组肝脏LPL基因的 mRNA相对表达水平显著降低,不能有效降解血清中的 TG,其变化与血脂变化一致。而在脂肪组织中,急性热应激组LPL基因的 mRNA相对表达水平有所增加,从而使脂肪酸在脂肪组织沉积。
4 结 论
①急性热应激情况下,AA肉仔鸡的平均日采食量、平均日增重下降,料重比增加,表明急性热应激可导致生长性能下降。
②急性热应激也影响了 AA肉仔鸡的脂肪代谢,使血清 TG、HDL-C和 LDL-C含量上升,肝脏中FAS和 ACC基因的 mRNA的相对表达水平增加,而 LPL基因的mRNA的相对表达水平下调,即意味着脂肪代谢过程中的脂肪沉积增加。
[1] CAHANER A,DEEB B,YUNIS R,et al.Reduced stress tolerance in fast growing broilers[C]//Proceeding of 10th European poultry conference.Jerusalem,Israel:[s.n.],1998,1:113-117.
[2] 刘梅,史挺.夏季家禽防热应激的措施[J].中国禽业导刊,2010(9):51.
[3] 林海.热应激家禽的营养与饲养措施[J].中国家禽,2008,30(13):28-31.
[4] 任延利,齐德生.热应激对家禽的影响及其营养防治措施[J].饲料工业,2008,29(13):8-10.
[5] GALLAHER C,MUNION J,HESSLINK R,et al.Cholesterol reduction by glucomannan and chitosan is mediated by changes in cholesterol absorption and bile acid and fat excretion[J].Nutrition,2000,130:2753-2759.
[6] 王述柏,王宝维,张丽英,等.新型添加剂——壳聚糖对肉鸡肌肉中胆固醇影响的研究[J].饲料研究,1998(5):9-10.
[7] HALESTRAP A P,DENTON R M.Insulin and the regulation of adipose tissue acetyl coenzyme A carboxylase[J].Biochemical Journal,1973,105:529-536.[8] HSUR Y,LARDY H A.Malic enzyme[J].Methods Enzymology,1969,13:230-235.
[9] 王怀蓬,乌日娜,孙镇平,等.热应激对肉鸡生产性能的影响[J].养禽与禽病防治,2008(7):20-21.
[10] 王启军,卢庆萍,张宏福.高温环境对北京油鸡生产性能及脂肪沉积的影响[J].广东饲料,2006,15(6):38-40.
[11] 贺喜,戴求仲,张石蕊,等.日粮共轭油酸对两个品种肉仔鸡生长性能及脂类代谢的影响[J].动物营养学报,2007,19(5):581-587.
[12] AIN BAZIZ H,GERAERT P A,GUILLAUMIN S.Chronic heat exposure enhances fat deposition and modifies muscle and fat partition in broiler carcasses[J].Poultry Science,1996,75:505-513.
[13] 宋庆文.动物脂肪代谢过程中关键酶的研究进展[J].畜牧与饲料科学,2007(3):58-60.
[14] KOUBA M,HERMIER D,LE DIVIDICH J.Influence of ahigh ambient temperature on lipid metabolism in the growing pig[J].Journal of Animal Science,2001,79(1):81-87.
[15] GOLDBERG I J.Lipoprotein lipase and lipolysis:central roles in lipoprotein metabolism and atherogenesis[J].Journal of Lipid Research,1996,37:693-707.[16] OLIVECRONA T,BENGTSSON-OLIVECRONA G.Lipoprotein lipase and hepatic lipase[J].Current O-pinion in Lipidology,1993,4:187-196.

