不同来源微量元素铁、锌、锰、铜对罗非鱼生长、代谢和非特异性免疫力的影响
林仕梅 潘 瑜 罗 莉 马 霞 詹若蕊 毛述宏
微量元素是动物维持生命和生产必不可少的营养素之一,在动物饲料中含量虽少,但它们直接或间接地参与机体几乎所有生理和生化过程,与动物生长和健康密切相关。微量元素缺乏或过量都会导致动物生物化学的、结构的和功能性的病理学变化[1-2]。当今对微量元素的认识,无论是从动物种类上、微量元素形式上,还是微量元素供给量以及比例上都有巨大的变革和突破,它对动物的生长、繁殖、免疫、抗病、体形、体色以及肉质等都会产生较大的影响[2-4]。影响微量元素生物利用率的因素很多,如动物机体的生理状态、微量元素的化学形式和数量以及饲料中存在的一些抗营养因子[5-6]。动物对微量元素利用的高低还取决于其吸收状况,而微量元素的形式是影响其吸收
和利用的主要因素之一。通常,水产饲料中都是以无机盐形式补充微量元素。无机盐形式的微量元素存在着难吸收、生物利用率低、生化功能差和对环境污染大的缺点。氨基酸微量元素具有结构稳定、分子量低、易吸收、生物学效价高等特点[7-8],已引起动物营养学家和饲料生产者的高度关注[9-10],并已广泛地应用到畜禽饲料工业中[4,7,11],而在水产饲料中相关的研究报道较少,少量的报道也仅局限在单一的氨基酸微量元素上[12-13],有关复合氨基酸微量元素的研究则未见报道。为此,本试验以吉富罗非鱼(Oreochromis niloticus)为试验对象,在实用饲料配方的基础上,探讨氨基酸微量元素对罗非鱼生长、代谢和非特异性免疫力的影响,以期为氨基酸微量元素在水产饲料中的科学应用提供理论依据。
1 材料与方法
1.1 试验饲料
微量元素铁 (Fe)、锌(Zn)、锰 (Mn)、铜 (Cu)分别以无机微量元素、氨基酸微量元素和氨基酸微量元素组合体形式添加到吉富罗非鱼实用饲料(粗蛋白质 32%,总能 14 MJ/kg)中,组成3种试验饲料,其中无机微量元素为 FeSO4◦H2O、ZnSO4◦ H2O、MnSO4◦ H2O、CuSO4◦ 5H2O,均为饲料级,由成都蜀星饲料有限公司提供;氨基酸微量元素为氨基酸螯合铁[Fe 15%(15.42%),氨基酸(AA)30%]、氨基酸螯合锌 [Zn 15%(15.46%),AA 30%]、氨基酸螯合锰[Mn 10%(10.11%),AA 20%]、氨基酸螯合铜[Cu 15%(15.35%),AA 30%],由施普诺生物技术(成都)有限公司提供,括号内为实测值;氨基酸微量元素组合体为氨基酸与 Fe、Zn、Mn、Cu螯合的组合体,即按比例称取微量元素混匀后,与氨基酸进行螯合反应配制而成,其中 Fe 8.98%、Zn 4.18%、Mn 1.46%、Cu 0.24%,均为实测值,由施普诺生物技术(成都)有限公司提供。
试验饲料 1(无机组)中微量元素 Fe、Zn、Mn、Cu的添加量分别为 160、80、28、4 mg/kg,试验饲料 2(有机组)和 3(有机组合体组)中 Fe、Zn、Mn、Cu添加量均为试验饲料 1添加量的 50%,即分别为 80、40、14、2 mg/kg。 3种试验饲料中 Fe、Zn、Mn、Cu保持相同的比例 ,即均为 40∶20∶7∶1。此外,以不添加微量元素 Fe、Zn、Mn、Cu的试验饲料为对照饲料。试验饲料组成及营养水平见表 1。饲料原料均为符合国家卫生标准的饲料级原料,饲料原料均粉碎过 40目筛,饲料调质温度为80℃,分别制成直径为 2.5 mm的硬颗粒饲料,60℃烘干后保存于 -15℃冰柜中备用。
1.2 饲养管理
试验鱼选用当年培育的全雄性吉富罗非鱼鱼苗,取自重庆璧山县鱼种场。驯食适应环境 10 d后,选取体质健壮、规格整齐、平均体重为(27.2±0.1)g的吉富罗非鱼 360尾,随机分成4组,每组设 3个重复,每个重复 30尾鱼,以重复为单位饲养在室内淡水循环玻璃水族箱(有效体积为 250 L)中。日投喂率为体重的 4% ~6%,每天 08:30、12:30和 17:30各投喂 1次,每 2周称重 1次,根据体重调整投饲量。每天早上清除箱内粪便,并换水 1/4。饲养时间为 8周。养殖水源为曝气自来水,试验期间定时对水质进行监控,养殖全程水温为(27.8±2.2)℃,pH为 7.4±0.4,溶解氧 >6.5 mg/L,氨氮 <0.50 mg/L,亚硝酸盐 氮 <0.06 mg/L。
1.3 指标测定与方法
饲养试验结束,禁食 24 h后称重,计算特定生长率、成活率、蛋白质效率和饲料系数;每箱取 3尾鱼作为全鱼样品,用于体组成的测定;每箱取 3尾鱼于尾静脉取血,置 4℃冰箱过夜,于 4℃条件下以 6 000 r/min离心 10 min,收集血清,-20℃保存备用;每箱取 3尾鱼采用捣毁脊髓法处死,取出肝胰脏,立即放入液氮罐中速冻,然后转入-80℃低温冰箱保存。肝胰脏匀浆液在 10 000×g 4℃条件下离心 30 min,取上清液作为酶活性分析样品,-20℃保存备用。
饲料原料及鱼体样品均在 105℃烘干至恒重,然后进行营养成分测定。采用凯氏定氮法测定样品的总氮含量,将测定结果乘以 6.25即得粗蛋白质含量,粗脂肪含量采用索氏抽提法测定,粗灰分含量采用高温(550℃)灰化法测定[14]。
肝胰脏谷草转氨酶(GOT)、谷丙转氨酶(GPT)、总超氧化物歧化酶(T-SOD)、铜锌超氧化物歧化酶(CuZn-SOD)以及血清过氧化氢酶(CAT)、碱性磷酸酶(AKP)和溶菌酶活性均采用南京建成生物工程研究所生产的试剂盒进行测定。GOT、GPT的活性单位定义为每毫克组织蛋白质与基质在 37℃下作用 60 min,生成 1μmol丙酮酸所需要的酶为 1个卡门氏单位;T-SOD、CuZn-SOD的活性单位定义为每毫克组织蛋白质在 1 mL反应液中超氧化物歧化酶(SOD)抑制率达 50%时所反应的SOD量为 1个国际单位(U);CAT的活性单位定义为 25℃、p H 7.0条件下,每分钟分解 1μmol CAT所需的酶的量为 1个国际单位;AKP的活性单位定义为 100 mL血清在 37℃与底物作用 15 min产生 1 mg酚所需要的酶的量为 1个金氏单位;溶菌酶的活性单位定义为每分钟吸光值减少 0.001所需血清的量为 1个国际单位。组织中蛋白质含量采用Bradford[15]方法测定。
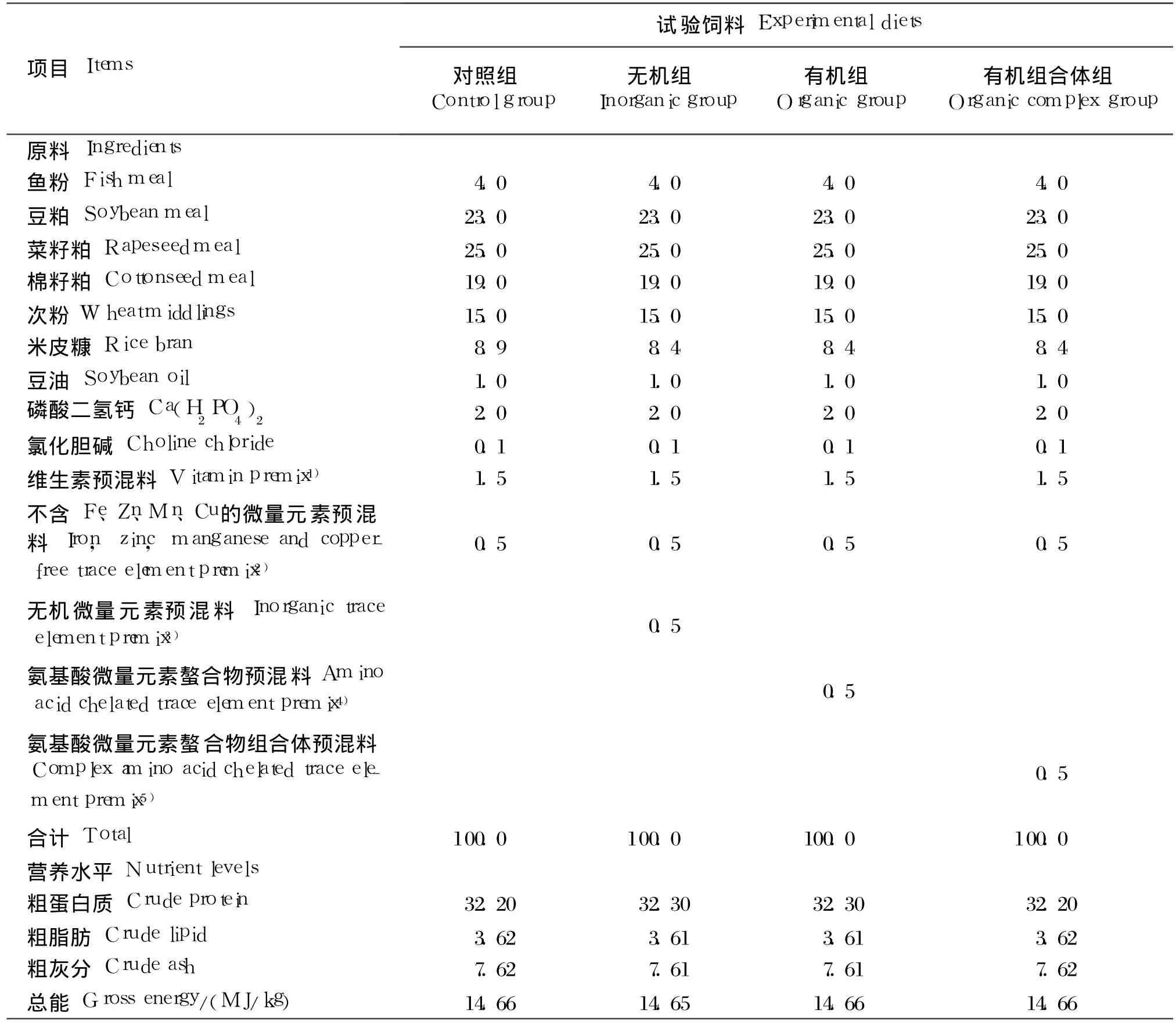
表1 试验饲料组成及营养水平(风干基础)Table 1 Composition and nutrient levels of experimental diets(air-dry basis) %
1.4 计算公式
特定生长率(specific growth rate,SGR,%d)=100×[ln末重(g)-ln初重(g)]/试验天数(d);
蛋白质效率(protein efficiency ratio,PER,%)=100×鱼体增重(g)/蛋白质摄人量(g);
饲料系数(feed conversion ratio,FCR)=总干物质摄食量(g)/鱼体总增重(g);
成活率(survival rate,SR,%)=100×终末鱼尾数 (只)/初始鱼尾数(只)。
1.5 数据处理与分析
数据均以平均值表示,采用 SPSS 11.0对所得数据进行单因素方差分析(One-way ANOVA),若差异达到显著,则进行 Tukey多重比较,显著性水平为 P<0.05。
2 结果与分析
2.1 不同来源微量元素 Fe、Zn、Mn、Cu对罗非鱼生长性能的影响
由表 2可知,饲料中补充不同来源的微量元素Fe、Zn、Mn、Cu后,罗非鱼的末重 、SGR均显著升高(P<0.05),同时有机组和有机组合体组罗非鱼的末重、SGR均显著高于无机组(P<0.05)。各组罗非鱼的 PER表现出与 SGR相同的趋势。此外,有机组罗非鱼的末重、PER均显著高于有机组合体组(P<0.05)。罗非鱼的 FCR与 PER表现出相反的趋势,即对照组 >无机组 >有机组合体组 >有机组,各组间差异均达到显著水平(P<0.05)。试验期间,各组罗非鱼的成活率均为 100%。
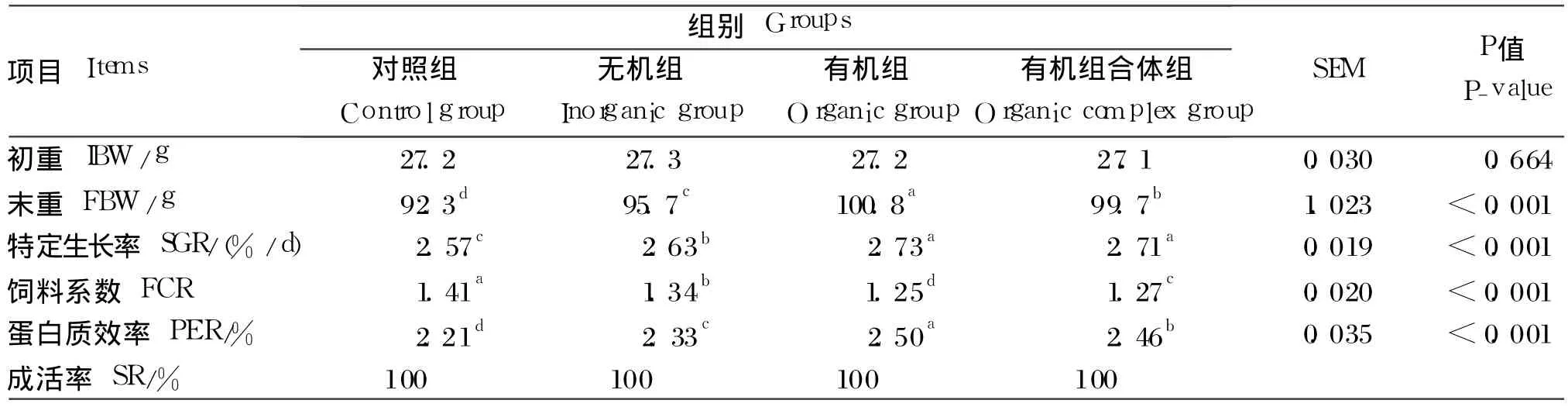
表2 不同来源微量元素 Fe、Zn、Mn、Cu对罗非鱼生长性能的影响Table 2 Effects of different sources of iron,zinc,manganese and copper on growth performance of tilapia
2.2 不同来源微量元素 Fe、Zn、Mn、Cu对罗非鱼体组成的影响
由表 3可知,不同来源微量元素 Fe、Zn、Mn、Cu对罗非鱼鱼体干物质、粗蛋白质、粗脂肪和粗灰分含量以及肥满度的影响均无显著差异(P>0.05)。
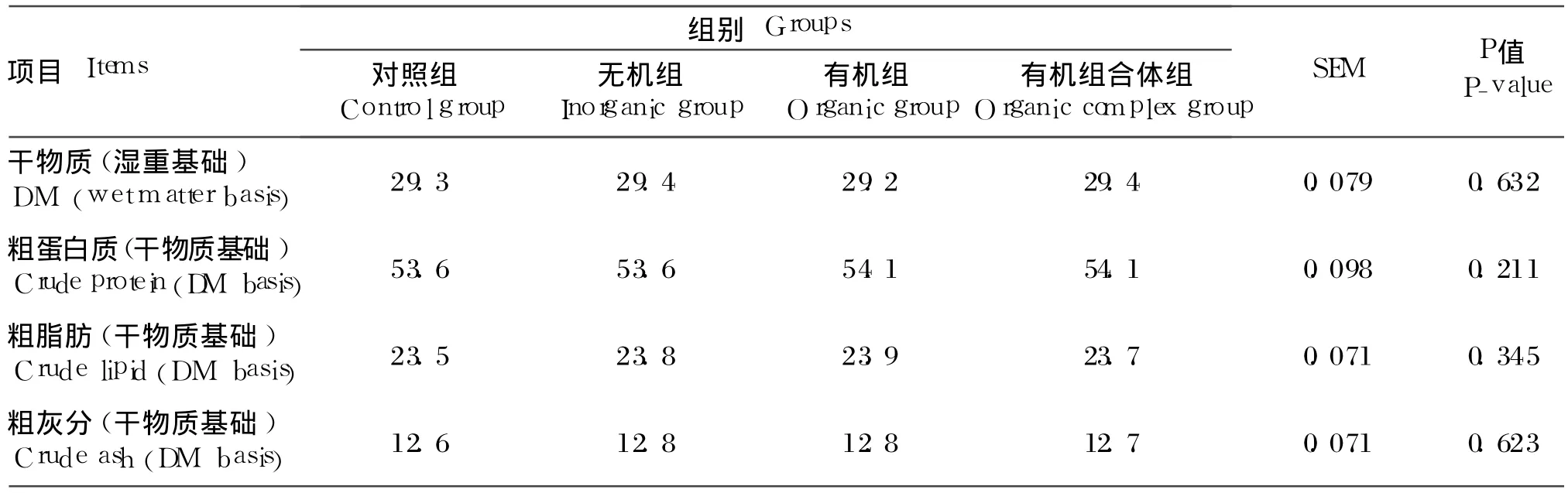
表3 不同来源微量元素 Fe、Zn、Mn、Cu对罗非鱼体组成的影响Table 3 Effects of different sources of iron,zinc,manganese and copper on body composition of tilapia %
2.3 不同来源微量元素 Fe、Zn、Mn、Cu对罗非鱼肝胰脏代谢酶活性的影响
由表 4可知,饲料中补充不同来源的微量元素Fe、Zn、Mn、Cu后,罗非鱼肝胰脏 GPT和 GOT活性显著升高(P<0.05)。罗非鱼肝胰脏 GPT活性表现为:对照组 <无机组 <有机组合体组 <有机组,各组间差异均达到显著水平(P<0.05)。各组罗非鱼的 GOT表现出与 GPT相同的趋势,但有机组合体组与有机组间差异不显著(P>0.05)。
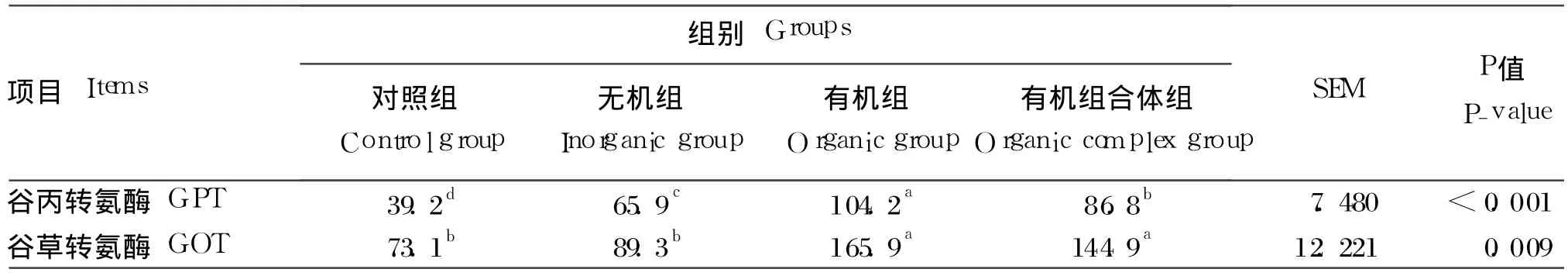
表4 不同来源微量元素 Fe、Zn、Mn、Cu对罗非鱼肝胰脏代谢酶活性的影响Table 4 Effects of different sources of iron,zinc,manganese and copper on the metabolic enzyme activities in hepatopancreas of tilapia 卡门氏单位/mg
2.4 不同来源微量元素 Fe、Zn、Mn、Cu对罗非鱼非特异性免疫指标的影响
由表 5可知,饲料中补充微量元素 Fe、Zn、Mn、Cu后,罗非鱼肝胰脏 T-SOD、CuZn-SOD和血清的CAT、AKP、溶菌酶活性均显著升高(P<0.05)。有机组罗非鱼肝胰脏 T-SOD活性最高,其次是有机组合体组,随后是无机组,对照组最差。罗非鱼肝胰脏CuZn-SOD活性以有机组合体组最高,其次是有机组,随后是无机组,对照组最差。罗非鱼血清 CAT活性表现为:对照组 <无机组 <有机组合体组 <有机组,各组间差异均达到显著水平(P<0.05)。有机组合体组与有机组罗非鱼血清 AKP和溶菌酶活性均显著高于无机组和对照组(P<0.05),但无机组与对照组间以及有机组合体组与有机组间均差异不显著(P>0.05)。
3 讨 论
本试验结果表明,氨基酸微量元素能够显著改善罗非鱼的生长,是罗非鱼饲料中最有效的微量元素补充形式,这与在虹鳟、斑点叉尾鮰上的研究结果一致[12-13,16]。众所周知,微量元素 Fe、Zn、Mn、Cu是人类和动物生长的必需营养素。Zn缺乏明显抑制胰岛素样生长因子 -Ⅰ(IGF-Ⅰ)、受体生长激素和生长激素结合蛋白 mRNA的表达[17-18]。像IGF-Ⅰ一样,Zn能够促进骨胶原蛋白的合成,继而刺激骨骼的生长[19-20]。补 Zn能显著提高 IGF-Ⅰ基因表达水平,与 ZnSO4相比,蛋氨酸锌更大幅度地提高 IGF-Ⅰ mRNA表达,从而有效地促进小鼠生长[21]。本试验中氨基酸微量元素的供给量仅为无机盐微量元素的 50%,却能够显著促进罗非鱼的生长。Paripatananont等[12]的试验也证明,当用蛋氨酸锌代替 ZnSO4时,可使斑点叉尾鮰饲料中 Zn的需要量减少 70%。微量元素螯合物中的金属离子在配位体(如氨基酸)的保护下,可有效地抵御与其他离子生成难溶的无机盐,缓解矿物质间的拮抗竞争作用,从而减少了营养物质的损失,增强了其吸收利用的程度。此外,氨基酸微量元素既是机体吸收金属离子的主要形式,又是动物体内合成蛋白质过程中的中间物质,所以氨基酸微量元素不仅吸收快,而且可以节省许多生化过程,节约体能消耗[22],这些因素致使氨基酸微量元素比无机微量元素具有更高的生物学效价。在其他动物如猪[23]、鸡[24-25]、山羊[11]、鲍鱼[26]上也有类似的研究报道。
以天然饲料来构成动物饲料往往缺乏 1种或数种微量元素,需要在饲料中额外添加。本试验结果表明,饲料中补充微量元素后罗非鱼的生长性能得到显著的改善。这说明罗非鱼饲料中补充微量元素是非常必要的。微量元素生物利用率的研究多集中在无机微量元素方面,而有关有机微量元素或饲料中微量元素生物利用率的研究报道则较少。本试验中,氨基酸微量元素的添加量仅为无机微量元素的50%,却能显著提高罗非鱼的生长,说明有机微量元素的利用率高于无机微量元素。再者,有机微量元素产品价格较高,而且对这类有机产品的化学特性还缺乏一种行之有效的检测方法,如产品螯合率的定量测定,这些因素限制了其研究和应用。因此,无论从提高鱼类生产的效益,还是从环境保护角度来讲,以氨基酸(肽)微量元素作为水产动物饲料添加剂,具有广阔的应用前景,深入研究适合动物机体的最佳螯合物结构形式、最佳添加比例以及氨基酸(肽)微量元素的作用机制也是非常迫切的。
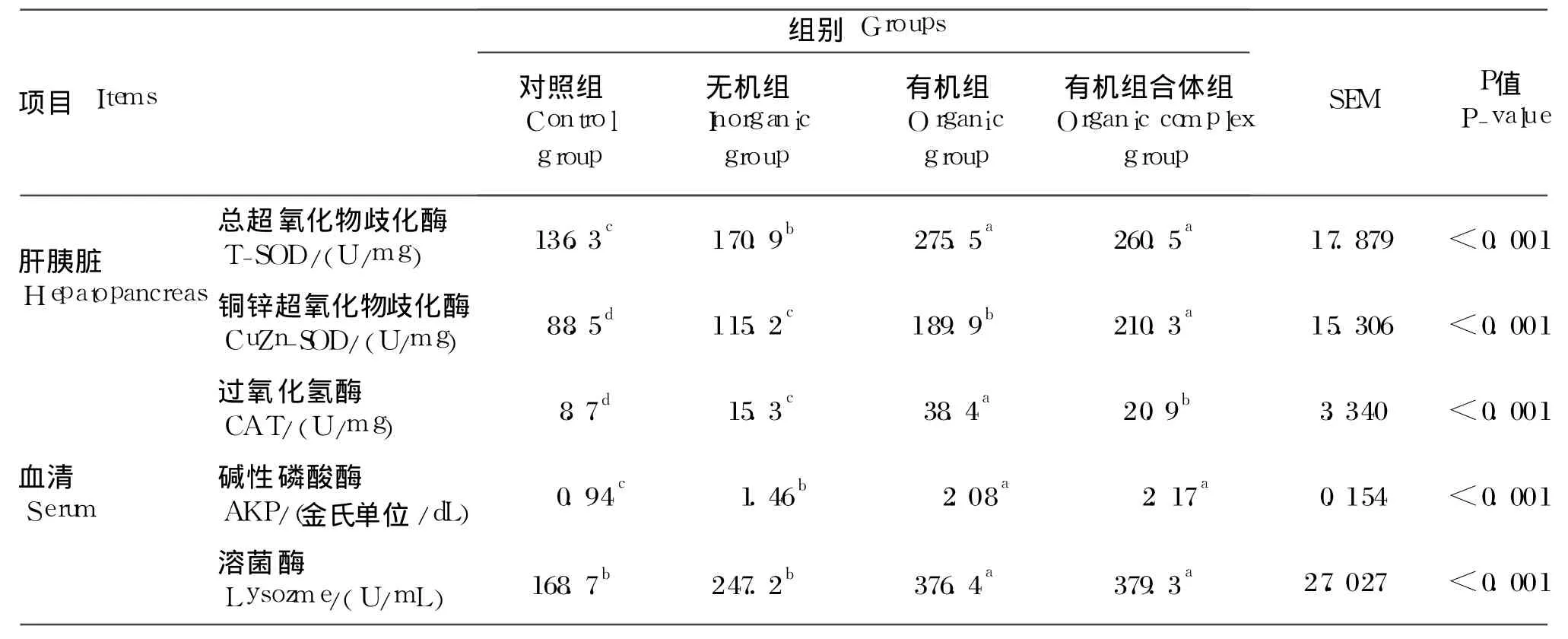
表5 微量元素 Fe、Zn、Mn、Cu对罗非鱼非特异性免疫指标的影响Table 5 Effects of different sources of iron,zinc,manganese and copper on non-specific immune indices in tilapia
目前,氨基酸微量元素的研究仅局限在单一氨基酸的单一微量元素螯合物方面[12-13]。本试验探讨了复合氨基酸微量元素 (Fe、Zn、Mn、Cu)对罗非鱼生长的影响,国内外还未见这方面的研究报道。结果表明,罗非鱼的生长效果得到显著改善。一方面可能是复合氨基酸微量元素减轻或避免了微量元素间拮抗竞争作用,并且氨基酸(肽)的微量元素螯合物具有类似二肽的结构,又消减了氨基酸吸收与转运的竞争;另一方面位于五元或六元环螯合物中心的金属可以通过小肠绒毛刷状缘,以氨基酸或肽的形式被吸收,从而使微量元素吸收和利用效率提高[27]。本试验中,氨基酸微量元素组合体的作用效果虽优于无机微量元素,但要低于单一氨基酸微量元素的同时添加,这还需要从组合比例、配位体以及螯合强度等方面深入研究。
转氨酶与动物体内蛋白质代谢密切相关,通常被认为是肝脏功能正常与否的标志,当肝脏细胞组织结构受损时,GOT和 GPT释放进入血液造成血液转氨酶活性升高。本试验中,有机组罗非鱼肝胰脏蛋白质代谢酶 GOT和 GPT活性最高,有机组合体组次之,无机组再次之,对照组最低,表明饲料中蛋白质的利用受到影响,PER的变化趋势也进一步证实了这个看法。这在一定程度上是因为肝胰脏受到损伤的缘故所致,说明不同来源的微量元素对肝胰脏的影响程度是不同的。
氨基酸微量元素由于其特殊的结构,较好的化学稳定性,能够减少吸收过程中自由基的形成,增强杀菌能力,调节机体免疫力,提高抗病及抗应激能力,从而提高动物的生产性能[28]。鱼体内有天然的抗氧化系统去除自由基,以维持正常的生理功能,其中包括 CAT、SOD等抗氧化酶[29],这 2种酶的测定常用于间接反映体内自由基反应的动态变化及组织损伤情况,而 Zn、Mn、Cu是 SOD的组成成分,Fe作为 CAT的辅助因子,是保持其活性所不可缺少的。AKP的活性可以作为预测临床疾病诊断及环境污染程度的重要指标,在机体的防御中起着重要作用,Zn是 AKP的重要组成部分。溶菌酶是鱼体内重要的非特异性免疫因子,是鱼体生理防御水平的重要标志,其活性受遗传、温度、食性等诸多因素的影响。本试验中添加不同来源的微量元素 Fe、Zn、Mn、Cu后,不同程度提高了鱼体营养水平,进而提高了罗非鱼血清的溶菌酶活性。因此,微量元素对于机体的防御系统是相当重要的。本研究表明氨基酸微量元素显著提高了罗非鱼的非特异性免疫力,证实了Tan等[26]关于氨基酸螯合态微量元素可提高鱼体抗病力的判断。Paripatananont等[12]的研究也表明,蛋氨酸锌替代硫酸锌后可提高斑点叉尾鮰经 Edwardsiella ictaluri攻毒后的存活率。Dudley-Cash[30]报道,给肉鸡补充蛋氨酸锰和蛋氨酸锌可减少肉鸡球虫病的发生,降低因球虫病所致的死亡率。这些研究表明,饲料中不同来源的微量元素能够显著影响养殖动物的免疫系统,从而使其免疫应答反应出现差异。由此可见,氨基酸微量元素对于维持动物机体的抗氧化系统和提高抗病力是不可缺少的营养素添加剂。
4 结 论
①罗非鱼饲料中适当添加微量元素是必要的,但不同形态的微量元素的促生长效果也不尽相同。
②氨基酸微量元素比无机微量元素能更有效地促进罗非鱼的生长,降低饲料系数。
③氨基酸微量元素能够显著提高罗非鱼的非特异性免疫力,可以广泛应用于罗非鱼的养殖生产。
[1] NRC.Nutritient requirements of fish[S].Washington,D.C.:National Academy Press,1993:114.
[2] WATANABE T,KIRON V,SATOH S.Trace minerals in fish nutrition[J].Aquaculture,1997,151:185-207.
[3] 林仕梅,叶元土,罗莉,等.11种矿物质元素对草鱼生长的影响[J].水生生物学报,2002,26(增刊):75-81.
[4] 吕林,罗绪刚,计成.矿物元素影响畜禽肉质的研究进展[J].动物营养学报,2004,16(1):12-19.
[5] HALLBERG L.Bioavailability of dietary iron in man[J].Annual Review of Nutrition,1981,1:123-147.
[6] HILTON J W.The interactions of vitamins,minerals and diet composition in the diet of fish[J].Aquaculture,1989,79:223-244.
[7] ASHMEAD H D.The roles of amino acids chelates in animal nutrition[M].Park Ridge,NJ:Noyes Publications,1992:479.
[8] DAVIS D A,GATLINⅢD M.Dietary mineral requirements of fish and marine crustaceans[J].Reviews in Fisheries Science,1996,4:75-99.
[9] APINES-AMAR M J S,SATOH S,CAIPANG C M A,et al.Amino acid-chelate:a better source of Zn,Mn,and Cu for rainbow trout,Oncorhynchus mykiss[J].Aquaculture,2004,240:345-358.
[10] SAOUD I P,ROY L A,DAVIS D A.Supplementation of chelated potassium and arginine to diets of Litopenaeus vannamei reared in low salinity waters of west Alabama[J].North American Journal of Aquaculture,2007,69:265-270.
[11] PUCHALA R,SAHLU T,DAVIS J J.Effects of zinc-methionine on performance of Angora goats[J].Small Ruminant Research,1999,33:1-8.
[12] PARIPATANANONT T,LOVELL R T.Responses of channel catfish fed organic and inorganic sources of zinc to Edwardsiella ictaluri challenge[J].Journal of Aquatic Aniamal Health,1995,7:147-154.
[13] SATOH S,APINES M J,TSUKIOKA T,et al.Bioavailability of amino acids chelated and glass embedded manganese to rainbow trout,Oncorhynchus mykiss,fingerlings[J].Aquaculture Research,2001,32:18-25.
[14] AOAC.Official methods of analysis of AOAC[S].16th ed.Arlington,VA:AOAC International,1995.
[15] BRADFORD M M.A refined and sensitive method for the quantification of microgram quantities of protein utilizing the principle of protein dye-binding[J].Analytical Biochemistry,1976,72:248-254.
[16] APINES M J,SATOH S,KIRON V,et al.Availability of supplemental amino acid chelated trace elements in diets containing tricalcium phosphate and phytate to rainbow trout,Oncorhynchus mykiss[J].Aquaculture,2003a,225:431-444.
[17] COSSACK Z T.Somatomedin-C in zinc deficiency[J].Experientia,1984,40:498-500.
[18] MCNALL A D,ETHERTON T D,FOSMIRE G J.The impaired growth induced by zinc deficiency in rats is associated with decreased expression of the hepatic insulin-like growth factorⅠand growth hormone receptorgenes[J].Journal of Nutrition,1995,125:874-879.
[19] MA Z J,YAMAGUCHI M.Role of endogenous zinc in the enhancement of boneprotein synthesis associated with bone growth of newborn rats[J].Journal of Bone and Mineral Metabolism,2001a,19:38-44.
[20] MA Z J,YAMAGUCHI M.Stimulatory effect of zinc and growth factor on bone protein component in newborn rats:enhancement with zinc and insulin-like growth factor-Ⅰ[J].International Journal of Molecular Medicine,2001b,7:73-78.
[21] 虞泽鹏,乐国伟,施用晖.不同锌源对断奶小鼠生长及机体抗氧化能力的影响[J].畜牧与兽医,2005(4):3-5.
[22] AAFCO.Official publication of American feed control officials[S].Atlanta,GA:AAFCO Inc.,2001.
[23] HILL A D,PEO E RJr,LEWISA J,et al.Zinc-amino acid complexes for swine[J].Journal of Animal Science,1986,63:123-130.
[24] WEDEKIND K J,BAKER D H.Zinc bioavailability in feed-grade zinc sources[J].Journal of Animal Science,1989,68:684-689.
[25] WEDEKIND K J,HORTIN A E,BAKER D H.Methodology for assessing zinc bioavailability:efficacy for ZnMet,zinc sulfate and zinc oxide[J].Journal of Animal Science,1992,70:178-187.
[26] TAN B P,MAI K S.Zinc methionine and zinc sulfate as zinc sources of dietary zinc for abalone Haliotis discus hannai Ino[J].Aquaculture,2001,192:67-84.
[27] ASHMEADH D.Unlocking reproductive potential in the sow with amino acid chelated elements:Proceedings of the Anaporcsymposium,Spain,1996[C].[S.l.]:[s.n.],1996.
[28] KIDD M T.Effect of zinc-methionine and manganese methionine on the performance and immune response of young turkeys[J].Poultry Science,1992(71):160.
[29] MOURENTE G,TOCHER D R,DIAZ E.Relationships between antioxidants,antioxidant enzyme activities and lipid peroxidation products during early development in Dentex dentx eggs and larvae[J].Aquaculture,1999,179:309-324.
[30] DUDLEY-CASH W A.Organic farms of zinc may provide additional benefits in poultry[J].Feedstuffs,1997(11):10-11.

