饲粮中添加复合益生菌对奶牛瘤胃发酵及纤维素酶活的影响
刘彩娟 孙满吉* 孙金艳 吕文龙 刘 薇 单安山 张永根
饲用微生物(direct-fed microbial,DFM)即传统所说的益生菌,它是指给动物添加的天然存在的活体微生物[1],不仅对动物体肠道微生物有促进作用,还对其它部位(如反刍动物瘤胃)和动物周边微生物环境有改善作用[2]。饲用微生物不仅能改变瘤胃发酵模式,还能提高动物的生产性能[3]。研究报道,反刍动物饲粮中添加饲用微生物能改变瘤胃与后段消化道的微生物数量及瘤胃发酵模式,提高饲料的降解率,促进纤维的降解[3-5],增进营养物质的外流速度,提高饲料采食速率,提高产奶量,改善奶成分[1-6],增进机体健康,提高抗氧化能力[7]。国内外有关直接饲喂益生菌在奶牛上的研究已取得了初步成绩,但复合益生菌对瘤胃发酵作用机制以及对纤维素酶活的影响还不清楚,目前我国在该领域的研究多集中在单菌的机理研究以及复合益生菌对生产效益的影响方面。因此,本文旨在通过研究饲粮中添加复合益生菌对奶牛瘤胃发酵及纤维素酶活的影响,探讨复合益生菌影响瘤胃调控的作用机制,为复合益生菌提高产奶量的作用机理以及其作为绿色饲料添加剂的安全性提供理论依据。
1 材料和方法
1.1 试验饲料与试验设计
复合益生菌由黑龙江省农业科学院畜牧研究所提供,活菌数为 1.2×109cfu/mL。复合益生菌组成为:乳酸杆菌 41.5%、酵母菌 36.6%、链球菌21.2%、光合作用菌 0.5%、放线菌 0.2%。
试验选用 3头体重约为 550 kg,安装有永久性三位点瘤胃瘘管的泌乳中期健康荷斯坦奶牛。试验分 3组,分别为对照组、低剂量组和高剂量组,各组分别在基础饲粮中添加 0、0.6×1011和1.2×1011cfu/d的复合益生菌,采用 3×3拉丁方试验设计,试验分为 3期,每期 18 d(预试期 15 d,正试期 3 d)。试验于东北农业大学香坊实习基地进行。奶牛饲粮营养需要参照 2004版《奶牛饲养标准》,饲粮精粗比控制在 50∶50,基础饲粮组成及营养水平见表 1。
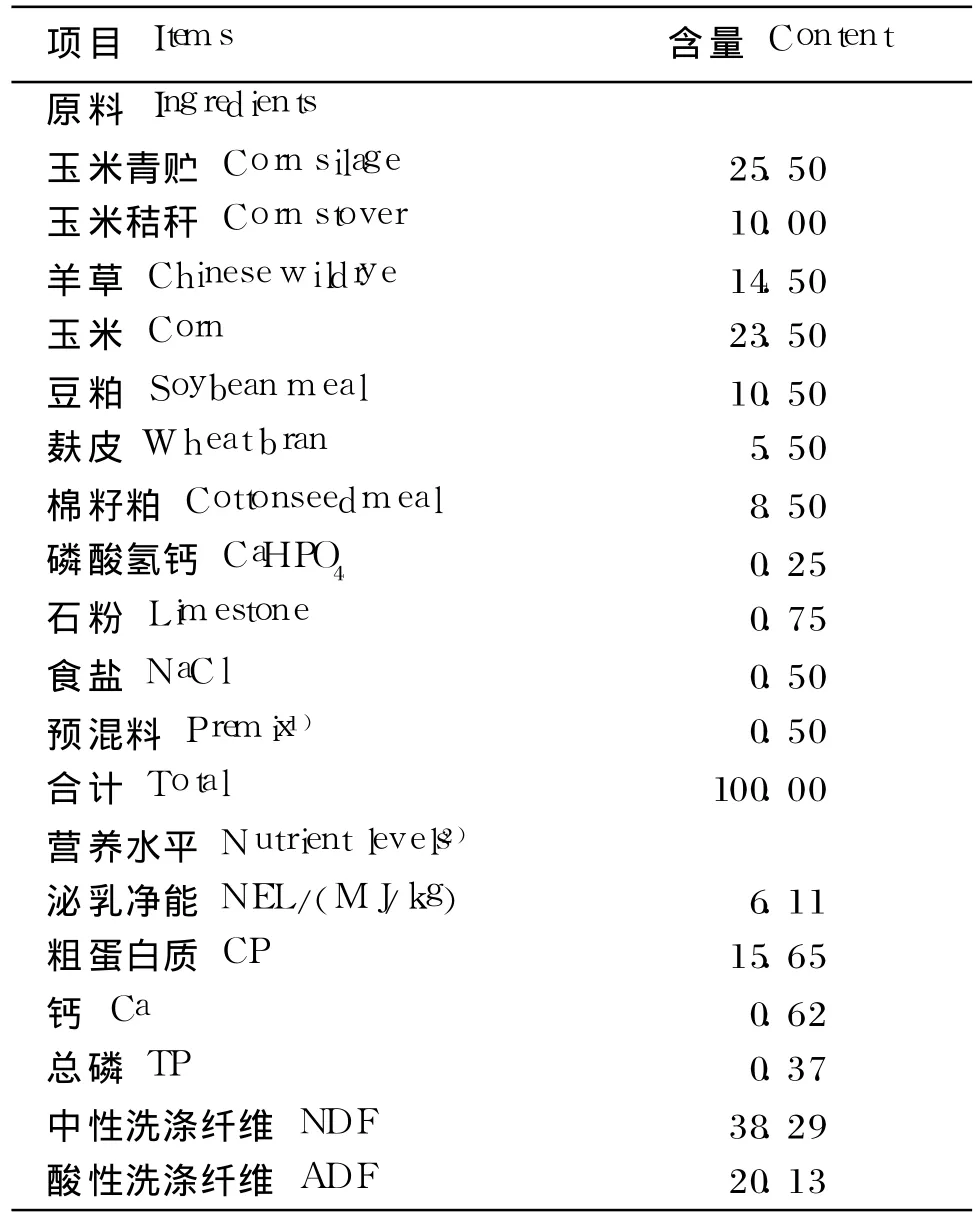
表1 基础饲粮组成及营养水平(风干基础)Table 1 Composition and nutrient levels of basal diet(air-dry basis) %
1.2 饲养管理
试验牛拴系饲养,每天 08:00和 20:00分 2次饲喂,先粗后精,自由饮水。将菌液均匀喷洒在精料上面,混匀饲喂。每天观察记录牛只采食情况。
1.3 样品采集与指标测定
分别取饲喂后 0、2、4、6、8 h取瘤胃液 50 mL,4层纱布过滤,取过滤后瘤胃液 2 mL装于 2个带盖的小瓶中,加入 1 mL 10%三氯乙酸、1 mL 25%的偏磷酸和 2滴饱和氯化汞,立即放入 -20℃冰箱中保存,用于测定氨态氮(NH3-N)和挥发性脂肪酸(VFA)浓度。其余瘤胃液冷冻保存,用于测定菌体蛋白浓度和酶活。
1.3.1 瘤胃液 pH的测定
取出瘤胃液后,用 Mettle MP120型酸度计立即测定 pH。
1.3.2 瘤胃液 NH3-N和 VFA浓度的测定
瘤胃液 NH3-N浓度采用靛酚比色法[4]测定。
瘤胃液 VFA浓度的测定:将冷冻保存的样品放在 4℃的冰箱中解冻,4 000 r/min离心 15 min,取上清液用巴豆酸作为内标物用 GC-9A型气相色谱仪测定乙酸、丙酸、丁酸浓度以及总挥发性脂肪酸(TVFA)浓度。
1.3.3 瘤胃液菌体蛋白(bacterial protein,BCP)浓度的测定
参考姜艳美等[4]测定方法,略有改动。具体操作如下:过滤后的瘤胃液,经 4 000 r/min离心15 min,收集上清液于 20 000 r/min离心 20 min,小心无损失的收集沉淀后,用 FOSS(型号:2300)全自动凯氏定氮仪测定。
1.3.4 酶活测定
采用 3,5-二硝基水杨酸比色法(DNS法)[5],酶活单位(IU)的定义为每分钟每毫升酶液作用于底物生成的还原糖量(μmol)。
1.4 统计分析
试验数据采用 Excel 2003软件进行整理,运用 SAS 8.2软件包中的平衡试验设计方差分析过程(ANOVA)进行统计分析,结果以平均值 ±标准差表示,均值的多重比较采用 Duncan氏法进行,P<0.05为差异显著。
2 结 果
2.1 复合益生菌对奶牛瘤胃液 p H的影响
由表 2可见,奶牛饲粮中添加不同剂量的复合益生菌对奶牛瘤胃平均 pH有显著的影响(P<0.05),添加复合益生菌后,与对照组(6.36)相比,低剂量组(6.43)和高剂量组(6.53)瘤胃平均 p H分别提高了 0.07和 0.17。各组 pH的变化趋势一致,均在饲喂后迅速下降,在 4 h后降低到最低点,而后缓慢上升,到饲喂 8 h后 pH基本接近饲喂前水平,在整个试验期内,各组瘤胃平均 pH均维持在 6.19~6.78范围内。
2.2 复合益生菌对奶牛瘤胃液 NH 3-N浓度的影响
由表 2可见,各组 NH3-N浓度的动态变化是饲喂 2 h后达到最高值,随着时间的延长,NH3-N浓度逐渐下降。从 5个时间点的平均值来看,低剂量组和高剂量组与对照组相比均差异显著(P<0.05),高剂量组的 NH3-N浓度在饲喂 2 h后各时间点均显著高于对照组(P<0.05),低剂量组在饲喂 8 h后显著高于对照组(P<0.05)。
2.3 复合益生菌对奶牛瘤胃液 TVFA浓度的影响
由表 2可知,随着复合益生菌添加剂量的增加,瘤胃发酵产生的 TVFA增加,高剂量组的平均值与对照组相比差异显著(P<0.05),低剂量组虽有提高的趋势,但差异不显著(P>0.05)。由TVFA的数据可以看出,TVFA浓度在饲喂后逐渐升高,在饲喂 4 h后达到最大值,随后逐渐下降,低剂量组和高剂量组的 TVFA浓度饲喂 2 h后各时间点有高于对照组趋势,但差异不显著(P>0.05)。低剂量组和高剂量组的乙酸浓度平均值显著高于对照组(P<0.05),而各组丙酸浓度、丁酸浓度和乙酸/丙酸比值无显著差异(P>0.05)。
2.4 复合益生菌对奶牛瘤胃液 BCP浓度的影响
由表 2可见,高剂量组的 BCP浓度平均值较对照组显著增加(P<0.05),而低剂量组和对照组没有显著差异(P>0.05),BCP浓度动态变化趋势显示,随时间的延长,低剂量组和高剂量组的BCP浓度均呈现增加的趋势,且高剂量组在饲喂4 h后显著高于对照组,各组均在饲喂 8 h后达到最大值。
2.5 复合益生菌对奶牛瘤胃纤维素酶活的影响
由表 3可见,饲粮中添加复合益生菌组的羧甲基纤维素酶、水杨苷酶和木聚糖酶 3种酶活比对照组相比显著提高(P<0.05),其中高剂量组木聚糖酶活提高最为明显。高剂量组的微晶纤维素酶活性显著高于对照组(P<0.05),而低剂量组的微晶纤维素酶活性与对照组相比无显著变化(P>0.05)。
3 讨 论
瘤胃 pH是评价瘤胃发酵状况的基本指标,它主要受唾液、饲粮及其降解物的碱化和缓冲的影响,一般认为当瘤胃 pH<6.2时微生物蛋白质合成效率下降[8],卢德勋[9]认为促进纤维素消化的适宜瘤胃液 p H范围为 6.0~6.8,低于 6.2时,纤维分解菌生长就会受到抑制。本试验奶牛饲喂后8 h内瘤胃 pH变化为 6.19~6.78,而且低剂量组和高剂量组 p H在饲喂后 6 h显著高于对照组,说明复合益生菌能稳定瘤胃 p H,促进瘤胃微生物在良好的瘤胃环境下迅速繁殖,从而加速纤维素的消化。
瘤胃 NH3-N是一个动态平衡过程,反映了特定饲粮组成条件下蛋白质降解与微生物蛋白质合成的动态平衡关系。一方面饲料被瘤胃微生物分解产生 NH3-N;另一方面瘤胃中的微生物利用饲料降解的 NH3-N与酮酸合成微生物蛋白质。NH3-N是瘤胃内合成菌体蛋白的主要前体物质,瘤胃中 NH3-N浓度过高或过低都不利于微生物的生长繁殖,因此保持瘤胃液中的最适 NH3-N浓度是保证微生物蛋白合成的首要条件[10]。本试验中随着复合益生菌剂量的增加,NH3-N浓度也不断上升,并且在饲喂 8 h后达到显著水平。这与大多数试验结果类似,Ghorbani等[11]直接饲喂丙酸杆菌与对照组相比,瘤胃 NH3-N浓度显著上升。有研究报道认为 NH3-N浓度对微生物生长的临界量为 6~30 mg/dL[10-12],本试验 NH3-N浓度均在此范围内。
瘤胃 VFA的组成比例是衡量瘤胃发酵能力的直接指标。瘤胃 VFA的产量主要来自进入瘤胃的饲料碳水化合物的发酵,是奶牛重要的能源物质,为瘤胃微生物的合成提供能量[13]。乙酸是泌乳反刍动物乳腺合成乳脂中脂肪酸的重要底物[12]。本试验使用复合益生菌后,TVFA的浓度和乙酸浓度显著上升,表明瘤胃产 VFA的微生物类群数量或者代谢能力提高,促进了碳水化合物的降解,使得瘤胃内环境发生变化。乙酸浓度提高可以解释奶牛产奶量增加和乳脂率提高的原因;另一方面,乙酸/丙酸较对照稍有升高但差异不显著,也从侧面说明乙酸产生菌受到刺激效应可能大于丙酸产生菌。
瘤胃微生物可以利用饲料蛋白降解产生的NH3-N、氨基酸和肽类合成微生物蛋白质。
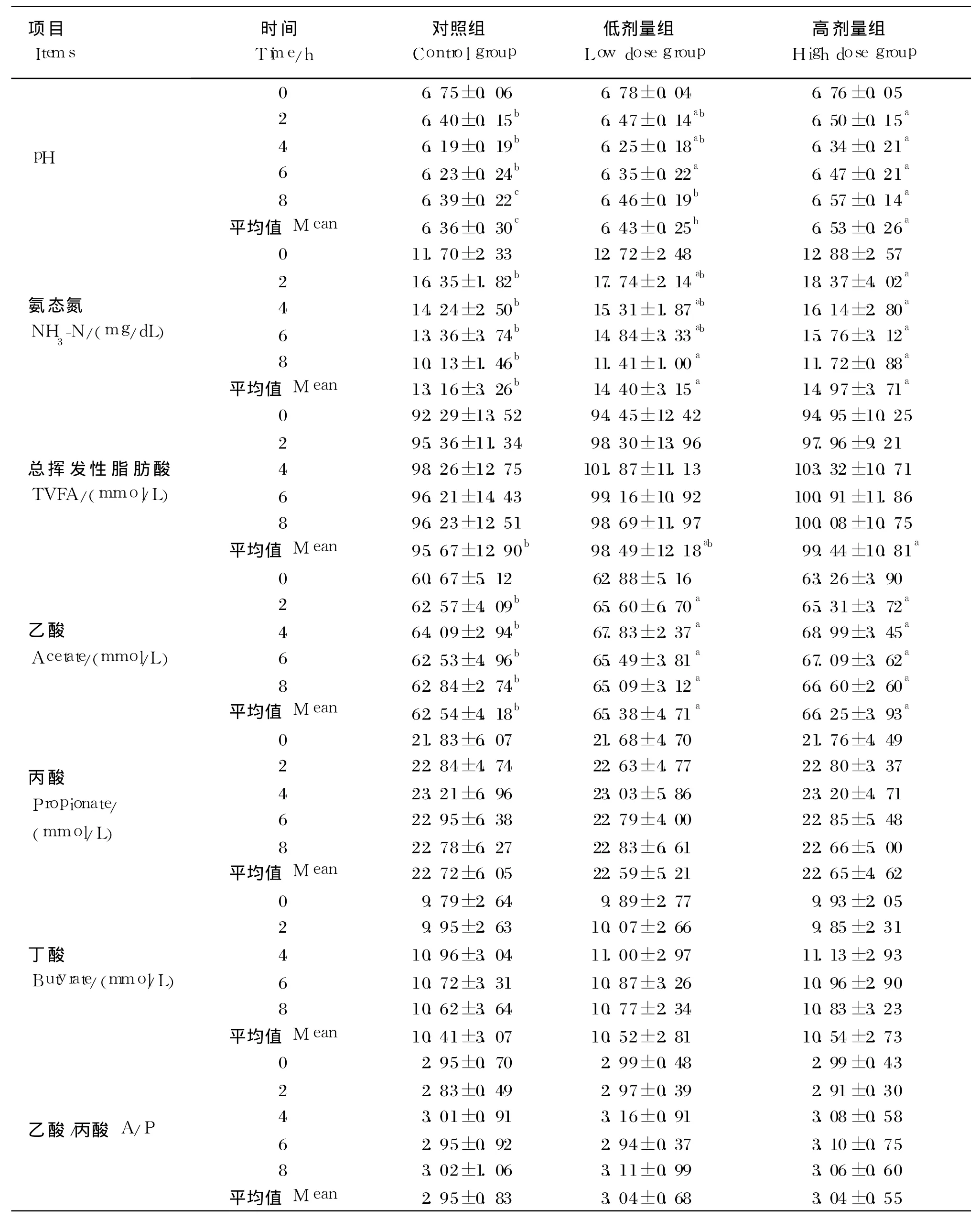
表2 复合益生菌对奶牛瘤胃发酵的影响Table 2 Effects of compound probiotics supplementation on ruminal fermentation of dairy cows

续表2
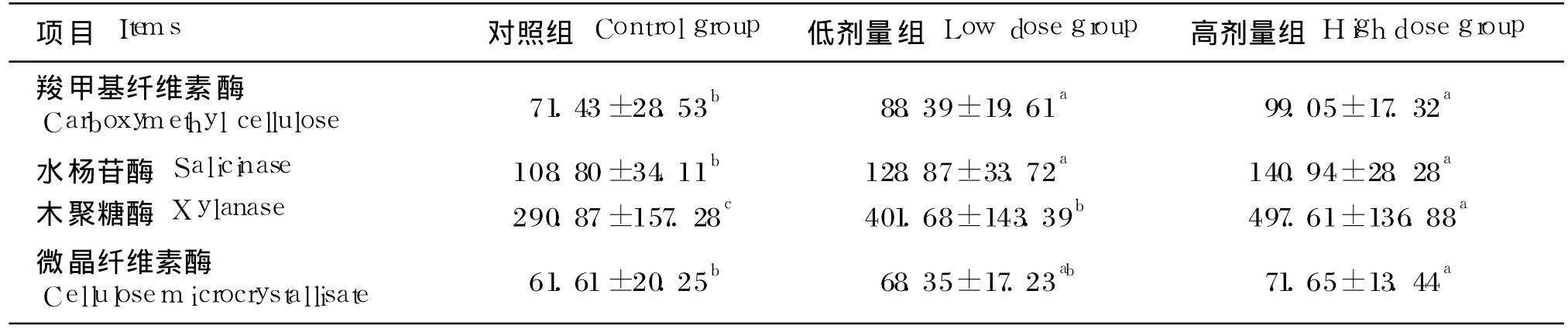
表3 复合益生菌对奶牛瘤胃纤维分解相关酶活性的影响Table 3 Effects of compound probiotics supplementation on activities of cellulase of dairy cows IU
姜艳美等[4]认为,酿酒酵母菌培养物添加量为 5%时显著增加了瘤胃微生物蛋白质浓度。本试验结果显示,高剂量组较其他组相比可以显著增加瘤胃微生物蛋白质的浓度,值得注意的是,该组 NH3-N浓度也最高,与通常认为的 NH3-N浓度较高时,细菌浓度较高相符合。原因可能是由于高剂量复合益生菌促进瘤胃微生物利用 NH3-N合成更多的菌体蛋白,也可能是由于复合益生菌自身的添加而提高了瘤胃液中总微生物蛋白质浓度。但从不同采样时间点看,低剂量组和高剂量组中 NH3-N浓度均高于对照组,且相对应时间点的菌体蛋白浓度也较高。这说明瘤胃液中菌体蛋白浓度升高大部分是来源于复合益生菌刺激了瘤胃部分微生物生长繁殖,从而间接提高了菌体蛋白浓度。有关具体是哪一种益生菌发挥的作用,还有待进行更深一步的研究。
本研究所分析的羧甲基维素酶代表的是一类能够随机切断纤维素非结晶区的葡聚糖链内β-1,4糖苷键的内切葡聚糖酶;水杨苷酶代表的是能够切开纤维二糖的 β-1,4糖苷键的纤维二糖苷酶;木聚糖酶代表的是一组能够水解木聚糖底物生成木糖的酶类,包括内切 β-1,4木聚糖酶、外切 β-1,4木聚糖酶和 β-木糖苷酶等多组分在内的多酶复合体;微晶纤维素酶是能够协同水解结晶纤维素底物产生葡萄糖的多酶组分复合体,反映了包括内切、外切葡聚糖酶和纤维二糖苷酶等多种酶活性,是代表纤维酶解全程总效应的一项指标[5]。瘤胃中纤维降解细菌及非纤维降解菌以及瘤胃真菌都能产生高活性的木聚糖酶,本试验高剂量组显著提高了木聚糖酶活,并且高剂量组瘤胃 pH稳定在适宜范围内,瘤胃微生物发酵产物 TVFA浓度及乙酸浓度提高,瘤胃纤维降解细菌和真菌生长所需的 NH3-N浓度及菌体蛋白浓度相应提高说明高剂量复合益生菌能较好促进瘤胃微生物生长并提高植物半纤维素降解率。纤维素的降解需要一系列酶的协同作用,本研究结果表明,高剂量组的羧甲基纤维素酶、水杨苷酶和微晶纤维素酶活显著提高,这意味着添加高剂量复合益生菌,可加快饲料纤维易降解成分的消化速度,提高纤维的起始消化率;同时降解纤维素结构致密区和其他组分的相关酶活提高,说明适宜水平的复合益生菌能在一定程度上消除对纤维总消化率的限制影响,提高瘤胃纤维物质的降解程度,从而改变纤维成分在全消化道中的消化率。冯伟业等[14]和黄庆生等[5]的试验结果也证明了这一点。
4 结 论
①添加复合益生菌可显著提高瘤胃 p H,对瘤胃内环境无任何不良影响。
②高剂量的复合益生菌添加组可显著增加瘤胃 TVFA和乙酸浓度,但对丙酸、丁酸、以及乙酸/丙酸比值没有显著影响。
③添加复合益生菌可显著提高 NH3-N浓度,高剂量组显著增加了瘤胃液 BCP的浓度。
④添加高剂量复合益生菌可显著提高羧甲基纤维素酶活、水杨苷酶活、木聚糖酶活及微晶纤维素酶活。
[1] KREHBIEL C R,RUST SR,ZANG G,et al.Bacterial direct-fed microbials in ruminant diets:performance response and mode of action[J].Journal of Animal Science,2003,81(Suppl.2):E120-E132.
[2] VERSCHUERE L,ROMBAUT G,SORGELOOS P,et al.Probiotic bacteria as biological control agents in aquaculture[J].Microbiology and Molecular Biology Reviews,2000,64(4):655-671.
[3] NOCEK J E,KAUTZ W P.Direct-fed microbial supplementation on ruminal digestion,health and performance of pre-and postpartum dairy cattle[J].Journal of Animal Science,2006,89:260-266.
[4] 姜艳美,王加启,邓露芳,等.酵母培养物对瘤胃发酵的影响[J].动物营养学报,2008,20(1):92-97.
[5] 黄庆生,王加启.添加不同酵母培养物对瘤胃纤维分解菌群和纤维素酶活的影响[J].畜牧兽医学报,2005,36(2):144-148.
[6] WANG Z,EASTRIDGE M L,QIU X.Effects of forage neutral detergent fiber and yeast culture on performance of cows during early lactation[J].Journal of Dairy Science,2001,84(1):204-212.
[7] 张爱忠,卢德勋,姜宁,等.酵母培养物对绒山羊机体抗氧化能力的影响[J].动物营养学报,2010,22(3):781-786.
[8] 王建平,王加启,卜登攀,等.高温条件下高产和中产奶牛产奶性能及瘤胃发酵的研究[J].动物营养学报,2010,22(1):51-56.
[9] 卢德勋.系统动物营养学导论[M].北京:中国农业出版社,2004:132-133.
[10] 姜旭明,齐智利,齐德生,等.不同蛋白质来源的日粮对瘤胃发酵特性及蛋白质消化的影响[J].草业科学,2009,26(1):74-80.
[11] GHORBANIG R,MORGAVI D P,BEAUCHEMIN K A,et al.Effects of bacterial direct-fed microbials on ruminal fermentation,blood variables,and themicrobial populations of feedlot cattle[J].Journal of Animal Science,2002,80:1977-1985.
[12] 冯仰廉.反刍动物营养学[M].北京:科学出版社,2004:241-336.
[13] 王丽娟,刘大程,卢德勋,等.日粮同时添加酵母培养物与延胡索酸二钠与对慢性酸中毒奶山羊瘤胃发酵和细菌数量的影响[J].动物营养学报,2009,21(1):67-71.
[14] 冯伟业,刘大程,卢德勋,等.不同品质粗饲料日粮及添加酵母培养物对绵羊瘤胃内主要纤维素酶及纤维物质降解的影响[J].动物营养学报,2008,20(1):108-114.

