裸仁美洲南瓜种皮性状遗传规律研究
薛应钰,师桂英,徐秉良* ,陈荣贤
(1.甘肃农业大学草业学院草业生态系统教育部重点实验室中-美草地畜牧业可持续发展研究中心(甘肃农业大学),甘肃 兰州730070;2.甘肃省作物遗传改良与种质创新重点实验室,甘肃兰州 730070;3.甘肃农业大学农学院,甘肃 兰州730070;
4.甘肃省武威金苹果有限责任公司,甘肃 武威733000)
南瓜(Cucurbita)是一年生草本爬蔓植物,属葫芦科(Cucurbitaceae),南瓜属。南瓜原产于中、南美洲,是人类最早栽培的古老作物之一,也是世界蔬菜中变异最大,色彩最为丰富的种类,它对环境的适应性强,容易栽培,世界各地均有种植,其栽培面积以亚洲最多,其次为欧洲和南美洲[1]。其富含胡萝卜素、维生素C、核黄素及钙、镁、铁等微量元素,并含有较多的粗纤维,对通便、抑制肠内病菌和致病物质有良好的作用,它既是良好耐贮蔬菜,又是优质高效饲料[2]。裸仁美洲南瓜(Cucurbita pepo)是自然界一种罕见的突变类型,最早在19世纪后期发现[3,4]。与普通南瓜相比,其瓜籽无壳,食用方便,种子含有大量的脂肪、蛋白质、碳水化合物及钙、磷、铁、锌、硒、镁、钠等8种主要的微量元素,VB1、VB2、VC、VH、VF等多种维生素和8种人体必需的氨基酸,营养丰富而享誉国内外市场,成为我国的一种稀有产品[5]。同时,以裸仁南瓜为基料,添加一些辅助成分制成的奶牛专用饲料,营养素全面,热量也很低,几乎不含淀粉质,是理想的补充型饲料,可以帮助解决奶牛所需的蛋白质,同时减少对高热量的豆类的摄入,降低热量,延长奶牛寿命,增加产奶量和牛奶浓度,在奶牛饲料的制作中有重要意义[6]。
甘肃省河西地区具有栽培南瓜的优越地理生态气候条件,武威市位于河西走廊东端,是甘肃省主要的瓜类生产基地[7]。甘肃省民勤县位于甘肃河西走廊东端北侧石羊河下游,海拔1 000~1 400 m,属中温带干旱区,大陆性沙漠气候,年均降水量110mm,年水面蒸发量达2 640mm,平均相对湿度45%,湿润系数0.06[8],被誉为沙漠深处的绿色宝石[9]。该地光照丰富,热量充足,昼夜温差大,土壤沙质,极有利于农作物的生长发育,是发展瓜类的理想生产基地。裸仁美洲南瓜是当地重要的经济作物,也是出口创汇的主要农产品。但是,近年来,裸仁美洲南瓜育种和生产过程中出现了品种少、产籽量低、种子无壳率不稳定、纯合性不好、瓜籽小以及饱满度不够和综合商品性状不高等问题[10],成为限制裸仁美洲南瓜种质创新和大规模生产的一个瓶颈问题。而杂交育种是植物遗传改良中常用的技术策略,利用性状差异明显的亲本进行杂交育种是选育高产、优良品种的重要途径[11]。因此,研究美洲南瓜的裸仁现象,揭示其遗传规律,对指导南瓜育种,改良品质,拓宽裸粒品种资源具有重要意义。本试验以武威金苹果有限责任公司培育而成的6个美洲南瓜自交系为材料,进行了裸仁美洲南瓜种皮性状遗传规律的研究,为有效地开展裸仁美洲南瓜杂交育种、良种繁育及获取南瓜种质资源创新材料提供理论依据。
1 材料与方法
1.1 研究区概况
研究区位于民勤县县城东北部泉山镇,甘肃省武威金苹果有限责任公司试验基地。该区面积为20.01 km2,土地以沙土为主,气候干燥,昼夜温差大,降水均匀,日照时间长,四季分明。平均海拔1 367 m,年均降水量155.8mm,年均气温9.5℃,全年无霜期163 d。年平均相对湿度45%,年日照时数3 289 h。
1.2 试验设计
1.2.1 试验材料 美洲南瓜高代自交系:有壳04FC 409-4(A)、03N-122-19(B)、04LAg-26-2(C)和无壳04GD112-7(a)、1N-275-7(b)、04LAg-26-28(c),均是稳定的自交系,由甘肃省武威金苹果有限责任公司提供。杂交组合的配置见表1。
1.2.2 研究方法 试验地为土层厚、疏松、有灌溉条件的沙质土壤。试验分4个年度进行,2006年,种植上述6个亲本材料各60株,在人工隔离条件下进行亲本自交和正、反交组配,获得正、反交的 F0材料;2007年将获得的6份正、反交F0材料种植40株,在同样隔离条件下进行自交,获得F0的自交材料F1;2008年,种植6个亲本各30株、2007年获得的正交后代F1材料各40株,进行自交和回交,获得F1代材料的F2和回交材料BC1、BC2;2009年,将6个亲本及其各世代材料同时播种,亲本及F1各种植35株,BC1、BC2种植约 150株,F2种植约250株。试验采用随机区组设计,即将杂交、回交后代群体及亲本进行小区随机排列,3次重复。小区为3行区,行长10 m,行距1.0 m,株距0.35 m,小区面积13 m×4 m。栽培管理按常规方法进行。于果实成熟后采收种瓜,刨出瓜籽,观察种皮性状的表现,应用遗传学原理分析不同世代种皮性状的分离比例,并进行χ2适合性测验。

表1 美洲南瓜试验材料的杂交组合配置Table 1 The hybrid combinations preparation of C.pepo parents
2 结果与分析
2.1 亲本自交后代种皮性状的表现
2006年对6个亲本A、B、C、a、b和c材料各30株分别进行自交,结果表明,有壳亲本A、B和C自交后,其子代群体共90株的种皮均表现为有壳;无壳亲本a、b和c自交后,其子代群体共90株的种皮均表现为无壳。
2.2 F0代种皮性状的表现
本试验用A、B 和C作母本,以a、b和c作父本进行正、反交组合,即A ×a、B×b、C×c、a×A 、b×B和 c×C共6个杂交组合获得的180株F0代植株,其种皮统计结果(表2)表明,所有的F0都表现为母本种皮的性状,即以有壳亲本作为母本进行正交的3个杂交组合,其90株的后代F0种皮为有壳;以无壳亲本作为母本进行反交的3个杂交组合,90株的后代F0种皮为无壳。这是由于被子植物的种皮由母本珠被发育而来,因此种皮的染色体数目、基因型与母本一致,而与父本无关。同时当年长出的种皮并不是子一代的种皮,而是母本的种皮性状,子一代的种皮为把种子种下去再结出来的种子的种皮,因此,此时观察到的种皮性状还是亲本的种皮性状。
2.3 F1代种皮性状的表现
结果表明(表3),用A×a、B×b、C×c 3个杂交组合(正交)其F1代群体共120株的种皮均表现为有壳,没有出现无壳种子;同样以a×A、b×B和c×C 3个杂交组合(反交)各40株自交所得的F1代种皮性状都表现为有壳,也没有出现无壳种子,说明供试美洲南瓜材料种皮的遗传表现是有壳对无壳为显性。同时,正、反交F1代的种皮性状表现一致,说明美洲南瓜种皮遗传是受核基因控制的。
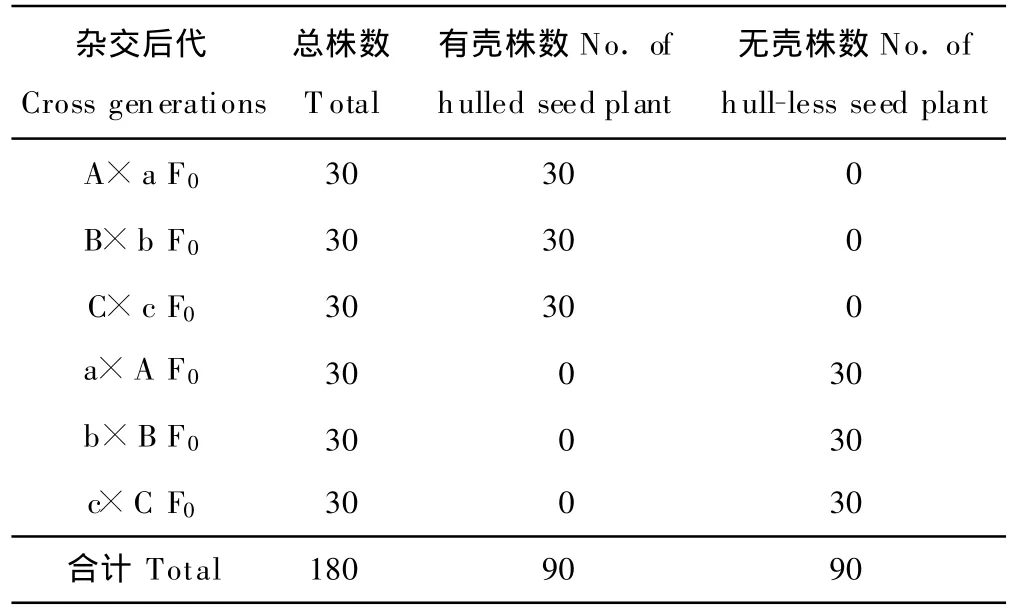
表2 美洲南瓜杂种F0种皮遗传观察结果Table 2 Results of seed coat in hybrid F0generation of C.pepo
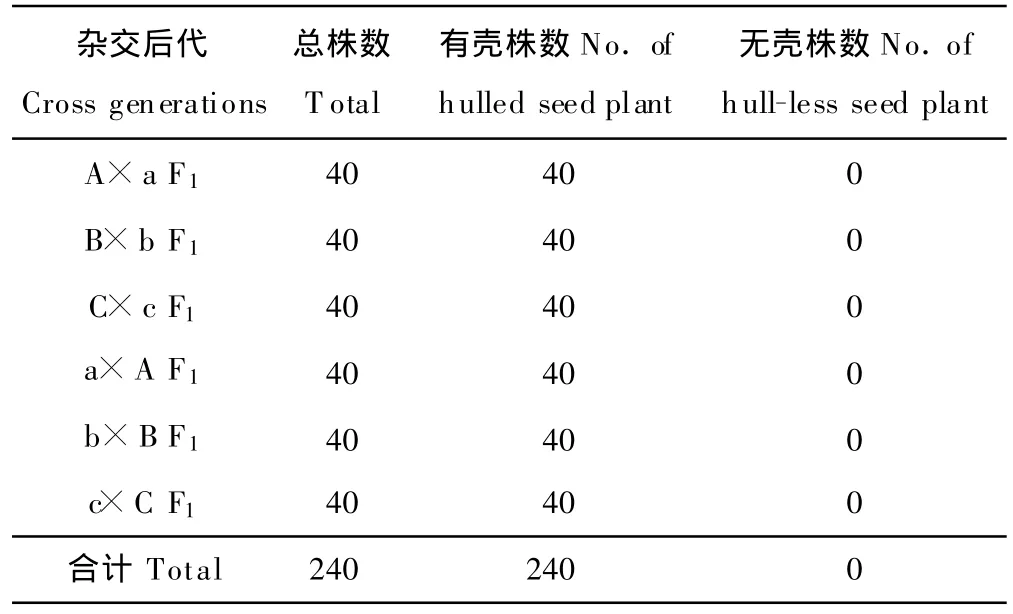
表3 美洲南瓜杂种F1种皮遗传观察结果Table 3 Results of seed coat in hybrid F1generation of C.pepo
2.4 F2代种皮性状的表现
结果表明(表4),A×a、B×b、C×c、a×A 、b×B和 c×C 6个杂交组合共 1 474株的F2代群体均发生了分离,出现了有壳(1 102株)和无壳(372株)2种性状,6个组合的有壳植株数依次为184,171,190,180,188和189株,无壳植株数依次为56,63,60,66,68和59株,其有壳、无壳分离比率分别为3.29∶1,2.71∶1,3.17∶1,2.73∶1,2.76∶1和3.20∶1。分别对其进行χ2适合性测验,其χ2值分别为0.272 2,0.364 7,0.085 3,0.346 9,0.255 2和0.134 4,均小于χ20.05=3.84,由此推断,其 F2代有壳、无壳性状分离符合3∶1分离比率,说明有壳性状的遗传受1对显性核基因控制;有壳对无壳为显性。
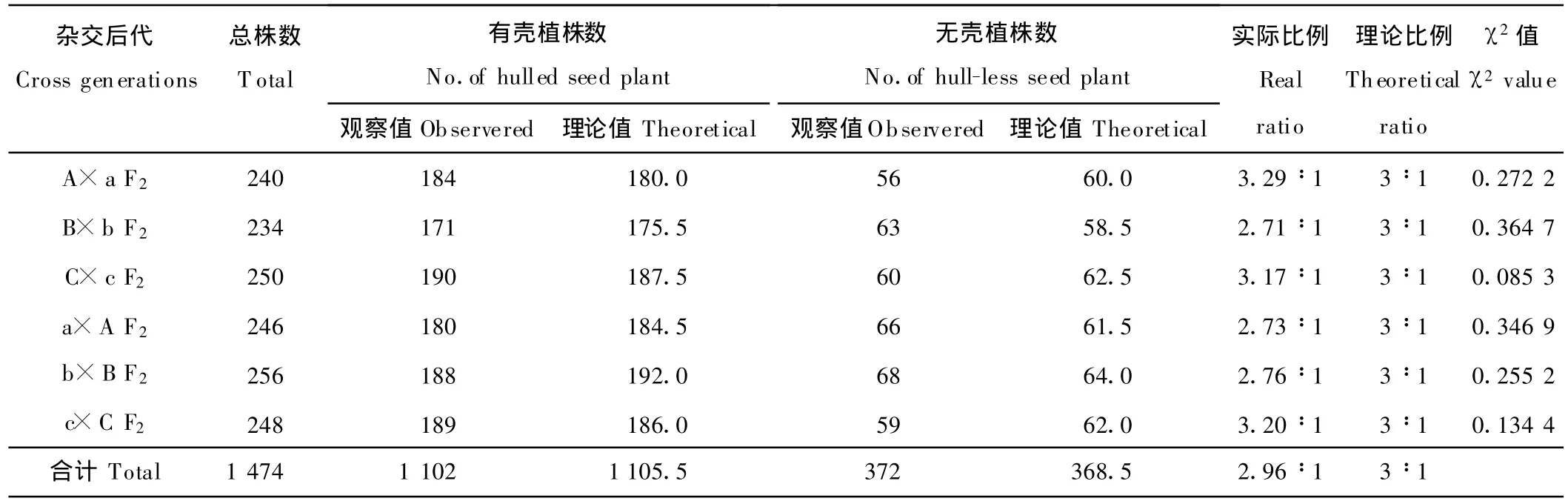
表4 美洲南瓜杂种F2种皮的分离表现Table 4 Separated results of seed coat in hybrid F2generation of C.pepo
2.5 回交后代种皮性状的表现
为了进一步验证美洲南瓜种皮的遗传规律,观察了6个组合分别与其父、母本回交的种皮分离比率。回交群体BC1,即以A×a、B×b、C×c作母本,有壳亲本A、B、C作父本配置的(A×a)×A、(B×b)×B和(C×c)×C三个杂交组合;以a×A、b×B、c×C为母本,有壳亲本A、B、C为父本配置的(A ×a)×a、(B×b)×b和(C×c)×c三个杂交组合,共6个回交组合所得的后代群体885株均表现为有壳(表5)。
回交群体BC2,即以A×a、B×b、C×c作母本,与无壳亲本a、b、c作父本进行回交时配置的3个杂交组合(A×a)×a、(B×b)×b和(C×c)×c,所得的回交后代群体均表现为有壳和无壳的分离,有壳植株数依次为65,83和69株,无壳植株数依次为86,67和83株,其有壳、无壳分离比率分别为0.76∶1,1.24∶1和0.83∶1,经用1对等位基因遗传的适合性测验,得出其χ2值分别为2.649 0,1.500 0和1.111 8,小于说明其分离比率符合1∶1。同样,以a×A 、b×B、c×C 为母本,与无壳亲本a、b、c作父本进行回交时配置的3个杂交组合(a×A)×a、(b×B)×b和(c×C)×c,所得的回交群体后代同样表现为有壳和无壳的分离,有壳植株数分别依次为60,84和70株,无壳植株数依次为84,75和76株,其有壳、无壳分离比率分别为0.71∶1,1.12∶1和 0.92∶1,经用1对等位基因遗传的适合性测验,得出其χ2值分别为3.673 6,0.402 5和0.171 2,小于说明其分离比率符合1∶1;此结果进一步说明了供试美洲南瓜的种皮遗传并不受细胞质影响,而是受细胞核的1对基因所控制,其中有壳对无壳表现为显性。
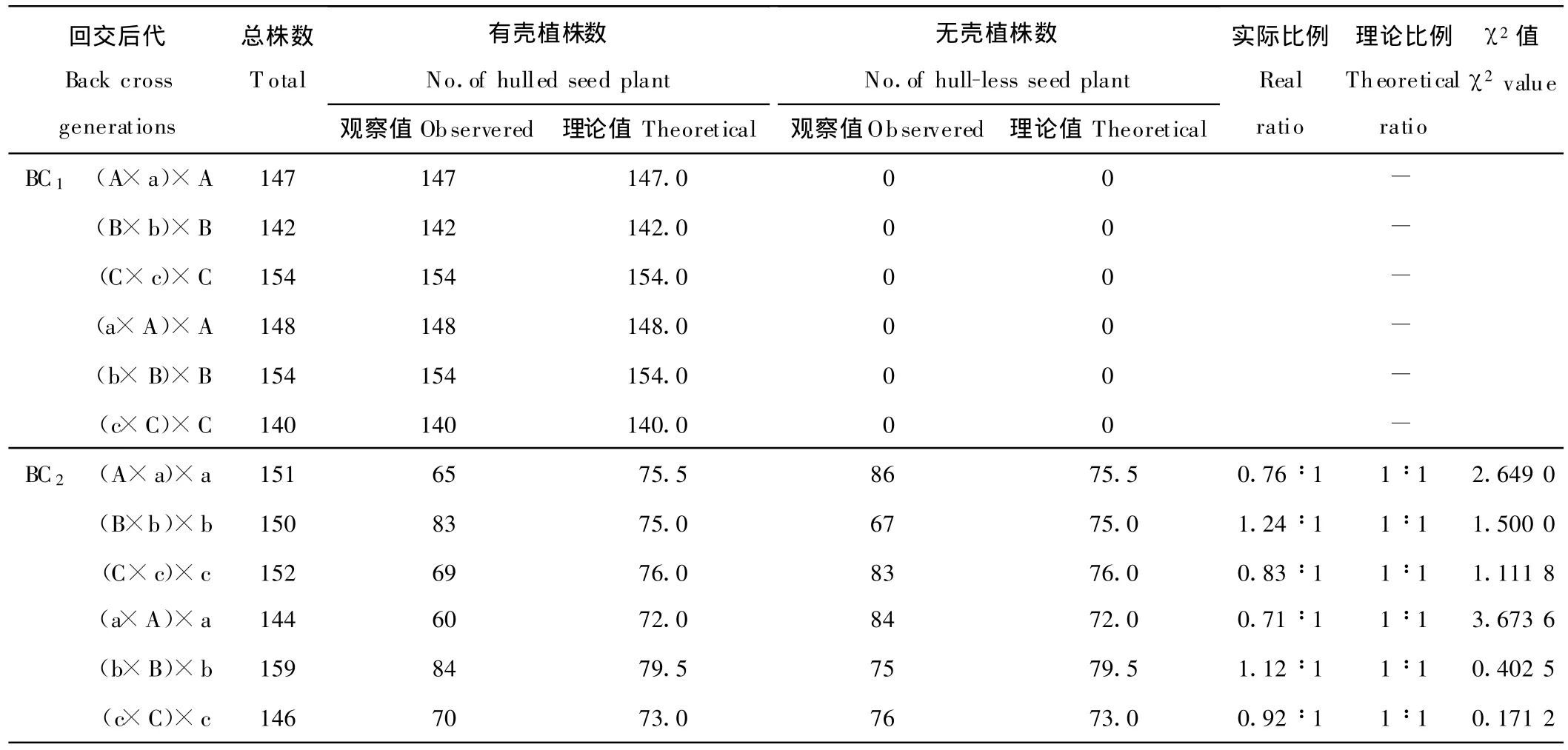
表5 美洲南瓜回交BC1、BC2种皮的分离表现Table 5 Separated results of seed coat in back cross generations of C.pepo
3 讨论
无壳裸仁南瓜是南瓜属中国南瓜和美洲南瓜种中存在的种子无硬壳而具暗绿、灰绿或翠绿种膜的变异品种。目前,在欧美市场已经取代人工剥壳的南瓜籽仁而被广泛应用于食品、医药、化工等行业,年需求量呈迅速增长趋势。但是作为天然裸仁南瓜籽仁的发源地、开发地、优质产品生产地的甘肃来说,尤其是民勤,由于可供选择的品种单一、品种退化严重等原因播种面积呈逐年下降趋势。因此,进行裸仁美洲南瓜种皮遗传规律的研究有着极其重要的理论价值和现实意义。
植物的种皮是由珠被发育而来。种皮是植物体保守性较强的器官,其形态性状和解剖构造一般不容易受外界环境的影响而发生形态结构的改变。其形态和结构是在长期自然进化过程中形成的,是受基因控制的稳定性状,受环境影响较小,可作为分类的重要依据[12]。种皮具有保护种胚和萌发时吸收水分的作用,对种子萌发和休眠有一定的抑制作用[13]。前人对植物种皮遗传的报道,目前多集中在油菜(Brassica napus)、花生(Arachis hypogaea)、黑米(Oryza sativa)和小麦(Triticum aestivum)等作物的种皮颜色性状遗传方面,而且不同的作物其种皮颜色遗传特点不尽相同。刘志文等[14]对黄籽油菜(yellow-seeded Brassica napus)进行遗传分析发现黄籽性状主要由1对加性-显性主基因控制,同时存在多基因作用和具有母性遗传特性,并且受环境影响较大;严明理等[15]以四川黄籽油菜和紫叶芥(Brassica j uncea var.atropurpurea)为材料,研究了芥菜型油菜种皮的遗传,结果表明,紫叶芥种皮的黑色对四川黄籽的黄色为显性,种皮颜色是由2对独立基因控制。胡晓辉等[16]认为花生种皮颜色的差异受1对不完全显性的主效基因控制;Branch[17]则认为花生种皮深红色遗传至少由1对或2对隐性纯合基因w1w1和w2w2控制。陈廷文[18]认为稻谷黑米种皮黑色素沉积性状表现受1对显性色素基因控制,存在加性、显性和上位性效应。姚金保等[19]认为青海黑小麦黑种皮对红种皮和白种皮呈显性,黑种皮受2对显性互补基因控制。
有关南瓜种皮的遗传研究报道相对较少,早期认为南瓜种子种皮的表面和边缘分别受“H”和“N”基因控制[20];Robinson等[21]和Stuart[22]认为无壳种子的形成是受1个隐性基因和几个修饰基因控制。20世纪80年代,周祥麟[23,24]以中国南瓜为试验材料,认为裸仁种子性状为隐性,与有壳种子杂交后代全有壳,侧交则出现1∶1的分离。本研究结果表明,有壳种皮的遗传在F1为显性,F2的分离有壳对无壳呈3∶1,无壳受1对纯合隐性基因的控制,属于质量性状遗传。这与Stuart[22]、周祥麟[23,24]、张仲保[3]的研究结果一致。但是Stuart[22]和张仲保[3]在试验过程中选择的杂交组合较少,而且群体较小;周祥麟[23,24]的研究一方面不系统,另一方面,试验材料是中国南瓜(C.moschata)。
Teppner[4]认为,种皮性状的遗传是由1个主效基因和9个微效基因控制[4]。本研究发现有壳和无壳杂交F2和BC1、BC2群体中除两亲本种皮类型外,还出现从无壳到有壳的一系列半壳或薄壳的中间类型的单株(图1,2,3),尤其有壳类型的单株呈无壳至有壳的连续分布(本试验在分类归类时将其统一归为有壳),这种现象一方面可能是种子成熟度对种皮形成表达的影响,另一方面也说明种皮的形成除受1对主基因控制外,可能也有修饰基因作用。

图1 美洲南瓜种子无壳性状Fig.1 Hull-less testa seed of C.pepo

图2 美洲南瓜F2种子出现的过渡类型Fig.2 A sample of seeds which exhibit residual lignification in F2progenies segregants

图3 美洲南瓜种子有壳性状Fig.3 Hulled testa seed of C.pepo
4 结论
通过对3个有壳美洲南瓜自交系 04FC409-4、03N-122-19、04LAg-26-2和 3个无壳美洲南瓜自交系04GD112-7、1N-275-7、04LAg-26-28的正交、反交和回交试验及统计分析,明确了美洲南瓜种皮性状的遗传规律,美洲南瓜种皮的有壳与无壳受1对核基因控制质量性状,有壳对无壳为显性。
[1]刘玉梅,高智明,王健,等.裸仁南瓜籽及南瓜籽油的营养成分研究[J].食品工业科技,2010,31(6):313-316.
[2]肖文一.饲料南瓜一地多种高产栽培技术试验报告[J].哈尔滨商业大学学报(自然科学版),1980,(3):34-35.
[3]张仲保.无种壳西葫芦巨仁[J].中国蔬菜,2007,(2):62-62.
[4]Teppner H.Cururbita pepo(Cucurbitaceae):History,seed coat types,thin coated seeds and their genetics[J].Phyton-international Journal of Experimental Botany,2000,40:1-42.
[5]陈荣贤,吕生全,孙有鑫,等.天然无壳瓜籽的化学组成及其分析[J].甘肃农业科技,1988,(3):32-33.
[6]贾楠.裸仁瓜与新型液态奶牛饲料——研制者田然升谈新型液态饲料[J].当代畜禽与饲料,2009,(8):56-57.
[7]张松林,田侠,董庆士,等.沙漠绿洲多功能高分子植物生长调节剂籽瓜增产和品质改善研究[J].中国沙漠,2006,26(3):503-506.
[8]何亚娟,潘学标.甘肃省民勤绿洲种植结构与水资源利用的研究[J].中国生态农业学报,2003,11(4):121-123.
[9]陈吉斌,刘胜祥,王明忠.甘肃民勤植物资源调查[J].黑龙江农业科学,2007,(5):104-105.
[10]于红茹,苏国辉.我国籽用南瓜现状及前景分析[J].北方园艺,2008,(4):54.
[11]谢文刚,张新全,陈永霞.鸭茅杂交种的SSR分子标记鉴定及其遗传变异分析[J].草业学报,2010,19(2):212-217.
[12]孟秋峰,王毓洪,周焕兴,等.园艺植物保守器官分类研究进展[J].宁波农业科技,2008,(4):21-23.
[13]路覃坦,张金政,孙国峰,等.四种国产野生无髯鸢尾种子休眠类型的研究[J].草业科学,2009,18(2):130-137.
[14]刘志文,毛玮,周芳彬,等.甘蓝型油菜种皮颜色的遗传分析[J].华北农学报,2008,23(2):84-87.
[15]严明理,刘忠松,官春云.芥菜型油菜种皮颜色和叶片颜色的遗传[J].作物研究,2008,22(3):157-159.
[16]胡晓辉,石运庆,苗华荣,等.花生种皮颜色遗传及相关品质分析[J].江西农业学报,2009,21(3):27-28.
[17]Branch W D.花生种皮深红色遗传的研究[J].花生科技,1999,(1):37-39.
[18]陈廷文.稻谷黑米种皮的遗传特性研究[J].四川农业大学学报,1995,13(4):498-505.
[19]姚金保,姚国才,杨学明,等.青海黑小麦种皮色泽的初步遗传分析[J].麦类作物学报,2007,27(5):791-793.
[20]Wei L F,von Becherer E P.Zur factoreanalyse der testa aus beldung beim kurbis[J].Berlin Deutsch Botanische Gesselschaft,1950,63:147-148.
[21]Robinson R W,Munger H M,Whitaker T W,et al.Genes of the Cucurbitaceae[J].Hortscience,1976,11:554-568.
[22]Stuart S G.Comparative biochemical and genetic studies of testa development in normal and hull-less phenotypes of pumpkin[D].PhD thesis,University of New Hampshire,1983.
[23]周祥麟.裸仁南瓜的育成及其遗传规律的探讨[J].山西农业科学,1983,(12):21-22.
[24]周祥麟.裸仁南瓜的育成及其遗传性研究[J].园艺学报,1987,14(2):115-118.

