采用流式细胞仪鉴定紫花苜蓿花药愈伤组织的变异
耿小丽,魏臻武 ,姚喜红
(1.甘肃农业大学草业学院,甘肃 兰州730070;2.扬州大学动物科学与技术学院,江苏 扬州225009)
紫花苜蓿(Medicago sativa)是多年生异花授粉豆科作物。自然环境下绝大多数紫花苜蓿为同源四倍体(2n=4x=32),少数为四倍体的变异体。苜蓿花药培养时,由于小孢子在形成愈伤组织的过程中,经历了连续不断的有丝分裂过程,因此,染色体水平上发生变异的可能性大大增加。这种遗传变异具有双重性,一方面可以利用有益变异为育种工作服务,另一方面变异的不确定性又为优良性状的保持带来了极大的困难[1]。因此,在育种过程中,掌握愈伤组织的遗传变异规律就显得尤为重要。Larkin和Scowcroft[2]指出植物组织培养过程中会出现可遗传的变异,并将组织和细胞培养所产生的变异称为体细胞无性系变异。Yoshida等[3]在水稻(Oryza sativa)花药培养中发现,愈伤组织继代时间越长,变异率越高。Muller等[4]利用RFLP(restriction fragment length polymorphism)分子标记研究不同继代时间对无性系变异的影响时,发现延长继代时间可增加体细胞无性系DNA的多态性。不同植物染色体数目的稳定性存在差异,谷明光[5]发现玉米(Zea mays)花粉愈伤组织倍性较为稳定。
染色体计数法是植物研究中最常用的染色体检测方法[6]。此方法虽然准确性高,但操作复杂,观察细胞群体小,难以实现大量材料的倍性鉴定[7,8]。本试验所采用的流式细胞仪可以同时对大量细胞进行染色体检测,提高了结果准确度,并且DNA变异可在分布图上直观地表现。此外,流式细胞仪还可以快速地鉴定细胞周期。
本试验采用流式细胞仪对3个基因型8个继代周期的苜蓿花药愈伤组织DNA含量进行测定及遗传变异分析,旨在研究苜蓿花药愈伤组织染色体的变异现象,为紫花苜蓿优良品种选育提供基础。
1 材料与方法
1.1 试验材料
试验材料为自选系大叶0510、自选系多叶0501、Sanditi的单株,3个材料种植于甘肃省皋兰县试验基地。试验于2008年5月开始。
1.2 苜蓿花药愈伤组织的诱导培养
在苜蓿初花期到盛花期期间,采集3个基因型紫花苜蓿单株上花药发育处于单核中、晚期的花蕾(使用醋酸洋红染色压片法,观察、确定发育时期。从外观上选择花冠最外面的旗瓣紧包,花冠饱满,伸出花萼1~2mm,呈刀尖状的花蕾)。将采集的花蕾放置在4℃的冰箱内低温处理12~24 h;然后将花蕾灭菌,在无菌条件下剥出花粉,接种到愈伤组织诱导培养基中(NB+0.5 g/L 2,4-D+0.2 g/L NAA+0.5 g/L 6-BA+2 g/L KT+9%蔗糖+0.7%琼脂),在温度为25℃、光强1 000 lx、光照时间16 h/d、湿度40%的环境下培养。诱导出愈伤组织后转入继代培养基(NB+3%蔗糖+0.7%琼脂),20 d为1个继代周期。培养条件同上。
1.3 采用流式细胞仪测定苜蓿愈伤组织DNA含量
本试验使用德国Partec公司PA-1型流式细胞仪进行DNA含量的检测。每1个基因型的愈伤组织每次测定5 000个细胞,重复3次。
1)用锋利的刀片对愈伤组织和叶片进行机械破碎,破碎过程中加入700~800 mL的缓冲液A[15 mmol/L T ris-HCl(pH 7.5),80 mmol/L KCl,20 mmol/L NaCl,2 mmol/L EDTA-Na2,15 mmol/L巯基乙醇,0.1%(V/V)T ritonX-100,0.5 mmol/L精氨四盐酸(spermine·4HCl)],在缓冲液A中处理10 min。然后用300目(48 μ m)尼龙网过滤(滤液含1×105~2×105个细胞),将滤液离心(2 000 r/min,5 min)。离心后弃去上层清液,取沉淀物加缓冲液A(700~800 mL),打散后用300目尼龙网过滤。取滤液离心(2 000 r/min,5 min),离心后弃去上层清液,取沉淀物加 RNase A溶液(50 mg/L)1 mL,处理10 min,去除RNA,然后离心(2 000 r/min,5 min)。离心后弃去上层清液,取沉淀物加入1.6 mL HR-B DAPI染色液(partec high resolution staining kit)染色30~60 s,完成细胞核染色,细胞核悬浮液制备完成。
2)以已知的四倍体苜蓿叶片(2n=4x=32)为对照。调整分析仪的放大倍数,使对照的DNA峰值处在200道附近。峰值处在100道的样本为二倍体,而处在300和400道的分别为三倍体和八倍体,其余的为嵌合体。嵌合体又根据峰值位置确定其构成细胞的倍性。
3)将1)所得细胞核悬浮液用调整好的流式细胞仪进行检测,DNA含量的分布曲线图由仪器自动生成。
1.4 统计分析
用DPAC(Data Pool Application of Cytometre)软件分析DNA含量的分布曲线图,得出S期细胞百分率和DNA含量整倍性变异与非整倍性变异细胞百分率,采用SPSS 10.0软件分析愈伤组织继代时间与DNA含量变异率之间的关系。
2 结果与分析
2.1 苜蓿花药愈伤组织DNA含量分布曲线图的分析
将苜蓿愈伤组织细胞核悬浮液和苜蓿叶片细胞核悬浮液放入流式细胞仪进行DNA含量的测定,检测完毕后流式细胞仪自动生成DNA含量分布曲线图。
自选系大叶0510(2n=4x=32)叶片DNA含量分布曲线图中出现1个G1/G0峰值,峰值在200道附近(图1)。自选系大叶0510花药愈伤组织继代3周后的曲线图,除1个主峰外还有1个峰,位置位于主峰DNA含量2倍的地方(图2)。主峰峰值为107.23,第2个峰的峰值为194.16,它们的比值约等于2。由此可看出自选系大叶0510花药愈伤组织的一部分细胞倍性发生了变异。
其余23个样本的DNA含量分布曲线图均表现出与此相似的分布曲线,即DNA含量分布曲线图上均出现第2个峰,愈伤组织的一部分细胞倍性都发生了变异。另外,Sanditi的2个继代周期的样本、自选系大叶0510一个继代周期的样本DNA含量分布曲线图上还出现了3个峰的现象。说明愈伤组织在培养过程中不仅出现了染色体加倍的现象,而且出现了多倍性变异和非整倍变异的现象。
2.2 苜蓿花药愈伤组织S期细胞百分率及DNA含量变异率的分析
愈伤组织DNA含量出现加倍的现象,可能是愈伤组织出现了多倍性变异,也可能是愈伤组织细胞处于有丝分裂S期,DNA进行复制导致DNA含量加倍。为了证实DNA含量加倍是多倍性变异引起的还是由于细胞处于S期而出现的,采用DPAC分析软件对愈伤组织DNA含量分布曲线图进行分析,得到了自选系大叶0510、自选系多叶0501、Sanditi 8个继代周期愈伤组织DNA含量变异细胞百分率和S期细胞百分率(表1)。

图1 自选系大叶0510叶片DNA含量分布曲线图(对照)Fig.1 DNA content distribution of M.sativa leave(as control)

图2 自选系大叶0510花药愈伤组织DNA含量分布曲线图Fig.2 DNA content distribution of M.sativa callus

表1 3个基因型8个继代周期的紫花苜蓿愈伤组织DNA含量变异百分率和S期细胞百分率Table 1 The percentage of DNA content variation cells and the percentage of S stage cells of M.sativa callus
自选系大叶0510、自选系多叶0501、Sanditi的花药愈伤组织的8个继代培养周期的样本都出现DNA含量变异现象(表1),且不同基因型、不同继代时间DNA含量变异率都不相同。变异最大的是自选系大叶0510继代15周时的样本,DNA含量变异率达到19.45%。变异最小的是自选系多叶0501未经过继代培养的样本,DNA含量变异率为2.05%。
在8个继代培养周期中,自选系大叶0510的愈伤组织有5个阶段S期细胞百分率为0,不处于S期(表1);自选系多叶0501有2个阶段不处于S期;Sanditi有3个阶段不处于S期,这10个样本真正出现了多倍性变异。另外,自选系大叶0510愈伤组织继代9周的样本、自选系多叶0501愈伤组织继代15周的样本、Sanditi愈伤组织继代15周的样本,DNA含量变异细胞百分率都大于S期细胞百分率,说明这3个阶段的愈伤组织也出现了多倍性变异。从以上得出24个样本中有13个样本出现了多倍性变异,这表明约65%的愈伤组织真正出现了多倍性变异。由此可知,在紫花苜蓿愈伤组织中倍性变异是普遍存在的。另外,自选系大叶0510有2个继代培养阶段,自选系多叶0501有5个阶段,Sanditi有4个阶段愈伤组织的S期细胞百分率大于DNA含量变异细胞百分率,其原因可能是细胞分裂的非同步性造成的。细胞分裂在S期内不同的细胞所处状态不同,就可能出现S期细胞百分率较大而DNA含量变异细胞百分率较小的现象。细胞处在分裂间期的S期时,DNA进行复制,含量也会加倍,这会引起DNA含量变异细胞百分率增高,S期及细胞分裂结束后DNA含量变异细胞百分率会略有下降。
S期细胞数占整个细胞群体数目的比率反映细胞分裂程度。自选系大叶0510的愈伤组织在继代3周时细胞开始分裂,继代9周时停止分裂(表1)。自选系多叶0501未经继代的样本细胞已经开始分裂,继代15周时细胞停止分裂。Sanditi愈伤组织继代培养3周时细胞开始分裂,继代培养15周时停止分裂。说明紫花苜蓿愈伤组织品种间的细胞周期长短存在差异,自选系多叶0501愈伤组织生长周期最长,其次为Sanditi,而自选系大叶0510愈伤组织生长周期最短。
2.3 培养时间与DNA含量变异率之间的相关分析
通过DPAC软件对苜蓿花药愈伤组织DNA含量分布曲线图的分析表明,3个基因型花药愈伤组织继代时间不同,DNA含量变异细胞百分率也不同。
自选系大叶0510、自选系多叶0501、Sanditi的花药愈伤组织继代时间与DNA含量变异率之间的相关系数分别是r2=0.792(P<0.05)、r2=0.826(P<0.05)、r2=0.843(P<0.05)(图3~5),这说明二者具有相关性。自选系大叶0510的花药愈伤组织DNA含量变异细胞百分率在一定时间内,随着继代时间的增长,呈增加趋势。DNA含量变异细胞百分率在继代0~12周时迅速增加,为集中变异期。之后,随着继代次数的增加,逐渐趋于稳定。自选系多叶0501、Sanditi花药愈伤组织8个继代培养时间段中,DNA含量变异细胞百分率的时相分布呈相同的趋势。
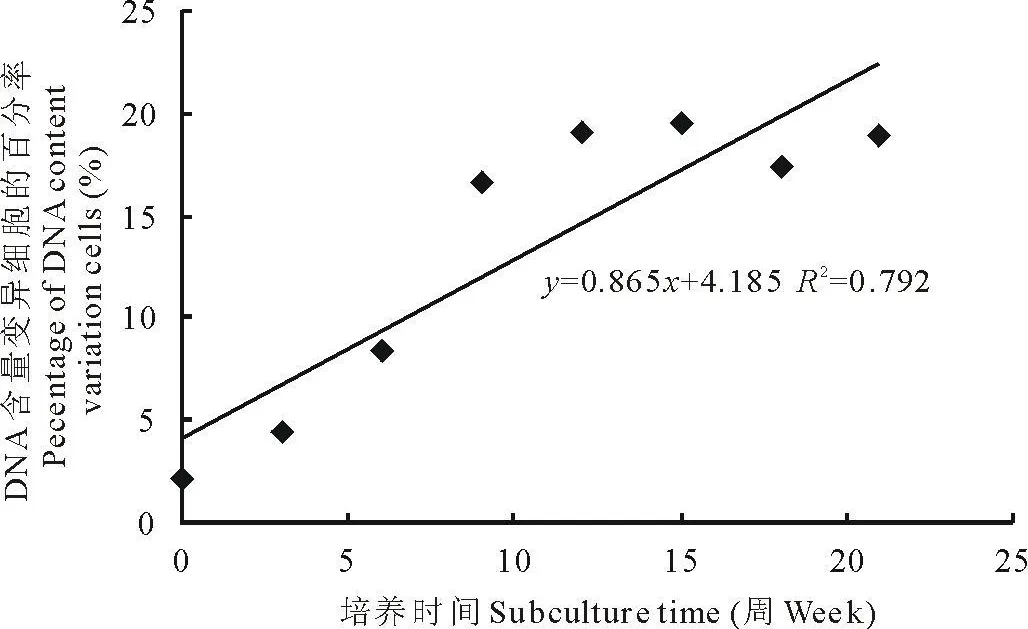
图3 自选系大叶0510花药愈伤组织在8个时间段中DNA含量变异细胞百分率时相分布Fig.3 Percentage of DNA content variation cells distribution of M.sativa callus in eight periods

图4 自选系多叶0501花药愈伤组织在8个时间段中DNA含量变异细胞的百分率时相分布Fig.4 Percentage of DNA content variation cells distribution of M.sativa callus in eight periods callus
3 讨论
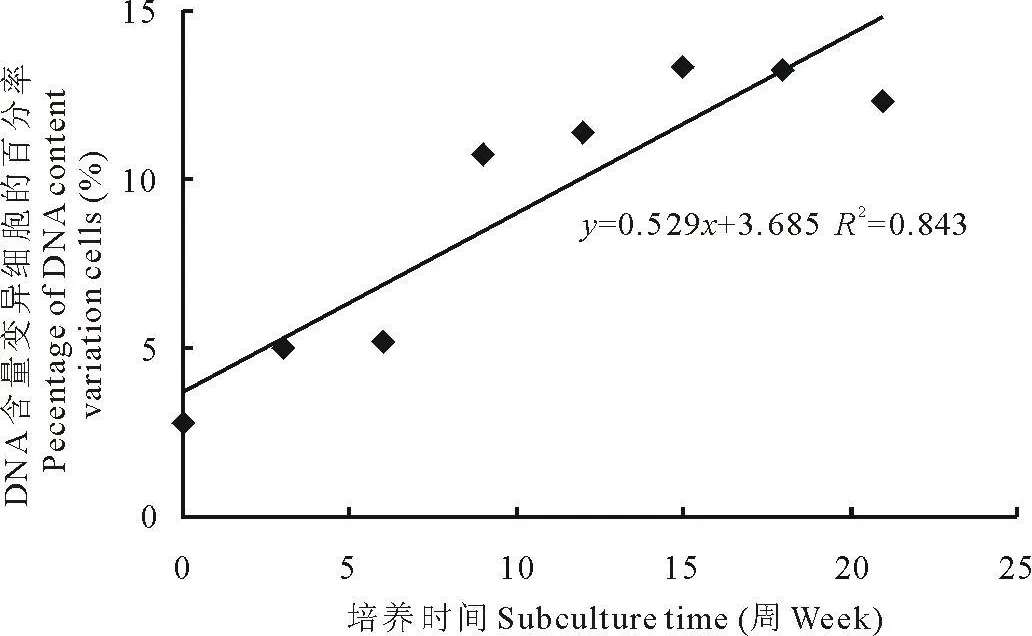
图5 Sanditi花药愈伤组织在8个时间段中DNA含量变异细胞的百分率时相分布图Fig.5 Percentage of DNA content variation cells distribution of M.sativa callus in eight periods
本试验通过流式细胞仪对3个基因型8个继代周期的苜蓿愈伤组织DNA含量进行测定,结果表明,在紫花苜蓿愈伤组织中倍性变异普遍存在。这与在玉米[5]、小麦(Triticum aestivum)[9,10]中的研究结果相同。绝大多数愈伤组织的第2个峰值是第1个峰值的2倍。这是因为,正在进行分化的细胞中,DNA不断地周期性复制,而不进入有丝分裂,结果产生多倍体细胞,这些细胞在正常条件下不再分裂,在离体条件下能诱导这些细胞分裂,则导致愈伤组织细胞倍性变异[15,16],愈伤组织的诱导阶段是体细胞变异的关键阶段,细胞的启动分裂也可能导致倍性变异[2]。苜蓿愈伤组织在培养过程中不仅出现了染色体加倍的现象,而且出现了多倍性变异和非整倍性变异。细胞倍性的变化表现出遗传的不稳定性,整倍体、非整倍体、混合体在许多植物的组培过程中都会出现[11,12]。这是由于在愈伤组织细胞中进行较多的无丝分裂,难以保证子细胞中染色体的稳定性,从而产生各种染色体数目变异,有丝分裂异常也可能导致子细胞中染色体数目和结构的变异[13,14]。但是,在愈伤组织中有DNA含量加倍的现象是否就一定是染色体数目发生变化,不能仅仅通过DNA含量分布来下结论,还需对其进行细胞周期分析。因为细胞处在分裂间期的S期时,DNA进行复制时DNA含量也会出现加倍的现象。
愈伤组织在继代过程中会发生大量的变异,长期继代的愈伤组织不仅分化能力下降,而且继代时间越长,变异越复杂,变异率越高[17,18]。本试验通过分析不同继代周期愈伤组织DNA变异细胞的百分率,发现随着继代时间的增长,染色体变异有增加的趋势。但是,这种趋势并不是随着时间的增长,无限增加的。继代0~12周是愈伤组织变异的高发期,以后随着继代次数的增加,变异趋向于稳定。这个结果可能是由于多倍体变异细胞在不断产生的同时也通过细胞程序性死亡途径不断被淘汰[19~21]形成的,所以DNA含量变化的细胞比例总在一定的范围之内。其他作物上也出现了相同的情况,如水稻愈伤组织在试管中继代时间越长,发生变异率越高[3]。继代20周的水稻花药再生植株发生性状改变的比例高达88%,而继代4~6周的再生植株发生性状改变的比例为63%;从染色体水平来看,愈伤组织继代时间不同,再生植株内染色体组的倍性变化也不同,不进行继代培养而分化成苗所形成的再生植株中单倍体、二倍体和多倍体的比例分别为57%,43%和0;但如果愈伤继代4~6周,再生植株中3种倍性植株的比例为20%,84%和3%;继代20周的愈伤再生植株中,这3种倍性植株的比例为7%,85%和11%[3]。Muller等[4]利用RFLP分子标记来研究不同继代时间对无性系变异的影响发现继代9周的愈伤再生植株RFLP多态性为23%,而继代4周的RFLP多态性为6.3%,说明长时间继代培养可增加体细胞无性系DNA的多态性。这意味着在植物组织培养过程中,减少继代次数或避开变异高发期可减少愈伤组织阶段的变异,进而获得遗传稳定性高的再生植株。通过分析不同继代次数愈伤组织的变异,可以更好的利用和避免紫花苜蓿组织培养过程中出现体细胞变异。
[1]杨磊,王彦荣,余进德.干旱荒漠区土壤种子库研究进展[J].草业学报,2010,19(2):227-234.
[2]Larkin P J,Scowcroft W P.Somalia variation a novel source of variability from cell-cultures for plant improvement[J].Theoretical and Applied Genetics,1981,60:197-214.
[3]Yoshida S Y,Kazuhiko W,M orihiro F J.Non-random game to clone variation in rice regenerate from callus subcultures for a prolonged period under high somatic stress[J].Euphytica,1998,104:87-94.
[4]Muller E,Brown P T,Harked S,et al.DNA variation in tissue-culture-derived rice plants[J].Theoretical and Applied Genetics,2001,80:673-679.
[5]谷明光.玉米花粉单倍体植株染色体上异染色质的变异[J].遗传学报,1991,18(3):235-238.
[6]崔广荣,张子学,张从宇.文心兰多倍体诱导及其鉴定[J].草业学报,2010,19(1):184-190.
[7]云岚,云锦凤,李俊琴.新麦草愈伤组织多倍体诱导与倍性鉴定[J].草业学报,2010,19(6):126-131.
[8]陈智勇,胡忠红,蒋建雄.早熟禾族3种基因型草坪草的染色体核型分析[J].草业学报,2010,19(6):281-285.
[9]李士生.小麦愈伤组织及再生植株的染色体变异[J].遗传学报,1991,18(4):332-338.
[10]梁虹,陈耀锋,王睿辉,等.小麦幼胚体细胞无性系及其继代过程的微观结构观察[J].西北农林科技大学学报(自然科学版),2005,6(9):62-67.
[11]Phillips R L,Kaepler S M,OLhoft P.Genetic Instability of Plant Tissue Culture:Breakdown if Normal Controls[M].Proceedings of the National Academy of Sciences USA,1998,91:5222-5226.
[12]Barcaccia G,Rosellini D,Falcinelli M,etal.Reproductive behaviour of tetraploid alfalfa plants obtained by unilateral and bilateral sexual polyploidization[J].Euphyatica,2002,99(3):18-24.
[13]胡钠梅,韩素英,梁国鲁.中间锦鸡儿染色体变异研究[J].生物技术通报,2009,10:75-79.
[14]张玉静.分子遗传学[M].北京:科学出版社,2001:27.
[15]商效民.植物离体培养中染色体的变异[J].细胞生物学杂志,1984,(1):5-12.
[16]黄晓梅,李桂英,梁艳,等.组织培养中大葱染色体倍性变异的研究[J].中国农学通报,2005,21(1):50-56.
[17]M yers J M,Simon P W.Regeneration of garlic callus as affected by colonel variation,plant growth regulators and culture conditions over time[J].Plant Cell Report,1999,19(1):32-36.
[18]Bouman H G,De Klert J.Measurement of the extent of soma clone variation in begonia plants regenerated under various conditions,comparison of three assays[J].Theoretical and Applied Genetics,2001,12(1):111-117.
[19]Hao Y J,You C X,Deng X X.Analysis of ploidy and the patterns of amplified fragment length polymorphism and methyl nation sensitive amplified polymorphism in strawberry plants recovered from cypresses ration[J].Cryoletters,2006,21:37-46.
[20]Hao Y J,You C X,Deng X X.Effects of cryopreservation on developmental competence,cytological and molecular stability of citrus callus[J].Cryoletters,2006,23(1):27-35.
[21]Hao Y J,Deng X X.Occurrence of chromosomal variations and plant regeneration from long-term cultured citrus callus[J].Biologia Plantarum,2002,38(5):32-38.

