一种有效检测水稻叶鞘低丰度蛋白的方法
王莹,崔为同,杨明峰,沈世华*
(1.中国科学院北京植物所,北京100093;2.中国科学院研究生院,北京100049)
蛋白质组学研究已成为21世纪生命科学的重要战略前沿,《科学》杂志将其列为六大研究热点之一[1]。在后基因组时代蛋白质组学发展迅速,对于探索基因功能日趋重要[2]。作为有力的分子生物学手段,蛋白质组学已被用来研究水稻(Oryza sativa)等作物生长发育和环境胁迫下蛋白质的表达[3-5]。
蛋白质组学研究中的关键步骤之一是样品的制备和分离。尽管色谱、同位素亲和标签(ICAT)和蛋白微列阵等技术已成功应用于蛋白质组学分析[6,7],双向凝胶电泳技术(2-DE)仍然是目前分析大量复杂蛋白样品的常用工具[8]。样品的制备是影响2-DE有效分辨率的关键因素,而蛋白分辨率可影响凝胶图像质量和蛋白分布[9]。蛋白样品的电泳分离常被一种或几种含量极度丰富的蛋白干扰,这些“超高丰度蛋白”限制低丰度蛋白的分辨率[10],而且数量庞大,可遮盖邻近蛋白点或影响其他蛋白点的电泳迁移[11,12]。例如,核酮糖-1,5-二磷酸羧化/加氧酶(rubicso)是光合作用中CO2固定的关键酶,也是植物中含量最丰富的蛋白[13]。叶片中rubisco含量非常丰富,在电泳共迁移过程中影响或遮盖邻近蛋白点[14],进而降低2-DE对低丰度蛋白的检测率。
降低样品体系复杂性,分离富集低丰度蛋白质的各种预分离技术近年来发展较快,并与现有的分离技术相结合,大幅度提高了低丰度蛋白的检测率[9,11,15-21]。但是,多数预分离技术比较昂贵或是耗时较长。PEG沉淀法是其中一种能够简单、快速地富集低丰度蛋白质的预分离方法。Sun等[22]采用20%PEG预处理水稻蛋白样品,rubisco大亚基为主的高丰度蛋白被分离到沉淀部分,取得很好的分离效果;Xi等[23]采用PEG分离法检测拟南芥(Arabidopsis thaliana)中低丰度蛋白,报道rubisco大亚基可被16%PEG沉淀;Lee等[24]采用15%PEG分离法检测了水稻幼苗叶片中响应低温胁迫的低丰度蛋白,取得了良好分离效果。
水稻、玉米(Zea mays)和小麦(Triticum aestivum)等禾谷类植物被广泛研究[25-28]。叶鞘常被作为研究禾谷类作物库源转化的特殊器官[29],已有关于水稻灌浆期叶鞘蛋白质组学分析的报道[30]。叶鞘也进行一部分光合作用,因此该器官内也含有大量光合作用相关酶类,尤其是 rubisco的存在严重干扰叶鞘低丰度蛋白的检测和分析,目前尚无提高叶鞘低丰度蛋白鉴定率的报道。本研究分别采用15%和20%PEG预分离法富集低丰度蛋白,旨在探索一种叶鞘低丰度蛋白的鉴定方法,为单子叶植物叶鞘蛋白质组学研究提供参考。
1 材料与方法
1.1 材料
将水稻9311(Oryza sativa ssp.indica cultivar 93-11)于正常水稻生长季节种植于北京中国科学院植物研究所实验温室内,常规水肥管理。自然光照下,生长70 d左右,待水稻生长至灌浆期,剪取水稻剑叶的叶鞘作为实验材料,液氮速冻后储藏于-80℃冰箱里。
1.2 蛋白质提取
1.2.1 Mg/NP-40法 蛋白质提取方法参照Kim等[31]的方法,略作修改。将0.5 g材料在液氮中研磨成精细的粉末,然后加入3 mL预冷的Mg/NP-40提取液[0.5 mol/L T ris-HCl(pH 8.3),2%(v/v)乙基苯基聚乙二醇(NP-40),20 mmol/L氯化镁,1 mmol/L苯甲基磺酰氟(PMSF),2%(v/v)β-巯基乙醇],在冰上充分研磨。4℃下12 791 r/min离心匀浆液10 min,弃沉淀。上清液中加入4倍体积丙酮,-20℃沉淀30 min。相同条件下再次离心后,弃上清。沉淀用丙酮清洗,4℃下12 791 r/min离心10 min,清洗3次。将沉淀真空干燥即得到可溶性全蛋白干粉(NF)。
1.2.2 Mg/NP-40法(PEG预分离) PEG沉淀方法参照Kim等[31]和Yang等[32]的方法,并作修改。将0.5 g材料在液氮中研磨成精细的粉末,然后加入3 mL预冷的Mg/NP-40提取液,在冰上研磨充分。4℃下12 791 r/min离心10 min,弃沉淀。上清中加入50%(w/v)PEG-4000至终浓度为15%或20%(w/v)。混匀,冰上沉淀30 min。4℃下12 791 r/min离心10 min。离心后上清加入4倍体积丙酮,置于-20℃沉淀30 min。4℃下12 791 r/min离心10 min,取沉淀用丙酮清洗4次后真空干燥得到15%或20%PEG预分离上清组分(AF1或BF1)。离心后沉淀用丙酮清洗4次,真空干燥得到15%或20%PEG预分离沉淀组分(AF2或BF2)。
1.3 双向凝胶电泳
双向凝胶电泳方法参照Yang等[32]的方法,略作修改。将蛋白干粉溶于裂解液:7 mol/L尿素,2 mol/L硫脲,4%(w/v)3-[3-(胆酰氨丙基)二甲氨基]丙磺酸内盐,2%(v/v)两性电解质(pH 3.5~10),5%(v/v)β-巯基乙醇,1%(w/v)二硫苏糖醇。NF、AF1、AF2、BF1和BF2蛋白上样量均为600 μ g。第一向等电聚焦(IEF)在长13cm、直径3mm的玻璃管内进行。注射器灌胶[2%(v/v)NP-40,3.6%(w/v)丙烯酰胺,8 mol/L尿素,2.5%(v/v)两性电解质(pH 3.5~10),2.5%(v/v)两性电解质(pH 5~8)]。胶条聚合完全后,加入溶有蛋白样品的裂解液,其上覆盖30 μ L的50%裂解液。最后加入上槽电极缓冲液(20 mmol/L氢氧化钠)及下槽电极缓冲液(6.67 mmol/L磷酸),等点聚焦200,400和800 V分别进行0.5,15和1 h。聚焦完毕后,从凝胶管中取出胶条,放入平衡缓冲液[62.5 mmol/L Tris-HCL(pH 6.8),2.5%(w/v)十二烷基磺酸钠,10%(v/v)甘油,5%(v/v)β-巯基乙醇]中。振荡平衡2次,每次15 min。然后转移胶条至分离胶浓度为15%,浓缩胶浓度为5%的聚丙烯酰胺凝胶(SDS-PAGE)上端进行第二向垂直电泳。双向电泳后,使用0.1%的考马斯亮蓝R-250(CBB-R-250)染色。
1.4 蛋白质凝胶扫描及图像分析
脱色后的凝胶用UMAX扫描仪扫描。使用ImageMaster凝胶分析软件对凝胶进行分析。
1.5 统计分析
所得数据经SPSS 14.0软件统计分析。
2 结果与分析
2.1 2-DE图谱
为测试PEG分离法是否适用于灌浆期水稻叶鞘低丰度蛋白的鉴定,分别将可溶性全蛋白(NF)、15%PEG预分离的上清蛋白(AF1)、15%PEG预分离的沉淀蛋白(AF2)、20%PEG预分离的上清蛋白(BF1)和20%PEG预分离的沉淀蛋白(BF2)进行2-DE(图1)。
经ImageMaster 2D Platinum软件分析,并计算各提取方法所检测到的总蛋白种类(表1)。15%和20%PEG沉淀法预分离上清分别检测到642和806个蛋白点,而沉淀分别检测到882和695个蛋白点。TCA/丙酮法检测到733个蛋白点,除去上清与沉淀中重叠的蛋白点,15%和20%PEG沉淀法检测到的蛋白点分别为1 042和1 023个。15%和20%PEG沉淀法所得的蛋白点大概相同,均显著(P<0.05)高于TCA/丙酮法检测到的蛋白点数。

图1 PEG预分离各组分与对照凝胶电泳图谱Fig.1 Comparison of 2-DE gel electrophoresis protein patterns of Mg/NP-40 method with PEG fractionation(AF1,AF2,BF1,BF2)and no PEG fractionation(NF)

表1 不同分离方法的2-DE图谱上蛋白点数Table 1 Number of spots of different methods
2.2 rubisco大亚基
NF的2-DE图谱上rubisco大亚基蛋白点影响或遮盖其周围的蛋白点(图2)。经PEG沉淀后AF1和BF1图谱上的rubisco大亚基显著减小(P<0.05)。采用ImageMaster 2D软件分析,以计算rubisco大亚基相对蛋白点体积在经PEG沉淀后的变化(图3)。未经PEG预分离的全蛋白图谱上,rubisco大亚基占全部蛋白的16.9%。经15%PEG沉淀后,rubisco大亚基下降55.9%,20%PEG沉淀后下降92.7%。可见,20%PEG沉淀rubisco的效果较好。
2.3 低丰度蛋白
与未经PEG分离提取的蛋白2-DE图谱相比较,PEG预分离后上清蛋白2-DE图谱上检测到的蛋白点的数目增多。如图4所示,仅在2-DE图谱的B和C两个小区域上,PEG预分离法的采用使得可检测蛋白点的数目显著增多。
参照Krishnan和Natarajan[33]的方法,将PEG预分离上清蛋白2-DE胶上表达上调3倍以上,且在可溶性全蛋白图谱上很微弱或检测不到的蛋白点,认为是PEG预分离法检测到的低丰度蛋白点。使用ImageMaster 2D软件,将AF1和BF1的2-DE图谱分别与NF进行比较分析。结果显示,AF1的2-DE胶上可检测到低丰度蛋白点共有62个,而BF1可检测到119个。显然,20%PEG沉淀法可检测到灌浆期水稻叶鞘中更多种类的低丰度蛋白。
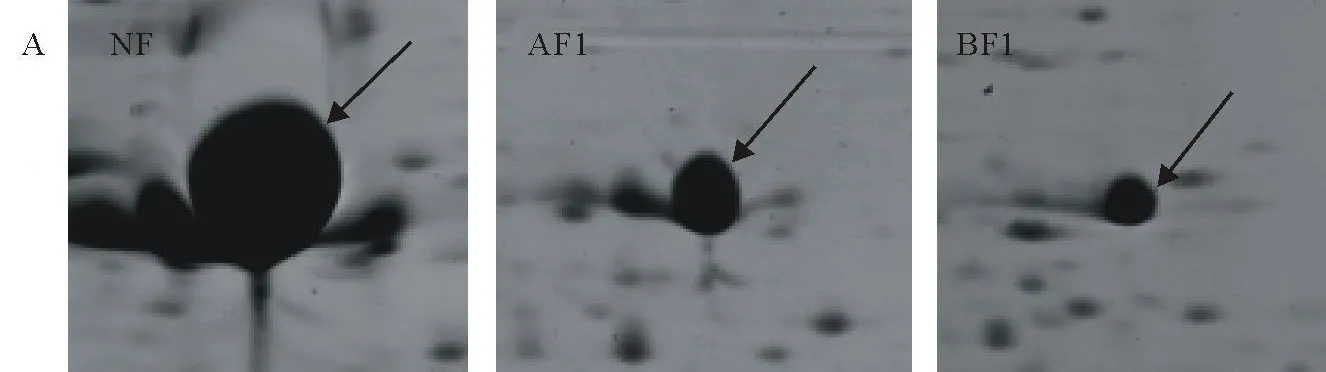
图2 PEG预分离法沉淀 rubisco大亚基效果Fig.2 PEG fractionation decreased rubisco large subunit in 2-DE analysis

图3 不同分离方法2-DE图谱rubisco大亚基相对丰度百分比Fig.3 Relative spot volume of rubisco large subunit using different methods
3 讨论
在现今的蛋白质组学研究中,低丰度蛋白备受关注。细胞或组织中受体分子、信号分子等参与基因表达调控的蛋白均是低丰度蛋白,而在细胞中拷贝数众多的高丰度蛋白,如rubisco等一般不参与基因调控[8]。结合双向凝胶电泳的预分离技术已成为蛋白质组学中分析低丰度蛋白的有力工具。

图4 PEG分离法增加2-DE图谱上可检测低丰度蛋白点数目Fig.4 15%and 20%PEG fractionation increased detectable proteins in 2-DE analysis
以rubisco为主的高丰度蛋白的存在严重影响叶片低丰度蛋白的检测和分析,文献报道PEG分离法主要是分离沉淀rubisco大亚基[22-24]。本研究采用简便PEG预分离方法去除水稻叶鞘中的rubisco,探索适用于水稻叶鞘低丰度蛋白的检测方法。前人报道证明PEG可有效分离沉淀rubisco,而不同样品蛋白的预分离所需PEG浓度不同。本研究分别采用15%和20%PEG,以测定适用于叶鞘低丰度蛋白检测的PEG浓度。
与未经PEG预分离的方法相比较,15%PEG沉淀可使rubisco大亚基相对蛋白点体积下降55.9%,而20%PEG沉淀法可降低92.7%。采用20%PEG预分离水稻叶鞘蛋白,可有效去除rubisco大亚基。PEG预分离的目的是富集低丰度蛋白,15%PEG沉淀法可检测到62个低丰度蛋白,而20%PEG可检测到119个。证明20%PEG对于灌浆期水稻叶鞘高丰度蛋白的减少和低丰度蛋白的富集效果显著。与传统的未经PEG预分离的TCA/丙酮法相比,采用15%和20%PEG分别预分离后经2-DE检测到的全蛋白种类均显著升高(P<0.05),而2种浓度PEG沉淀方法所检测到全蛋白种类差异并不显著。由此看来,20%PEG预分离方法不仅适于低丰度蛋白的鉴定,也适用于全蛋白表达的鉴定。
4 结论
PEG沉淀法是富集低丰度蛋白的方法之一。本研究采用水稻叶鞘为材料,分析了不同浓度PEG对rubisco的分离效果。研究发现,20%PEG分离法非常适合于鉴定水稻叶鞘中的低丰度蛋白,这些工作可为进一步研究水稻叶鞘差异蛋白质组学提供参考。
[1]曾嵘,夏其昌.蛋白质组学研究进展与趋势[J].中国科学院院刊,2002,17(3):166-169.
[2]Phizicky E,Bastiaens,Zhu H,et al.Protein analysis on a proteomic scale[J].Nature,2003,422:208-215.
[3]Imin N,Kerim T,Rolfe B G,et al.Effect of early cold stress on the maturation of rice anthers[J].Proteomics,2004,4:1873-1882.
[4]Imin N,Kerim T,Weinman J J,et al.Low temperature treatment at the young microspore stage induces protein changes in rice anthers[J].Molecular Cellular Proteomics,2006,5:274-292.
[5]Yan S P,Zhang Q Y,Tang Z C,et al.Comparative proteomic analysis provides new insights into chilling stress responses in rice[J].Molecular Cellular Proteomics,2006,5:484-496.
[6]Adam G C,Sorensen E J,Cravatt B F.Chemical strategies for functional proteomics[J].Molecular Cellular Proteomics,2002,1:781-790.
[7]Templin M F,Stoll D,Schwenk J M,et al.Protein microarrays:promising tools for proteomic research[J].Proteomics,2003,3:2155-2166.
[8]Gö rg A,Weiss W,Dunn M J.Current two-dimensional eletrophoresis technology for proteomics[J].Proteomics,2004,4:3665-3685.
[9]Lilley K S,Razzaq A,Dupree P.Two-dimensional gel electrophoresis:recent advances in sample preparation,detection and quantitation[J].Current Opinion in Chemical Biology,2002,6:46-50.
[10]Herman E M,Helm R M,Jung R,etal.Genetic modification removes an immunodominant allergen from soybean[J].Plant Physiology,2003,132:36-43.
[11]Cho J H,Hwang H,Cho M H,et al.The effect of DT T in protein preparations for proteomic analysis:removal of a highly abundant plant enzyme,ribulose bisphosphate carboxylase/oxygenase[J].Plant Biology,2008,51:297-301.
[12]Shaw M M,Riederer B M.Sample preparation for two-dimensional gelelectrophoresis[J].Proteomics,2003,3:1408-1417.
[13]Gutteridge S,Gatenby A A.Rubisco systhesis,assembly,mechanism,and regulation[J].Plant Cell,1995,7:809-819.
[14]Corthals G L,Wasinger V C,Hochstrasser D F,et al.The dynamic range of protein expression:a challenge for proteomic research[J].Electrophoresis,2000,21:1104-1115.
[15]Pier G R,Annalisa C,Ben H.Prefractionation techniques in proteome analysis[J].Proteomics,2003,3:1397-1407.
[16]Pier G R,Annalisa C,Paolo A.Prefractionation techniquesin proteome analysis:The mining tools of the thirdmillennium[J].Electrophoresis,2005,26:297-319.
[17]Peltier J B,Ripoll D R,Friso G,et al.Clp protease complexes from photosynthetic and non-photosynthetic plastids and mitochondria of plants,their predicted three-dimensional structures,and functional implication[J].Journal of Biological Chemistry,2004,279(6):4768-4781.
[18]Wienkoop S,Glinski M,Tanaka N,etal.Linking protein fractionation with multidimensional monolithic reversed-phase pep-tide chromatography/mass spectrometry enhances protein identification from complex mixtures even in the presence of abundant proteins[J].Rapid Commun Mass Spectrom,2004,18:643-650.
[19]Espagne C,Martinez A,Valot B,et al.Alternative and effective proteomic analysis in Arabidopsis[J].Proteomics,2007,7:3788-3799.
[20]Kwanyuen P,Allina S M,Weissinger A K,et al.A new form of crystalline rubisco and the conversion too its common dodecahedral form[J].Joural of Proteome Research,2002,1:471-473.
[21]Widjaja I,Naumann K,Roth U,et al.Combining subproteome enrichment and Rubisco depletion enables identification of low-abundance proteins differentially regulated during plant defense[J].Proteomics,2009,9:138-147.
[22]Sun T K,Kyu S C,Yu S J,et al.Two-dimensional electrophoresis analysis of rice proteins by polyethylene glycol fractionation for protein arrays[J].Electrophoresis,2001,22:2103-2109.
[23]Xi J H,Wang X,Li S Y,etal.Polyethylene glycol fractionation improved detection of low-abundant proteins by two-dimensional electrophoresis analysis of plant proteome[J].Phytochemistry,2006,67:2341-2348.
[24]Lee D G,Ahsan N,Lee S H,et al.An approach toidentify cold-induced low-abundant proteins in rice leaf[J].Comptes Rendus Biologies,2007,330:215-225.
[25]苏衍菁,赵国琦,王小山,等.不同生育期脆性突变水稻细胞壁组分动态研究[J].草业学报,2010,19(1):151-157.
[26]常宏,王汉宁,张金文,等.玉米品种真实性和纯度鉴定的SSR标记多重PCR体系优化[J].草业学报,2010,19(2):204-211.
[27]邵宏波,梁宗锁,邵明安.小麦抗旱生理生化和分子生物学研究进展与趋势[J].草业学报,2006,15(3):5-17.
[28]惠文森,穆晓峰,王康英.草坪草屑叶蛋白质提取方法研究[J].草业科学,2009,26(3):108-110.
[29]Tatsuro H,Alexander E,Ryu O.Gene expression of enzymes for starch ad sucrose metabolism and transport in leaf sheaths of rice(Oryza sativa L.)during the heading period in relation to the sink to source transition[J].Plant Production Science,1999,2:178-183.
[30]李兆伟,熊君,李振方,等.水稻灌浆期叶鞘蛋白质差异表达分析[J].作物学报,2008,34(4):619-626.
[31]Kim S T,Cho K S,Jang Y S,etal.Two-dimensionalelectrophoretic analysis of rice proteins by polyethylene glycol fractionation for protein arrays[J].Electrophoresis,2001,22:2103-2109.
[32]Yang P F,Liang Y,Shen S H,et al.Proteome analysis of rice uppermost internodes at the milky stage[J].Proteomics,2006,6:3330-3338.
[33]Krishnan H B,Natarajan S S.A rapid method for depletion of Rubisco from soybean(Glycinemax)leaf for proteomic analysis of lower abundance proteins[J].Phytochemistry,2009,70:1958-1964.

