黑皮素-1受体在瘢痕疙瘩中的表达及基因沉默黑皮素-1受体对成纤维细胞增殖的影响
吕川 戴海英 张敬德 王晓芸
黑皮素-1受体在瘢痕疙瘩中的表达及基因沉默黑皮素-1受体对成纤维细胞增殖的影响
吕川 戴海英 张敬德 王晓芸
目的检测黑皮素-1受体(MC-1R)在瘢痕疙瘩中的表达,同时研究基因沉默黑皮素-1受体对成纤维细胞增殖的影响。方法用MTT法比较α-MSH对正常皮肤成纤维细胞(hDF)和瘢痕疙瘩成纤维细胞(hKF)增殖能力的影响;用qPCR法检测正常皮肤及瘢痕疙瘩组织中MC-1R的表达水平;用MTT法检测RNA干扰MC-1R基因后对α-MSH抑制hDF增殖能力的影响。结果α-MSH可抑制hDF的增殖,而未对hKF的增殖产生明显影响;与正常皮肤组织相比,瘢痕疙瘩组织中MC-1R的mRNA表达水平明显下降,而α-MSH的表达增加;最后,将hDF转染MC-1R siRNA后,α-MSH对其增殖能力的抑制程度显著降低。结论瘢痕疙瘩中MC-1R表达降低,导致α-MSH抑制hKF增殖的功能无法实现,促进了瘢痕疙瘩的形成。
瘢痕疙瘩黑皮素-1受体促黑素细胞激素成纤维细胞增殖
瘢痕疙瘩多发生于选择性手术或创伤术后,组织学上以成纤维细胞的过度增殖和胶原过度合成为特征,但目前对其复杂的机制了解甚少,尚无有效治疗方法[1]。促黑素细胞激素(Melanocyte-stimul-ating hormone,MSH)是一种内源性神经免疫调节肽,可分为α-MSH、β-MSH、γ-MSH等3种。近年来,越来越多的研究表明,α-MSH通过作用于其受体黑皮素-1受体(MC-1R)参与调节瘢痕的形成过程。本实验通过对比瘢痕疙瘩成纤维细胞和正常皮肤成纤维细胞中MC-1R的表达,以及基因沉默正常成纤维细胞中的MC-1R,研究α-MSH及其受体在瘢痕疙瘩形成中的作用。
1 材料与方法
1.1 材料与试剂
siRNA由上海吉玛生物制药公司合成,序列为5'-CGUGAUCACCUGCAGCUCCUU-3',5'-AAGGAGCTGCAGGTGATCACG-3'。siRNA脂质体转染试剂(Interferin)购自法国Polyplus公司,四甲基偶氮唑蓝(MTT)购自美国Sigma公司,Trizol试剂和RT-PCR试剂盒购自美国Invitrogen公司,α-MSH为德国Biosciences公司产品。
1.2 实验对象
正常皮肤和瘢痕疙瘩组织各8例,供者均系本科患者,并征得患者知情同意。患者年龄16~48岁,男7例,女9例。标本切取后一部分应用组织块法进行成纤维细胞原代培养;其余部分在30 min内放入液氮中,置入-80℃冰箱中保存,待提取细胞总RNA。
1.3 实验方法
1.3.1 组织块培养法
无菌切取正常皮肤标本、瘢痕疙瘩标本,75%乙醇浸泡2 min,PBS冲洗2次后,剪成约1 mm3碎块,置于25 cm2的培养瓶,加入含10%胎牛血清的DMEM培养基,倒置放入孵箱,7 h左右轻轻翻正,在37℃、5%CO2和95%湿度条件下培养。以后每3天换液1次。待成纤维细胞从组织块边缘长出,达80%亚汇合状态时,按1∶3传代培养。第4~7代的细胞用于实验。
1.3.2realtime RT-PCR检测
使用Trizol(购自Invitrogen公司)试剂提取细胞总RNA,使用反转录试剂盒(购自Toyobo公司)反转录为cDNA。定量PCR引物序列为,MC-1R:5'-CCTGCTGGTGAGCGGGA-3'(上游),5'-ACGGCCATGAGCACCAG-3'(下游);α-MSH:5'-TAAGGACAGAGGAGCGCGGGA-3'(上游),5'-TCTCCTGGTGGAACAGCCACTG-3'(下游);β-actin:5'-GGCGGCACCACCATGTACCCT-3'(上游),5'-AGGGGCCGGACTCGTCATACT-3'(下游)。反应条件为94℃预变性1 min,94℃变性30 sec,55℃退火30 sec,72℃延伸30 sec,共循环40次,由罗式Lightcycler 1.5定量PCR仪检测并计算分析Ct值,相对定量采用2-ΔΔCt法计算。
1.3.3MTT法检测
取对数生长期的成纤维细胞,以每孔2×103个细胞接种于96孔培养板,每组设6个重复孔。培养液中加入MTT,放入培养箱继续培养4 h后,每孔加入DMSO 150 μL,振荡10 min溶解。波长570 nm下,用酶联免疫检测仪测定各孔光吸收值,检测成纤维细胞的增殖情况。
1.3.4RNA干扰
1×104个细胞铺入96孔板中并培养过夜,次日使用脂质体转染试剂Interferin转染siRNA,按说明书标准操作,转染终浓度为40 nM。
1.3.5Western blot检测
蛋白浓度检测使用BCA蛋白定量试剂盒(购自Pierce公司)。Western blot按标准操作步骤进行,MC-1R、β-actin及相应HRP酶标二抗均购自Santa Cruz公司。
1.4 统计学处理
组间差异采用Student’s t检验计算,P<0.05认为有统计学意义。
2 结果
2.1 α-MSH对正常皮肤和瘢痕疙瘩两种来源成纤维细胞的作用
将正常皮肤成纤维细胞(hDF)和瘢痕疙瘩成纤维细胞(hKF)分别分为2组,一组为对照组,用正常培养基培养,另一组为α-MSH处理组,在培养基中加入终浓度为10-6mmol/L的α-MSH处理细胞。处理0 h、48 h和96 h后,用MTT法检测细胞增殖情况。结果显示,α-MSH可抑制hDF的增殖能力(图1左),而未对hKF的增殖产生明显影响(图1右)。
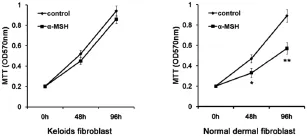
图1 α-MSH对正常皮肤和瘢痕疙瘩成纤维细胞增殖的影响Fig.1The effect of α-MSH on the proliferation of fibroblasts derived from normal skin and keloids

图2 qPCR检测正常皮肤和瘢痕组织中MC-1R和α-MSH的mRNA表达水平Fig.2The expression of MC-1R and α-MSH mRNA in normal skin and keloids by qPCR
2.2qPCR检测正常皮肤和瘢痕疙瘩组织中MC-1R和α-MSH的mRNA表达水平
与正常皮肤相比,瘢痕疙瘩组织中MC-1R表达水平降低(图2A),而α-MSH水平升高(图2B),差异有统计学意义(P<0.01),提示hKF表型发生了改变,MC-1R表达减少,而α-MSH代偿性升高。
2.3 MC-1R RNA干扰的效果分析
hDF细胞经转染MC-1R siRNA 48 h及72 h后,通过检测MC-1R mRNA发现:MC-1R siRNA能够显著抑制MC-1R mRNA的表达(图3A)。通过转染后72 h检测MC-1R蛋白水平发现,MC-1R的蛋白表达水平也能被MC-1R的siRNA抑制(图3B)。这些结果证明了MC-1R RNA干扰的有效性。

图3 MC-1R RNA干扰的效果分析Fig.3The knockdown efficacy of MC-1R siRNA
2.4MC-1R RNA干扰对α-MSH抑制hDF增殖作用的影响
hDF经转染MC-1R siRNA后,用α-MSH分别处理0 h、48 h和96 h,然后用MTT法检测细胞增殖情况。结果显示,将hDF的MC-1R基因沉默后,α-MSH不能发挥对hDF增殖能力的抑制作用。在α-MSH处理后,与转染对照组相比,转染MC-1R siRNA的hDF增殖能力强,差异显著(P<0.05)(图4)。
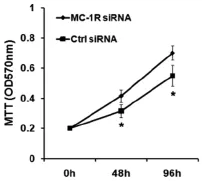
图4 MC-1R RNA干扰对α-MSH抑制hDF增殖作用的影响Fig.4The influence of MC-1R siRNA on the α-MSH inhibitory effect of hDF proliferation
3 讨论
异常的创伤愈合会导致瘢痕疙瘩的形成,典型症状为超出原伤口界限向周围组织侵入性生长,表面光滑,存在时间长,不能自愈,切除后易复发,可造成局部瘙痒、疼痛以及挛缩,给患者带来生理和心理上的痛苦[2-3]。瘢痕疙瘩的形成经过3个病理阶段,分别为炎症期、增殖期和成熟期,成纤维细胞是这一过程中的效应细胞,成纤维细胞的过度增殖和功能活跃导致细胞外基质(ECM)的过度沉积是瘢痕疙瘩的组织学基础[4]。
MSH是一种内源性神经免疫调节肽,可分为α-MSH、β-MSH、γ-MSH 3种。最早发现α-MSH的生物功能主要是调控皮肤色素沉着过程。黑皮素受体(Melanocortin receptor,MCR)共有5种亚型:MC-1R、MC-2R、MC-3R、MC-4R和MC-5R,正常黑素细胞可表达多种MCR,而成纤维细胞仅表达MC-1R[5]。
瘢痕疙瘩的形成可能与MSH的异常代谢有关,且众多临床现象也支持这一结论:①黑种人瘢痕疙瘩发生率高,该人种的黑素细胞对MSH的刺激反应敏感;②白化病患者很少发生瘢痕疙瘩;③瘢痕疙瘩主要发生在身体黑素细胞较多的部位,而在黑素细胞较少的部位如手掌、足底等处,则罕见瘢痕疙瘩发生;④瘢痕疙瘩在垂体功能活跃期,如青春期和妊娠期发病率高,该期伴随着皮肤色素增加;⑤氢化可的松类药物可抑制瘢痕疙瘩的生长,这种类固醇药物具有抑制MSH产生的作用[6-7]。也有研究显示,瘢痕疙瘩组织中α-MSH水平明显高于正常瘢痕及正常皮肤组织[8]。上述结果提示,α-MSH与瘢痕疙瘩的形成有正向调控关系。
同时又有更多文献证实,α-MSH可能对瘢痕形成具有抑制性的调控作用。α-MSH可诱导成纤维细胞分泌胶原酶,而胶原酶是分解细胞外基质的重要蛋白酶,是抑制瘢痕形成的重要环节[9];α-MSH还可通过转录后调控机制抑制TGF-β诱导的成纤维细胞胶原的合成[10]。白介素-1(IL-1)可诱导成纤维细胞分泌IL-8,α-干扰素可激活成纤维细胞中转录因子激活蛋白-1(AP-1)并诱导其生成细胞间黏附因子-1(ICAM-1),而α-MSH可通过抑制以上机制而进行免疫调控,拮抗炎症反应,最终抑制胶原合成和促进胶原降解[11]。由于成纤维细胞发生表型改变是瘢痕形成过程中的关键事件,与正常成纤维细胞相比,瘢痕中的成纤维细胞高表达生长因子受体,使其更迅速对PDGF和TGF-β等生长因子做出应答,从而有利于瘢痕形成[12]。因此,我们假设瘢痕疙瘩成纤维细胞(hkF)中α-MSH受体异常,从而使得α-MSH无法实现对瘢痕形成的抑制性调控。
本实验研究了α-MSH对成纤维细胞增殖的作用。MTT结果显示,α-MSH可抑制hDF的增殖,而对hKF增殖的影响没有统计学意义;通过qPCR检测了瘢痕疙瘩和正常皮肤中MC-1R和α-MSH的表达。结果显示,与正常皮肤组织相比,瘢痕疙瘩组织中MC-1R的mRNA表达水平明显下降,而α-MSH的表达增加;将hDF转染MC-1R siRNA后,α-MSH对其增殖能力的抑制程度显著降低。以上结果验证了我们的假设,说明α-MSH通过与其受体MC-1R结合,发挥对成纤维细胞增殖的负向调控;而hkF中MC-1R表达降低,导致α-MSH功能无法实现,并出现代偿性高表达,最终成纤维细胞增殖过快促进瘢痕疙瘩的形成。本实验为深入了解瘢痕疙瘩的形成提供了新的证据,并为瘢痕疙瘩的有效治疗提供了实验依据。
[1]Gauglitz GG,Korting HC,Pavicic T,et al.Hypertrophic scarring and keloids:pathomechanisms and current and emerging treatment strategies[J].Mol Med,2011,17(1-2):113-125.
[2]Peacock EE Jr,Madden JW,Trier WC.Biologic basis for the treatment of keloids and hypertrophic scars[J].South Med J,1970,
The Expression of Melanocortin 1 Receptor in Keloids and the Effects of Its Gene Silencing in Fibroblasts Proliferation
ObjectiveTo investigate the expression of melanocortin 1 receptor(MC-1R)in keloids and the effects of its gene silencing in fibroblasts proliferation.MethodsThe effects of α-MSH on the proliferation of normal dermal fibroblast (hDF)and keloids fibroblast(hKF)were detected by MTT assay;The expression of MC-1R mRNA was detected by qPCR in normal skin tissue and keloids;After the gene silencing of MC-1R,the proliferation of hDF inhibited by α-MSH was detected by MTT assay.Resultsα-MSH could inhibit the proliferation of hDF rather than hKF;Compared with normal skin tissue,the expression of α-MSH mRNA was increased in keloids while the expression of MC-1R mRNA was decreased; After the transfection of MC-1R siRNA,the inhibitory effect of α-MSH on hDF proliferation was decreased obviously. Conclusion The expression of MC-1R is decreased in keloids,which leads to malfunction of proliferation-inhibitory effect of α-MSH and finally results in keloids formation.
Keloids;Melanocortin 1 receptor;Α-melanocyte-stimulating hormone;Fibroblast;Proliferation
R619+.6
A
1673-0364(2011)03-0147-04
LU Chuan,DAI Haiying,ZHANG Jingde,WANG Xiaoyun.
Department of Plastic Surgery,Changhai Hospital,The Second Military Medical University,Shanghai 200433,China.Corresponding author:ZHANG Jingde(E-mail: E-mail:zhangjd789@sohu.com).
10.3969/j.issn.1673-0364.2011.03.007
上海市自然科学基金项目(09ZR1400600)。
200433上海市第二军医大学附属长海医院整形外科。
张敬德(E-mail:zhangjd789@sohu.com)。

