宫颈上皮内瘤变诊治中二次病理结果分析
江卫红,朱翠婷,刘惠媚,姚蔼娉
(深圳市福田区第二人民医院妇产科,广东 深圳 518049)
子宫颈癌是女性肿瘤最常见之一,要降低宫颈癌的发病率,防治结合的重点是要清除宫颈癌前病变,即CIN;液基薄层细胞学、阴道镜、活组织检查三阶梯在诊治宫颈癌前期病变中的应用,提高了CIN的检出率。本文对2006年6月至2010年12月在本院经三阶梯确诊为CIN的病例105例进行LEEP治疗,清除病灶,并送病检。将LEEP病理与阴道镜下活检病理进行回顾性对比分析。
1 资料与方法
1.1 一般资料 2006年6月至2010年12月,我院经液基薄层细胞学检测(TCT)、高危型人乳头瘤病毒(HR-HPV)检测并在阴道镜下取活检,病理组织学检查确诊为CIN共105例。其中CINⅠ35例,CINⅡ62例,CINⅢ8例,合并有HR-HPV感染81例(CINⅠ17例,CINⅡ56例,CINⅢ 8例),年龄24~53岁,平均35.6岁。
1.2 方法
1.2.1 术前准备 除绝经者外,治疗时间均选择月经第2~7 d。术前盆腔检查正常,常规行阴道分泌物涂片排除霉菌及滴虫性阴道炎等生殖道急性或特殊感染,出、凝血时间正常。
1.2.2 LEEP手术方法 行“牛仔帽”术式,切除范围在病变的移行带以外3~5 mm,深度以不同病变程度而异,对不同深度和广度的切割选择不同尺寸的电圈,创面用球形电极电凝即可止血。
1.3 术后处理及随访 术后处理:术毕阴道后窟窿放置保妇康栓,2枚/d,持续2~3个月,经期停用。并口服抗菌素预防性抗感染治疗,并给予妇科千金胶囊清热除湿,减少LEEP术后下腹痛及阴道分泌物多、黄等症状。术后注意事项:术后禁性生活2~3个月,注意外阴清洁。术后随访日期及内容:术后第1、2、3个月每月复诊1次,询问并记录阴道出血、分泌物、宫颈修复情况。有出血多、阴道分泌物有异味、下腹痛等不适随诊。术后半年复查TCT和HR-HPV检测,按复查结果给予相应指导及处理。
2 结果
2.1 手术后随访情况 本组有6例术后3 d内出血量较多,给予创面上云南白药并碘伏纱条压迫创面24 h取出,及/或再次用球形电极电凝后血止。另有3例阴道分泌物有异味,给予来院局部消毒、清洗并再继续阴道后窟窿放置保妇康栓,口服抗菌素及妇科千金胶囊。
2.2 LEEP术后病理结果及疗效 本资料中,LEEP术后病理诊断:12例CINⅢ,2例LEEP术后病理切缘阴性患者及1例原位腺癌患者要求行子宫切除术;另2例切缘阳性,其中1例原位腺癌累及腺体、1例早期浸润癌给予相应治疗。共有98例复查TCT及HR-HPV,2例残留CINⅠ病灶,3例残留CINⅡ,其中阴性93例,1次性成功率达94.90%(93/98)。3例残留为CINⅡ再次行LEEP治疗,2例再次LEEP术后病理切缘阴性,另1例目前仍在随访中。
2.3 术前阴道镜下活检与LEEP术后病理结果比较 LEEP术后病理诊断与阴道镜下活检病理诊断相符者70例,占66.67%,不相符者35例,占33.33%,病理级别上升18例(17.14%),其中LEEP术后病理诊断升高为子宫颈原位腺癌及早期浸润癌共3例,占2.857%,诊断降低17例,占16.19%。以级别高的病理诊断为最终诊断。
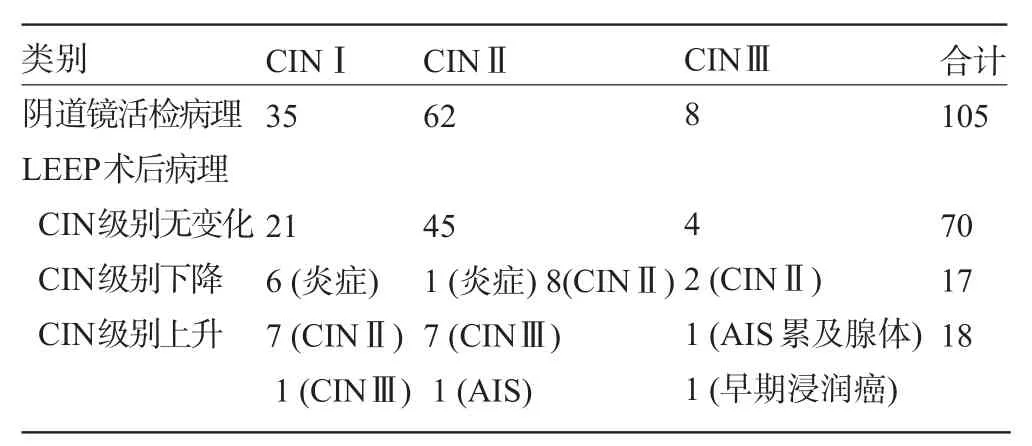
表1 105例患者阴道镜下活检病理结果与LEEP术后病理结果比较(例)
3 讨论
3.1 CIN1处理问题 随着宫颈癌筛查工作的广泛开展,诊断出的CIN不断增多,对其适当的诊治值得临床工作者的重视[1]。CINⅠ、CINⅡ、CINⅢ发展为宫颈癌的危险性分别为15%、30%、45%。CIN如不及时治疗将有可能发展为宫颈癌。宫颈活检诊断为CINⅡ~Ⅲ给予治疗已明确,但因CINⅠ有较高的转阴率,是否接受治疗争议较大。Szurkus等[2]通过对104例因CINⅠ级行LEEP治疗,组织病理学检查发现63例为CINⅡ级,1例为浸润癌,本资料显示:阴道镜活检确认为CINⅠ35例LEEP术后有8例为宫颈上皮内高度病变,CINⅠ级别上升者占22.86%(8/35),均为HR-HPV阳性。赵继红等[3]阐明宫颈中度以上程度病变的患者高危型HPV平均感染率为94.3%,证证了HR-HPV是CINⅡ~Ⅲ的主要致病因素,而HR-HPV阴性者患CINⅡ~Ⅲ的阴性预测值的99.1%[4],故HR-HPV阴性者患CINⅡ~Ⅲ的风险几乎为零。级别未上升者CINⅠ为HR-HPV阴性,考虑为一般炎症所致。故建议对CIN I的患者,HR-HPV阳性,在征得病人的同意下,实施LEEP治疗可以避免因阴道镜活检造成的更高级别的CIN,甚至宫颈癌的漏诊,使其得到及时的治疗。
3.2 阴道镜活检病理LEEP术后病理不符问题本资料LEEP术后与阴道镜活检病理诊断相符者70例(66.67%),这可能与阴道镜下多点活检时已切除了局灶性病变并刺激了人体免疫功能清除了残留病灶,起到了治疗作用。另外CIN本身的逆转或自愈也是一种可能。另有病理级别上升18例(17.14%),其中LEEP术后病理诊断升高为子宫颈原位腺癌及早期浸润癌共3例,占2.857%。由于CIN多为多中心病变,点活检的范围小,容易遗漏;官颈病变具有延续性,点活检取材部位可能不够精确;此外,部分患者子宫颈移行带区回缩到宫颈管内。这些都会造成阴道镜下多点活检取材后出现漏诊[5]。研究表明,阴道镜下多点活检的准确性为66%~84%[6]。阴道镜下多点活检病理学诊断仍有漏诊的可能。故阴道镜下多点活检病理诊断不能作为CIN最后诊断。而LEEP能切除足够的宫颈管组织送病检,减少漏诊,应结合LEEP治疗并送病理检查对CIN作最终诊断和治疗。对活组织检查诊断为高级别CIN者,推荐以LEEP除外浸润癌。
3.3 LEEP术的优越性 LEEP手术采用高频电刀,由电极尖端产生3.8 MHz的超高频电波,在接触身体的瞬间,由组织本身产生阻抗,吸收此电波产生高热,来达到各种切割止血的手术目的。宫颈LEEP术在阴道镜放大条件下直视进行,能准确地切除病变组织,是一种微创治疗手段,在许多方面优于传统的治疗方法[7]。LEEP与传统冷刀相比可以达到传统电刀达不到的精细手术效果,不会发生传统电刀的组织拉扯、炭化现象,不影响组织标本的病理检查结果,对邻近组织伤害小。何素芬等[8]总结出宫颈LEEP术治愈率高达98.6%,本文显示一次性治疗愈率达94.90%(93/98),大致与文献相同。
LEEP术操作简便、损伤小,手术时间短,对于CIN可诊断和治疗一次进行,在诊治CIN及早期宫颈癌诊断方面,值得推广。
[1]Behtash N,Mehrdad N.Cervical cancer:screening and prevention[J].Asian Pac J Cancer Prev,2006,7(4):683.
[2]Szurkus DC,Harrison TA.Loop excision for high-grade squamous intraepithelial lesion on cytology:correlation with colposcopic and histologic findings[J].Am J Obstet Gynecol,2003,188(5):1180-1182.
[3]赵继红,卢义生,王晓文,等.高危型人类乳头瘤病毒的检测在宫颈癌筛查中的应用[J].海南医学,2009,20(6):19-21.
[4]王晓黎,崔红梅,刘 青,等.HR-HPV检测、宫颈液基细胞学检查对宫颈病变筛查的评价[J].实用妇产科杂志,2010,26(8):588-591.
[5]Le T,Hopkins L,Menard C.Psychologic morbidities prior to loop electrosurgical excision procecdure in the treatment of cervical intraepithelial neoplasis[J].Int J Gynecol Cancer,2006,16(3):1089.
[6]Thomas CW,Thomas C,Stewart M,et al.Consensus guidelines for the management of women with cervical intraepithelial neoplasia[J].Am J Obstet Gynecol,2003,189:295-304.
[7]Bretelle F,Agostini A,Rojat-Habib MC,et al.The role of frozen section examination of conisations in themanagement of women with cervical intraepithelial neoplasia[J].BJOG,2003,110(4):364-370.
[8]何素芬,金绍辉,唐良萏,等.LEEP术治疗宫颈上皮内瘤变的临床观察[J].重庆医学,2009,38(10):1235-1237.

